Bệnh hô hấp
Đánh giá cập nhật về chiến lược thông khí hướng dẫn bằng áp lực đẩy và ứng dụng lâm sàng của nó
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Đánh giá cập nhật về chiến lược thông khí hướng dẫn bằng áp lực đẩy và ứng dụng lâm sàng của nó. Tải về file pdf ở đây.
Dịch bài: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Các chiến lược thông khí bảo vệ phổi (lung- protective ventilation strategies − LPVS) truyền thống hiện đang được sử dụng để giảm tỷ lệ biến chứng phổi sau phẫu thuật (postoperative pulmonary complications − PPC), bao gồm thể tích khí lưu thông (VT) thấp, áp lực dương cuối kỳ thở ra (PEEP), áp lực bình nguyên hít vào (Pplat) thấp, tăng CO2 máu chấp nhận (permissive hypercapnia) và thủ thuật huy động (recruitment maneuver − RM). Tuy nhiên, một phân tích tổng hợp cho thấy áp lực đẩy cao có liên quan chặt chẽ với tỷ lệ mắc PPC, nhưng không liên quan đến PEEP hoặc VT, dẫn đến chiến lược thông khí được hướng dẫn bằng áp lực đẩy. Một số nghiên cứu đã chứng minh rằng chiến lược thông khí hướng dẫn bằng áp lực đẩy vượt trội so với LPVS truyền thống trong việc giảm tỷ lệ mắc PPC. Mục đích của bài đánh giá này là trình bày tiến độ nghiên cứu hiện tại và ứng dụng của chiến lược thông khí hướng dẫn bằng áp lực đẩy.
Giới thiệu
Hiện nay, hầu hết bệnh nhân được gây mê toàn thân đều cần thở máy, điều này một mặt tạo thuận lợi cho việc quản lý bệnh nhân và mặt khác dẫn đến tổn thương phổi do thở máy (ventilator- induced lung injury − VILI) [1]. Các cơ chế chính của VILI bao gồm chấn thương khí áp, chấn thương thể tích, chấn thương xẹp phổi và chấn thương sinh học [2], sẽ làm tăng tỷ lệ biến chứng phổi sau phẫu thuật (PPC), khó rút ống nội khí quản, kéo dài thời gian nằm viện và tăng tỷ lệ tử vong [3]. Hiện tại, các chiến lược thông khí bảo vệ phổi truyền thống (LPVS) thường được sử dụng để giảm tỷ lệ mắc PPC, bao gồm thể tích khí lưu thông (VT) thấp, áp lực dương cuối kỳ thở ra (PEEP), áp lực bình nguyên hít vào (Pplat) thấp, tăng CO2 máu chấp nhận và thủ thuật huy động (RM) [4].
Nhiều nghiên cứu [5 – 7] đã chỉ ra rằng LPVS truyền thống có thể làm giảm tỷ lệ mắc PPC. Tuy nhiên, một phân tích tổng hợp được thực hiện bởi Amato [8] cho thấy áp lực đẩy cao hơn có liên quan chặt chẽ đến tỷ lệ mắc PPC, chứ không phải với VT và PEEP, hoặc chỉ ở mức độ thay đổi VT và PEEP ảnh hưởng đến áp lực đẩy. Do đó, một chiến lược thông khí hướng dẫn bằng áp lực đẩy đã được phát triển để giảm thiểu áp lực đẩy trong quá trình thở máy để giảm tỷ lệ mắc PPC.
Trong bài báo này, tiến trình nghiên cứu về chiến lược thông khí hướng dẫn áp lực trong những năm gần đây được xem xét, để cung cấp tài liệu tham khảo cho thở máy lâm sàng và nghiên cứu trong tương lai.
Khái niệm và ý nghĩa của áp lực đẩy
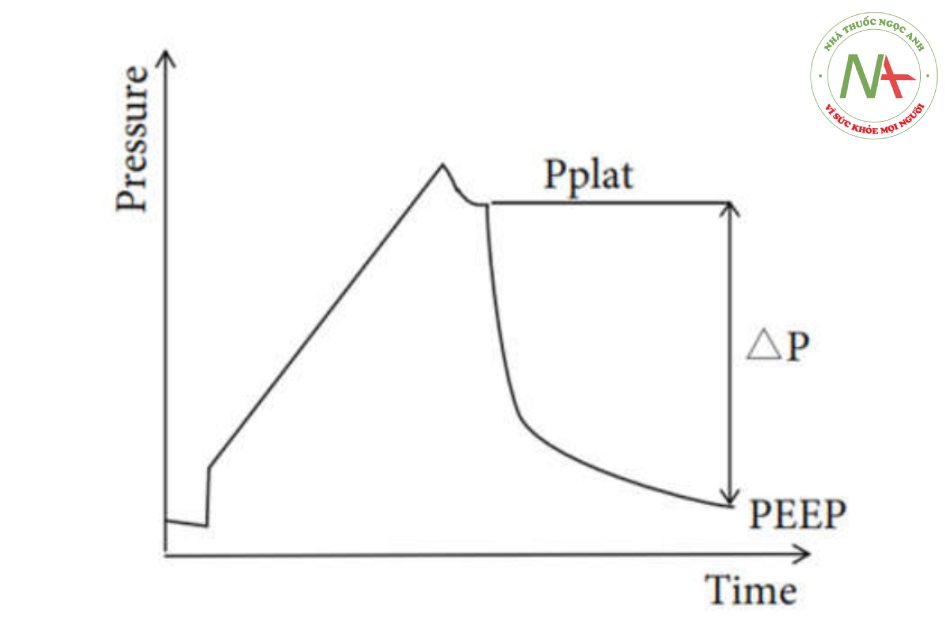
Áp lực đẩy, được định nghĩa là VT chia cho độ giãn nở của hô hấp, được điều chỉnh để chống lại lực cản đàn hồi của hệ hô hấp để mở rộng lồng ngực và phổi [9]. Khi thông khí cơ học được thực hiện mà không có hô hấp tự phát, cách tính áp lực đẩy đơn giản là Pplat–PEEP (Hình 1) [10], do đó, khi VT được đặt, áp lực đẩy càng thấp thì toàn bộ hệ thống hô hấp càng có độ giãn nở cao hơn. “Kích thước phổi chức năng” [11] đề cập đến thể tích phổi được thông khí tại một VT nhất định. Thông khí trên thể tích này sẽ dẫn đến chấn thương khí áp, trong khi thông khí dưới thể tích này sẽ dẫn đến xẹp phổi. Độ giãn nở hô hấp được tối đa hóa khi thông khí được thực hiện theo “kích thước phổi chức năng”, điều này có thể tránh được việc căng giãn phế nang quá mức hoặc thông khí không đủ. Khi sử dụng chiến lược thông khí hướng dẫn bằng áp lực đẩy, áp lực đẩy có thể được giữ ở mức thấp hơn để đạt được độ
giãn nở hô hấp cao hơn và trạng thái “kích thước phổi chức năng”. Hiện tại, chiến lược thông khí được hướng dẫn bằng áp lực đẩy thường được thực hiện thông qua cài đặt PEEP bằng thuật toán Pplat-PEEP đơn giản hóa của áp lực đẩy.
Hình 1. Đường cong áp lực-thời gian của thở máy. DP = áp lực đẩy = Pplat – PEEP.
Mối quan hệ giữa stress phổi, strain phổi và áp lực đẩy
Stress phổi đề cập đến phản lực do mô phổi tạo ra trên một đơn vị diện tích khi lực căng tác động lên mô phổi, có độ lớn bằng áp lực xuyên phổi nhưng ngược chiều [12]. Strain phổi đề cập đến tỷ lệ thay đổi thể tích phổi so với thể tích phổi tham chiếu trong quá trình hô hấp; hiện tại, dung tích cặn chức năng (FRC) thường được sử dụng thay cho thể tích phổi tham chiếu [13]. Stress phổi = strain phổi K (độ đàn hồi phổi đặc hiệu)[12]. Áp lực đẩy có thể được chia thành hai phần, một là áp lực đẩy xuyên phổi và phần còn lại là áp lực đẩy xuyên thành ngực. Trong trường hợp không có hô hấp tự nhiên và độ đàn hồi thành ngực của bệnh nhân bình thường, sức cản đàn hồi không thay đổi đáng kể, sự thay đổi của áp lực đẩy xuyên phổi là sự thay đổi của áp lực đẩy [14], và sự thay đổi của áp lực đẩy phản ánh sự thay đổi của stress phổi, có một mối quan hệ tuyến tính với strain phổi. Do đó, áp lực đẩy có thể phản ánh sự thay đổi của stress phổi và strain phổi, đây là những yếu tố quan trọng dẫn đến VILI.
Protti và cộng sự [15] đã thử nghiệm về tác động của các strain phổi và stress phổi khác nhau đối với VILI của động vật được thở máy. Mức độ nghiêm trọng của VILI được đánh giá bằng sự thay đổi trọng lượng phổi. Kết quả cho thấy trọng lượng phổi của động vật thở máy không tăng khi strain phổi nhỏ hơn 1,0, stress phổi tương ứng nhỏ hơn 6 cmH2O; khi strain phổi lớn hơn 2,1, stress phổi tương ứng lớn hơn 13 cmH2O, trọng lượng phổi của động vật khi thở máy tăng lên đáng kể; và strain phổi 1,0 ~ 2,1, tương ứng stress phổi 6 ~ 13 cmH2O không rõ ràng, an toàn hay có hại. Nghiên cứu chứng minh rằng stress phổi và strain phổi đóng một vai trò quan trọng trong sự xuất hiện của VILI khi trên một ngưỡng nhất định sẽ dẫn đến sự hình thành phù phổi.
Chiumello và cộng sự [16] đã tiến hành một nghiên cứu hồi cứu về mối tương quan giữa áp lực đẩy và stress phổi trên tổng số 150 bệnh nhân ARDS. Stress phổi, áp lực đẩy và độ đàn hồi của phổi và thành ngực được ghi lại ở PEEP là 5 cmH2O và PEEP là 15 cmH2O trong khi thở máy. Kết quả cho thấy áp lực đẩy có tương quan đáng kể với stress phổi ở cả hai mức PEEP và áp lực đẩy cao dẫn đến stress phổi cao.
Các kết quả trên chỉ ra rằng chiến lược thông khí hướng dẫn bằng áp lực đẩy có thể làm giảm stress phổi và strain phổi bằng cách duy trì áp lực đẩy thấp trong quá trình thở máy, do đó làm giảm mức độ nghiêm trọng của VILI và đạt được mục đích giảm PPC.
Phương pháp đo áp lực đẩy
Không thở tự nhiên
Đối với bệnh nhân thở máy, thuật toán điều khiển áp lực đơn giản hóa là Pplat − PEEP.
Thở tự nhiên
Đối với bệnh nhân thở tự nhiên, áp lực do máy thở tạo ra (Pplat − PEEP) và áp lực do cơ hô hấp tạo ra (sự thay đổi âm của áp lực màng phổi) cùng nhau hoàn thành quá trình hít vào, vì vậy phương pháp tính toán áp lực đẩy là Pplat – PEEP + D Ppleural [17].
Các phương pháp chính để giảm áp lực đẩy
Nhiều nghiên cứu lâm sàng đã chỉ ra rằng áp lực đẩy có liên quan mật thiết đến PPC và nên duy trì áp lực đẩy dưới một mức nhất định. Với sự gia tăng áp lực đẩy, tỷ lệ mắc PPC tăng lên. Do đó, cần duy trì mức áp lực đẩy thấp trong quá trình thở máy. Phần sau đây mô tả cách giảm áp lực đẩy.
PEEP
Thuật toán đơn giản hóa áp lực đẩy là Pplat – PEEP, vì vậy áp lực đẩy có thể giảm bằng cách điều chỉnh PEEP.
Ferrando và cộng sự [18] đã tiến hành một thử nghiệm về tác động của hai chế độ thở máy đối với áp lực đẩy và hiệu quả thông khí ở 36 bệnh nhân trải qua phẫu thuật bụng. Bệnh nhân ở cả hai nhóm ban đầu được cung cấp VT 6 mL/kg và PEEP là 5 cmH2O. Sau 30 phút, cả hai nhóm đều nhận được RM, nhóm đối chứng tiếp tục với PEEP là 5 cmH2O và nhóm còn lại nhận được PEEP cá nhân hóa cài đặt. Kết quả cho thấy áp lực đẩy của bệnh nhân trong nhóm kiểm soát và nhóm PEEP cá nhân hóa là 7,4 ± 1 cmH2O vs. 5,6 ± 1 cmH2O (p < 0.001). So với nhóm đối chứng, độ giãn nở phổi động của nhóm PEEP được cá nhân hóa đã tăng 22% và áp lực đẩy giảm 28%.
Pereira và cộng sự [19] đã tiến hành thử nghiệm PEEP cá nhân hóa trong quá trình thở máy để giảm xẹp phổi sau phẫu thuật ở 40 bệnh nhân trải qua phẫu thuật bụng. Nhóm đối chứng duy trì PEEP ở mức 4 cmH2O trong phẫu thuật. Một nhóm bệnh nhân khác được cài đặt PEEP cá nhân hóa và mức PEEP được xác định bằng chụp cắt lớp trở kháng điện sau RM. Kết quả cho thấy áp lực đẩy của bệnh nhân trong nhóm kiểm soát và nhóm PEEP cá nhân hóa là 11,6 ± 3,8 cmH2O vs. 8,0 ± 1,7 cmH2O (p < 0.001). Áp lực đẩy của bệnh nhân trong nhóm PEEP cá nhân thấp hơn, oxygen hóa được cải thiện và tỷ lệ xẹp phổi sau phẫu thuật giảm.
Park và cộng sự [11] đã tiến hành một thử nghiệm về tác động của LPVS thông thường và chiến lược thông khí được hướng dẫn bằng áp lực đẩy đối với tỷ lệ mắc PPC. Tổng cộng có 292 bệnh nhân được thông khí một phổi trong phẫu thuật lồng ngực đã được ghi danh. Nhóm LPVS thông thường nhận được VT 6 mL/kg, PEEP 5 cmH2O và RM. Nhóm chiến lược thông khí được hướng dẫn bằng áp lực đẩy đã chấp nhận cùng một VT, RM và đặt PEEP theo áp lực đẩy thấp nhất. Kết quả cho thấy áp lực đẩy trung bình (khoảng tứ phân vị) của bệnh nhân trong nhóm LPVS thông thường và nhóm chiến lược thông khí hướng dẫn áp lực đẩy là 10 (9,11) cmH2O so với 9 (8,10) cmH2O (p < 0.001), và tỷ lệ mắc PPC là 12,2% so với 5,5% (p = 0,047). Chiến lược thông khí hướng dẫn áp lực đẩy có thể giảm tỷ lệ mắc PPC trong khi vẫn duy trì áp lực đẩy thấp trong quá trình vận hành so với LPVS truyền thống.
Tất cả các kết quả nghiên cứu trên cho thấy cài đặt PEEP có thể làm giảm áp lực đẩy, đây có thể là hướng lựa chọn PEEP cho thở máy trong tương lai.
VT
Định nghĩa về áp lực đẩy là VT chia cho độ giãn nở của hô hấp và về mặt lý thuyết, VT thích hợp có thể làm giảm áp lực đẩy. Quá nhiều VT có thể gây ra sự giãn nở quá mức của phế nang, dẫn đến chấn thương khí áp và một loạt các yếu tố gây viêm; VT quá nhỏ dễ dẫn đến xẹp phổi. Hiện tại, một phương pháp thiết lập VT cá nhân là cần thiết, nhưng không có nghiên cứu liên quan.
Áp dụng chiến lược thông khí được hướng dẫn bằng áp lực đẩy ở các bệnh nhân khác nhau
Bệnh nhân ARDS
Pereira và cộng sự [20] đã thực hiện một nghiên cứu so sánh tính khả thi của chiến lược thông khí với áp lực đẩy hạn chế so với LPVS thông thường ở bệnh nhân mắc ARDS. Bệnh nhân trong nhóm áp lực đẩy hạn chế có VT từ 4 ~ 8 ml/kg theo trọng lượng cơ thể dự đoán (PBW) của họ, nhắm đến áp lực đẩy là 10 cmH2O hoặc thấp nhất có thể. Nhóm LPVS truyền thống được thông khí theo giao thức ARDSNet và VT được đặt là 6 ml/kg theo PBW, nếu Pplat lớn hơn 30 cmH2O, thì VT được điều chỉnh thành 4 ml/kg. Kết quả cho thấy từ giờ đầu tiên đến ngày thứ 3, áp lực đẩy ở nhóm áp lực đẩy giới hạn thấp hơn 4,6 cmH2O so với nhóm LPVS thông thường (p < 0.001), và VT cũng thấp hơn so với nhóm LPVS thông thường (p < 0.001), nó gợi ý rằng đối với những bệnh nhân mắc ARDS, việc sử dụng chiến lược thông khí áp lực đẩy giới hạn là khả thi.
Rauf và cộng sự [21] đã tiến hành một nghiên cứu về tác động của áp lực đẩy đối với tỷ lệ mắc bệnh và tử vong ở trẻ em mắc ARDS. Trẻ em được nhận vào ICU được chia thành hai nhóm tùy theo áp lực đẩy động tối đa trong 24 giờ đầu tiên có lớn hơn 15 cmH2O hay không. Kết quả cho thấy trong thời gian nằm trong ICU, nhóm trẻ em có áp lực đẩy lớn hơn 15 cmH2O và nhóm trẻ em đẩy áp lực đẩy dưới 15 cmH2O có thời gian thở máy trung bình (khoảng tứ phân vị), tương ứng là 8 (6 ~ 11) so với 5 (4 ~ 6) ngày (p < 0.001), thời gian nằm viện ICU trung bình (khoảng tứ phân vị), tương ứng là 12 (8 ~ 15) ngày so với 6 ngày (5 ~ 8) (p < 0.001), số ngày không thở máy nhiều hơn ở ngày thứ 28 trung bình (khoảng tứ phân vị) là 17 (0 ~ 22) ngày so với 23 (20 ~ 24) ngày (p < 0.001). Những kết quả này chỉ ra rằng áp lực đẩy nhỏ hơn 15 cmH2O có thể làm giảm đáng kể tỷ lệ mắc bệnh ở trẻ em mắc ARDS.
Bệnh nhân không mắc ARDS
Blank và cộng sự [22] đã phân tích hồi cứu thể tích khí lưu thông trung bình và áp lực đẩy của 1019 bệnh nhân phẫu thuật lồng ngực trong quá trình thông khí hai phổi và thông khí một phổi. Kết quả cho thấy rằng áp lực đẩy là một yếu tố nguy cơ đối với bệnh tật tổng thể sau phẫu thuật (OR, 1,034; 97,5% CI, 1,001 đến 1,068). Nguy cơ mắc bệnh nghiêm trọng tăng 3,4% cho mỗi 1 cmH2O tăng của áp lực đẩy.
Neto và cộng sự [23] đã phân tích dữ liệu gộp của 17 RCT, bao gồm 2250 bệnh nhân, để điều tra tác động của thể tích khí lưu thông, PEEP và áp lực đẩy lên PPC trong quá trình thở máy. Park và cộng sự [11] đã so sánh hiệu quả của chiến lược thông khí được hướng dẫn bằng áp lực đẩy với LPVS truyền thống đối với tỷ lệ mắc PPC ở những quần thể có nguy cơ cao. Mathis và cộng sự [24] đã phân tích hồi cứu 4694 bệnh nhân trải qua phẫu thuật tim không khẩn cấp bằng phương pháp bắc cầu tim phổi. Kết quả của ba nghiên cứu này cho thấy áp lực đẩy có liên quan đến sự phát triển của PPC. Là đại diện trung gian quan trọng duy nhất của LPVS, việc giảm áp lực đẩy có thể làm giảm tỷ lệ mắc các PPC như viêm phổi và ARDS.
Những kết quả này cho thấy rằng chiến lược thông khí được hướng dẫn bằng áp lực đẩy hiện tại có lợi hơn so với LPVS truyền thống trong quá trình thở máy ở cả bệnh nhân ARDS và bệnh nhân không mắc ARDS. Chiến lược thông khí được hướng dẫn bằng áp lực đẩy có thể giảm thiểu áp lực đẩy thông qua cài đặt PEEP được cá nhân hóa, cải thiện quá trình oxygen hóa trong phẫu thuật, giảm sự xuất hiện của xẹp phổi và VILI, do đó làm giảm tỷ lệ mắc PPC.
Phương pháp thiết lập chiến lược thông khí có hướng dẫn áp lực đẩy
Park và cộng sự [11] đã chọn đặt áp lực đẩy thấp nhất trước khi rạch da sau thông khí một phổi. PEEP được tăng từ 1 cmH2O lên 10 cmH2O. Mỗi mức PEEP được duy trì trong 10 chu kỳ hô hấp và áp lực đẩy trong chu kỳ hô hấp cuối cùng được ghi lại. PEEP với áp lực đẩy thấp nhất cuối cùng đã được chọn và duy trì trong suốt quá trình thông khí một phổi.
Spadaro và cộng sự [25] đã thực hiện một nghiên cứu để so sánh sự khác biệt giữa phương pháp tăng PEEP và phương pháp giảm PEEP trong việc thiết lập áp lực đẩy tối thiểu. PEEP tăng từ 0 cmH2O lên 16 cmH2O ở nhóm tăng và PEEP giảm từ 16 cmH2O xuống 0 cmH2O ở nhóm giảm. Kết quả cho thấy áp lực đẩy trung bình (quãng bốn) của nhóm tăng và giảm là 10 (9 ~ 11) cmH2O so với 8 (7 ~ 11) cmH2O (p = 0.03). Bệnh nhân trong nhóm giảm có oxy trong phẫu thuật tốt hơn và áp lực đẩy thấp hơn.
Không có phương pháp cài đặt chiến lược thông khí hướng dẫn bằng áp lực đẩy thống nhất, nhưng bất kể phương pháp nào dựa trên áp lực đẩy tối thiểu hoặc sẽ kiểm soát áp lực đẩy ở một mức nhất định, hiện tại, chỉ có một nghiên cứu ngẫu nhiên có kiểm soát cho thấy phương pháp giảm PEEP có thể có được áp lực đẩy thấp hơn và vẫn cần nghiên cứu thêm để xác nhận.
Chúng tôi (Bệnh viện liên kết đầu tiên của Đại học Trịnh Châu) hiện đang sử dụng các phương pháp của Park, cụ thể là tăng PEEP để đặt áp lực đẩy tối thiểu. Nhưng chúng tôi đã tìm thấy một khiếm khuyết trong quá trình này. Phương pháp là chọn áp lực đẩy của chu kỳ hô hấp thứ mười, nhưng áp lực đẩy của chu kỳ thứ mười có thể thay đổi và không ổn định do nhiều yếu tố khác nhau, vì vậy chúng tôi đã thực hiện một số thay đổi. Chúng tôi cũng sẽ tăng PEEP, nhưng mỗi PEEP sẽ duy trì 13 chu kỳ hô hấp, loại bỏ 3 chu kỳ hô hấp đầu tiên, bắt đầu với chu kỳ hô hấp thứ tư, ghi lại Pplat tương ứng của mỗi chu kỳ hô hấp, tính toán và ghi lại áp lực đẩy tương ứng theo đơn giản hóa thuật toán Pplat trừ PEEP, lấy áp lực đẩy tần số cao nhất trong 10 chu kỳ hô hấp làm áp lực đẩy tương ứng với mức PEEP này,
Phạm vi áp lực đẩy an toàn
Trong nghiên cứu của Amato và cộng sự [8], người ta thấy rằng áp lực đẩy nhỏ hơn 15 cmH2O thông qua việc điều chỉnh các thông số hô hấp trong quá trình thở máy và tỷ lệ tử vong của bệnh nhân ARDS giảm đáng kể. Kết quả của một nghiên cứu về kết quả ở những bệnh nhân mắc ARDS do Bellani thực hiện [26] cho thấy những bệnh nhân có áp lực đẩy hơn 14 cmH2O vào ngày đầu tiên thở máy có kết quả tồi tệ hơn.
Hiện tại, phạm vi an toàn của áp lực đẩy vẫn chưa được xác định, nhưng dưới 15 cmH2O có thể là lựa chọn tốt hơn, vẫn cần nghiên cứu thêm để xác nhận.
Kết luận
Chiến lược thông khí được hướng dẫn bằng áp lực là một LPVS mới nổi trong những năm gần đây, có thể được sử dụng để thiết lập PEEP cho từng cá nhân. Mặc dù hiện tại vẫn còn nhiều khía cạnh chưa hoàn thiện, nhưng việc giảm tỷ lệ mắc PPC đã được xác nhận bởi nhiều nghiên cứu ngẫu nhiên có kiểm soát, nhưng cần nhiều nghiên cứu hơn để thúc đẩy ứng dụng lâm sàng của nó.
References
- Coppola, A. Caccioppola, S. Froio et al., “Effect of mechanical power on intensive care mortality in ARDS patients,” Critical Care, vol. 24, no. 1, p. 246, 2020.
- Sakuramoto, N. Shimojo, S. Jesmin et al., “Repeated open endotracheal suctioning causes gradual desaturation but does not exacerbate lung injury compared to closed endotracheal suctioning in a rabbit model of ARDS,” BMC Anesthesiology, vol. 13, no. 1, p. 47, 2013.
- Yu, J. Y. Park, D. H. Kim et al., “Incidence and risk factors of pulmonary complications after robot-assisted laparoscopic prostatectomy: a retrospective observational analysis of 2208 patients at a large single center,” Journal of Clinical Medicine, vol. 8, no. 10, p. 1509, 2019.
- Bergez, N. Fritsch, D. Tran-Van et al., “PEEP titration in moderate to severe ARDS: plateau versus transpulmonary pressure,” Annals of Intensive Care, vol. 9, no. 1, p. 81, 2019.
- Futier, J. M. Constantin, C. Paugam-Burtz et al., “A trial of intraoperative low-tidal-volume ventilation in abdominal surgery,” The New England Journal of Medicine, vol. 369, no. 5, pp. 428–437, 2013.
- M. Goldenberg, B. E. Steinberg, W. L. Lee, D. N. Wijeysundera, and B. P. Kavanagh, “Lung-protective ventilation in the operating room,” Anesthesiology, vol. 121, no. 1, pp. 184–188, 2014.
- Severgnini, G. Selmo, C. Lanza et al., “Protective mechanical ventilation during general anesthesia for open abdominal surgery improves postoperative pulmonary function,” Anesthesiology, vol. 118, no. 6, pp. 1307– 1321, 2013.
- B. Amato, M. O. Meade, A. S. Slutsky et al., “Driving pressure and survival in the acute respiratory distress syndrome,” The New England Journal of Medicine, vol. 372, no. 8, pp. 747–755, 2015.
- K. Sahetya, C. Mallow, J. E. Sevransky et al., “Association between hospital mortality and inspiratory airway pressures in mechanically ventilated patients without acute respiratory distress syndrome: a prospective cohort study,” Critical Care, vol. 23, no. 1, p. 367, 2019.
- Vaporidi, C. Psarologakis, A. Proklou et al., “Driving pressure during proportional assist ventilation: an observational study,” Annals of Intensive Care, vol. 9, no. 1, p. 1, 2019.
- Park, H. J. Ahn, J. A. Kim et al., “Driving pressure during thoracic surgery,” Anesthesiology, vol. 130, no. 3, pp. 385–393, 2019.
- Gattinoni, E. Carlesso, and P. Caironi, “Stress and strain within the lung,” Current Opinion in Critical Care, vol. 18, no. 1, pp. 42–47, 2012.
- F. Nieman, J. Satalin, P. Andrews, N. M. Habashi, and L. A. Gatto, “Lung stress, strain, and energy load: engineering concepts to understand the mechanism of ventilator-induced lung injury (VILI),” Intensive Care Medicine Experimental, vol. 4, no. 1, p. 16, 2016.
- C. Williams, G. C. Motta-Ribeiro, and M. F. Vidal Melo, “Driving pressure and transpulmonary pressure: how do we guide safe mechanical ventilation?” Anesthesiology, vol. 131, no. 1, pp. 155–163, 2019.
- Protti, M. Cressoni, A. Santini et al., “Lung stress and strain during mechanical ventilation,” American Journal of Respiratory and Critical Care Medicine, vol. 183, no. 10, pp. 1354–1362, 2011.
- Chiumello, E. Carlesso, M. Brioni, and M. Cressoni, “Airway driving pressure and lung stress in ARDS patients,” Critical Care, vol. 20, no. 1, p. 276, 2016.
- Yoshida, Y. Fujino, M. B. Amato, and B. P. Kavanagh, “Fifty years of research in ARDS. Spontaneous breathing during mechanical ventilation. Risks, mechanisms, and management,” American journal of respiratory and critical care medicine, vol. 195, no. 8, pp. 985–992, 2017.
- Ferrando, F. Suarez-Sipmann, G. Tusman et al., “Open lung approach versus standard protective strategies: effects on driving pressure and ventilatory efficiency during anesthesia – a pilot, randomized controlled trial,” PLoS One, vol. 12, no. 5, article e0177399, 2017.
- M. Pereira, M. R. Tucci, C. Morais et al., “Individual positive end-expiratory pressure settings optimize intraoperative mechanical ventilation and reduce postoperative atelectasis,” Anesthesiology, vol. 129, no. 6, pp. 1070–1081, 2018.
- L. Pereira Romano, I. S. Maia, L. N. Laranjeira et al., “Driving pressure-limited strategy for patients with acute respiratory distress syndrome. A pilot randomized clinical trial,” Annals of the American Thoracic Society, vol. 17, no. 5, pp. 596–604, 2020.
- Rauf, A. Sachdev, S. T. Venkataraman, and V. Dinand, “Dynamic airway driving pressure and outcomes in children with acute hypoxemic respiratory failure,” Respiratory Care, vol. 66, no. 3, pp. 403–409, 2021.
- S. Blank, D. A. Colquhoun, M. E. Durieux et al., “Management of one-lung ventilation,” Anesthesiology, vol. 124, no. 6, pp. 1286–1295, 2016.
- S. Neto, S. N. Hemmes, C. S. Barbas et al., “Association between driving pressure and development of postoperative pulmonary complications in patients undergoing mechanical ventilation for general anaesthesia: a
- R. Mathis, N. M. Duggal, D. S. Likosky et al., “Intraoperative mechanical ventilation and postoperative pulmonary complications after cardiac surgery,” Anesthesiology, vol. 131, no. 5, pp. 1046–1062, 2019.
- Spadaro, S. Grasso, D. S. Karbing et al., “Physiological effects of two driving pressure-based methods to set positive end-expiratory pressure during one lung ventilation,” Journal of clinical monitoring and computing, vol. 35, no. 5, pp. 1149–1157, 2021.
- Bellani, A. Grassi, S. Sosio et al., “Driving pressure is associated with outcome during assisted ventilation in acute respiratory distress syndrome,” Anesthesiology, vol. 131, no. 3, pp. 594–604, 2019.