Bệnh hô hấp
Đặc tính của tái huy động- không tái huy động phổi và việc thực hành chúng trong quản lí ARDS
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
nhathuocngocanh.com – Bài viết Đặc tính của tái huy động- không tái huy động phổi và việc thực hành chúng trong quản lí ARDS được biên dịch bởi bác sĩ Đặng Thanh Tuấn tại bệnh viện Nhi Đồng 1. Để tải file PDF của bài viết, xin vui lòng click vào link ở đây.
Tóm tắt
Các thủ thuật huy động trong ARDS được sử dụngđể cải thiện quá trình oxygen hóa và cơ học phổi bằng cách áp dụng áp lực đường thở cao để mở lại các phế nang và đường thở ngoại vi bị xẹp hoặc tắc nghẽn. Vào đầu những năm 1990, thủ thuật huy động đã trở thành đặc điểm chính của một dạng biến thể của thông khí bảo vệ phổi được gọi là thông khí phổi mở. Chiến lược này dựa trên niềm tin rằng việc đóng mở lặp đi lặp lại các khoảng khí xa gây ra chấn thương do cắt và do đó góp phần vào cả tổn thương phổi do máy thởvà tửvong do ARDS. Tuy nhiên, thửnghiệm ngẫu nhiên có đối chứng đa trung tâm lớn nhất về thông khí phổi mở trong ARDS từ trung bình đến nặng đã báo cáo rằng áp lực bình nguyên của thủ thuật huy động là 50–60 cm H2O có liên quan đến tỷ lệ tử vong cao hơn đáng kể so với thông khí bảo vệ phổi truyền thống. Mặc dù dựa trên các nghiên cứu thủ thuật huy động tiền lâm sàng và lâm sàng được tiến hành tốt, tỷ lệ tử vong cao hơn liên quan đến chiến lược thông khí phổi mở đòi hỏi phải kiểm tra lại các giả định và kết luận rút ra từ các nghiên cứu trước đó. Đánh giá tường thuật này xem xét các bằng chứng được sử dụng để thiết kế các chiến lược thủ thuật huy động. Chúng tôi cũng xem xét các bằng chứng X quang học, lưu biến học và mô bệnh học liên quan đến bản chất của tổn thương phổi và các hiện tượng huy động và mất huy động vì nó cho biết nhận thức của chúng tôi về tiềm năng huy động trong ARDS. Dữ liệu thử nghiệm lâm sàng về thông khí bảo vệ phổi chính và các dữ liệu lâm sàng khác cũng được kiểm tra để đánh giá mức độ cần thiết thực tế của thủ thuật huy động trong ARDS và liệu một nhóm nhỏ các trường hợp có thể có lợi khi theo đuổi liệu pháp thủ thuật huy động hay không. Cuối cùng, một cách tiếp cận ít triệt để hơn đối với các thủ thuật huy động được đưa ra có thể đạt được các mục tiêu của các thủ thuật huy động với ít nguy cơ gây hại hơn.
Giới thiệu
ARDS được đặc trưng bởi tính thấm bị thayđổi, phù phổi và giảm thểtích khí (tức là dung tích cặn chức năng [FRC, functional residual capacity]), dẫn đến độ giãn nở hệ thống hô hấp thấp (CRS, respiratory system compliance) và giảm oxy máu do shunt trong phổi và không phù hợp thông khí-tưới máu.1-3 Nguyên nhân gây giảm FRC bao gồm phế nang không được bơm phồng đủ (underinflated), không ổn định, dễ bị xẹp và phế nang bị xẹp hoặc mất huy động (de- recruited).4 Với sự ra đời của thông khí bảo vệ phổi (LPV, lung-protective ventilation) thể tích khí lưu thông thấp, tình trạng mất huy động phế nang trở nên trầm trọng hơn mặc dù PEEP ở mức trung bình (tức là 10 ± 4 cm H2O).5
Các thao tác huy động đảo ngược tình trạng xẹp phổi trong ARDS bằng cách tạo áp lực đường thở cao vượt qua áp lực ngưỡng mở (TOP, threshold opening pressures). Mởlại các phế nang và đường thở ngoại vi bị xẹp hoặc tắc nghẽn thường giúp cải thiện quá trình oxygen hóa và CRS, đồng thời có thể tăng cường sự thanh thải dịch phế nang.6-10 Trong lịch sử, các thủ thuật huy động bao gồm bơm phồng 40 cm H2O duy trì trong ∼ 15 giây (tức là, lực cần thiết để đạt được dung tích sống ở đối tượng bình thường) để đảo ngược xẹp phổi trong phẫu thuật và shunt trong phổi.11,12
Các thủ thuật huy động bổ trợ cho LPV lần đầu tiên được mô tả trong các nghiên cứu tiền lâm sàng ban đầu về thông khí dao động tần số cao cho tổn thương phổi cấp tính.13 Vào đầu những năm 1990, thủ thuật huy động đã trở thành đặc điểm chính của một biến thể LPV được gọi là thông khí phổi mở (OLV, open-lung ventilation).14,15 Một kỹ thuật như vậy mô tả thời gian ngắn (ví dụ, 10 phút) thở máy liên tục ở áp lực đường thở đỉnh là 55 cm H 2O và PEEP là 16 cm H2O.14 Trong những năm can thiệp tiếp theo, cơ học, sinh lý học, và hiệu quả của các thao tác huy động đã được khám phá trong nhiều nghiên cứu lâm sàng và tiền lâm sàng bằng cách sử dụng nhiều chiến lược khác nhau, cũng như các luận thuyết lý thuyết.16
Một số phát hiện này đã thông báo cho thử nghiệm kiểm soát ngẫu nhiên đa trung tâm lớn nhất vềOLV, Thửnghiệm huyđộng phếnang cho Hội chứng nguy kịch hô hấp cấp tính (ART),17 nghiên cứu thu nhận> 1.000 đối tượng mắc ARDS từ trung bình đến nặng. Bất chấp giao thức dựa trên dữ liệu, nhóm ART 17 báo cáo tỷ lệ tử vong cao hơn đáng kể ở nhóm điều trị OLV so với nhóm đối chứng sử dụng giao thức PEEP thấp hơn của Mạng lưới thử nghiệm lâm sàng ARDS của Viện Y tế Quốc gia (ARDSNet).18 Đặc biệt gây khó chịu là mặc dù lượng ôxy hóa cao hơn đáng kể và CRS ở những đối tượng được điều trị bằng OLV, nhu cầu về các liệu pháp cấp cứu không khác nhau. Điều này cho thấy rằng các thủ thuật huy động phần lớn không hiệu quả trong việc ổn định FRC. Tỷ lệ tử vong cao hơn ở nhánh OLV đã xác nhận một trong những phát hiện chính của thử nghiệm ARDSNet LPV ban đầu: cải thiện oxygen hóa không nhất thiết là một dấu hiệu hợp lệ cho các kết quả có ý nghĩa.18
Một số người đã giải thích kết quả ART để gợi ý từ bỏ các thao tác huy động trong điều trị ARDS,19 trong khi những người khác20 cho rằng các vấn đề phương pháp luận liên quan đến ART vẫn làm mờ đi cách giải thích của nó và thay vào đó họ ủng hộ cho một phân tích hậu kỳ kỹ lưỡng (theo hiểu biết của chúng tôi, vẫn chưa đã được xuất bản). Hơn nữa, sự thất bại đáng kể của một cuộc thử nghiệm dựa trên nhiều nghiên cứu sinh lý học được thực hiện tốt sẽ dẫn đến việc kiểm tra lại bản chất của việc huy động và mất huy động cũng như tính hợp lệ của các suy luận rút ra từ chúng. Bài đánh giá tường thuật này kiểm tra lại sinh lý và cơ chế của việc huy động và mất huy động trong ARDS, kết quả của chúng có thể gợi ý khi nào và cách thức các thủ thuật huy động có thể được kết hợp hợp lý hơn vào thực hành lâm sàng.
Tổng quan ngắn gọn về Thủ thuật huy động trong ARDS
Các cách tiếp cận khác nhau đối với các thủ thuật huy động đã được phát triển trong 30 năm qua (Bảng 1). Một trong những chiến lược sớm nhất và phổbiến nhất là thủ thuật bơm phồng duy trì (sustained inflation) sử dụng CPAP.15,21-24 Một chiến lược khác (tức là thông khí điều chỉnh theo biên độ- amplitude- modulated ventilation) đặt ra rằng sau khi bơm phồng sâu, hằng sốthời gian để đóng phếnang (của các đơn vị đã bị xẹp trước đó) về cơ bản dài hơn chu kỳ thở máy, do đó việc huy động đạt được từ một bơm phồng sâu duy nhất (hoặc các khoảng thời gian ngắn của PEEP tăng cao) có thể được duy trì trong một khoảng thời gian sau đó.25,26 Điều này được giả thuyết là cho phép ổn định phế nang mà không cần duy trì mức PEEP cao hơn. Các chiến lược dựa trên cách tiếp cận này bao gồm thở sâu ngắt quãng27,28 (intermittent sigh breaths) và PEEP ngắt quãng hoặc dao động (intermittent or fluctuating PEEP).29-31 Một cách tiếp cận khác là một biến thể ít mạnh mẽ hơn của kỹ thuật huy động được mô tả bởi Lachmann,14 trong đó thời gian thông khí ngắn (2 phút) ở áp lực bình nguyên (P plat) là 45 cm H2O và PEEP là 15 cm H2O được sử dụng. 32 Các lần lặp lại khác, mở rộng hơn của phương pháp này bao gồm thủ thuật huy động kéo dài 33 và thủ thuật huy động áp lực vừa phải chậm. 34 Các cách tiếp cận kéo dài khác bao gồm phương pháp thở sâu kéo dài35-37 và kỹ thuật RAMP.38,39 Bốn kỹ thuật cuối cùng này gần giống nhất với kỹ thuật hiện đang được nghiên cứu rộng rãi nhất (và là trọng tâm chính của bài tổng quan này): thủ thuật huy động theo bậc thang. 40 Tác động của các kỹ thuật này sẽ được thảo luận với nhiều chi tiết khác nhau trong suốt quá trình đánh giá này về những gì chúng tiết lộ về bản chất của huy động trong ARDS.
Các nghiên cứu về thủ thuật huy động đã phân loại các đối tượng ARDS là người đáp ứng hoặc người không đáp ứng theo sự hiện diện và mức độ cải thiện oxygen hóa, 26 thể tích phổi nghỉ,26 hoặc giảm mô phổi không được sục khí bằng cách chụp cắt lớp vi tính (CT), chụp cắt lớp trở kháng điện hoặc siêu âm. 34,41 Điều này có nghĩa là các thủ thuật huy động có số lượng ứng dụng hạn chế trong các điều kiện cụ thể không phải lúc nào cũng có thể nhận biết được tại giường. ARDS liên quan đến tổn thương biểu mô trực tiếp (tức là ARDS nguyên phát hoặc tại phổi) hoặc tổn thương nội mạc gián tiếp (tức là ARDS ngoài phổi hoặc thứ phát) đều cho thấy oxygen hóa được cải thiện sau quá trình thủ thuật huy động: những người bị tổn thương gián tiếp có xu hướng đápứng nhanh hơn cả về mức độhuy động và oxygen hóa và giảm cả sức cản và độ đàn hồi của phổi.21,27,42 Tổn thương gián tiếp thường trùng hợp với phù nề mô kẽ sớm và lực đàn hồi thành ngực cao hơn,43,44 gợi ý rằng các thủ thuật huy động có hiệu quả nhất khi xẹp phổi do nén và sung huyết là những yếu tố chính so với tình trạng ngập phế nang và đông đặc mô, những yếu tố này nổi bật hơn trong tổn thương trực tiếp như viêm phổi (xem bên dưới).
Bảng 1. Các chiến lược thủ thuật huy động khác nhau để điều trị ARDS từ trung bình đến nặng
| Thao tác | Mô tả |
| Bơm phồng duy trì | CPAP được tăng lên theo các bước 5 cm H2O sau mỗi 5–10 giây cho đến khi đạt được áp lực huy động mục tiêu là 30–50 cm H2O, và sau đó duy trì trong 30–40 giây. Phổi xẹp xuống đạt được theo cùng bước giảm áp lực đường thở cho đến khi CPAP đạt đến mức PEEP ban đầu (hoặc mức cơ sởmục tiêu mới).
Kỹ thuật này dựa trên nhiều nghiên cứu lâm sàng và tiền lâm sàng. |
| Những nhịp thở sâu ngắt quãng | 1–3 nhịp thở sâu liên tiếp, được lập trình mỗi phút nhắm vào Pplat 35–45 cm H2O. Kỹ thuật này dựa trên các nghiên cứu lâm sàng nhỏ. |
| PEEP ngắt quãng/PEEP “dao động” | Các nhịp thở liên tiếp, được lập trình trong đó PEEP được nâng từ mức cơ bản lên mức cao hơn trong một số nhịp thở/phút cụ thể (1–3 lần), vài phút một lần hoặc trong một khoảng thời gian kéo dài (6 phút).
Kỹ thuật này dựa trên một số nghiên cứu tiền lâm sàng mà không có Pplat mục tiêu và một báo cáo trường hợp với Pplat mục tiêu là 50 cm H2O trong ARDS và hội chứng khoang bụng. |
| Quy trình huy động ngắn gọn trên CMV | Thông khí kiểm soát thể tích hoặc áp lực tạo ra Pplat 45 cm H2O ở PEEP là 15 cm H2O.
Kỹ thuật này dựa trên một số nghiên cứu lâm sàng về tác động sinh lý của thủ thuật huy |
| Thủ thuật huy động kéo dài | Định kỳ lặp lại (2 phút) PEEP nâng lên đến 15 cm H2O, theo đó Pplat sau đó được tăng lên từng bước từ 30, 35 và 40 cm H2O trong các thao tác 2 phút liên tiếp.
Kỹ thuật này dựa trên một nghiên cứu tiền lâm sàng. |
| Thủ thuật huy động áp lực vừa phải chậm | PEEP được tăng lên 15 cm H2O trong 15 phút ở VT là 10 mL/kg (tạo ra Pplat ~ 27 cm H2O), và áp dụng thời gian tạm dừng cuối 7 giây trong 30 giây.
Kỹ thuật này dựa trên một nghiên cứu tiền lâm sàng |
| Nhịp thở sâu | Hai cách tiếp cận:
Kỹ thuật này dựa trên một số nghiên cứu lâm sàng nhỏ. |
| Thủ thuật huy động RAMP | Hai cách tiếp cận:
Kỹ thuật này dựa trên một nghiên cứu tiền lâm sàng. |
| Thủ thuật huy động theo bậc thang | Thông khí kiểm soát áp lực với áp lực kiểm soát cố định là 15 cm H2O bắt đầu ở PEEP là 25 cm H2O. Chiến lược này sử dụng các khoảng thời gian 2 phút xen kẽ các bước PEEP tăng dần và giảm dần, tăng dần từ 5 đến 10 và đến 15 cm H2O để đạt được Pplat 60 cm H2O.
PEEP sau thủ thuật huy động được thiết lập theo một thử nghiệm giảm dần với PEEP tối ưu được xác định là mức nằm ngay trên ngưỡng khi quan sát thấy sự suy giảm về oxygen hóa hoặc độgiãn nở. Một số cách lặp lại của phương pháp chung này tồn tại bằng cách sử dụng các mức PEEP và Pplat tối đa khác nhau (ví dụ: 25 và 45–50 cm H2O tương ứng. Kỹ thuật này dựa trên nhiều nghiên cứu lâm sàng lớn và nhỏ cũng như các nghiên cứu tiền lâm sàng. |
Vật lý và sinh lý của huy động: Áp lực và thời gian
Trọng tâm của việc huy động là tái bơm phồng phế nang. Đây là một vấn đề thuận tiện cho cuộc trò chuyện mà vô tình dẫn đến đánh giá thấp thực tế rằng tổn thương và viêm đường thở ở xa là một đặc điểm nổi bật của ARDS và không thể tách rời với tổn thương phế nang.45 Sau đây là mô tả về tác động qua lại giữa tổn thương đường thở xa và phế nang vì nó liên quan đến hiện tượng huy động. Trong phần sau mô tả những điều còn mơ hồ xung quanh thủ thuật huy động, mô tả sâu hơn về các yếu tố liên quan đến mô liên quan (tức là lưu biến học [rheology] và mô bệnh học) sẽ được cung cấp.
Tổn thương ở đường dẫn khí xa (tức là đường dẫn khí có đường kính <2 mm) trong ARDS được đặc trưng bởi hoại tử/bong tróc biểu mô tiểu phế quản và vỡ các phần đính kèm tiểu phế quản-phế nang làm mất ổn định đường thở xa.45,46 Điều này lại làm tăng sức cản của đường thở và hạn chế lưu lượng thở ra.2,47 Mở các đường thở nhỏ bị xẹp trong ARDS là một quá trình động với thời gian thay đổi phụ thuộc vào một số yếu tố, bao gồm bán kính đường thở, phần phế nang chức năng cung cấp sự ổn định đường thở khu vực (ví dụ, lực kéo thành trục hoặc kết dính), đặc điểm dịch đường thở (tức là, sức căng bề mặt và lực nhớt, cũng như độ dày của màng) và sự hiện diện của chất hoạt động bề mặt sinh học.48-51 Khi sức căng bề mặt chất lỏng lót tăng lên, TOP cũng tăngđểvượt qua nó, với áp lực bổ sung cần thiết để khắc phục lực nhớt. Khi độ nhớt của chất lỏng đường thở tăng lên, cả áp lực và thời gian cần thiết để tác động đến việc mở đường thở cũng tăng lên, điều này có thể đặc biệt khóđạt được ở đường thởngoại vi và đường thở tận.50
Liên quan đến phản ứng bình thường của phế nang đối với sự huy động, một nghiên cứu vi mô thực nghiệm về phổi khỏe mạnh bị xẹp xuống trải qua quá trình bơm phồng từng bước từ 0 đến 35 cm H2O đã quan sát thấy một kiểu hình chữ U bất thường, theo đó kích thước phế nang đầu tiên tăng lên, ổn định (ở 25 cm H 2O), và sau đó giảm xuống. Số lượng phế nang được bơm căng giảm và sau đó tăng trở lại rõ rệt ở áp lực 25–35 cm H2O, gây ra kích thước thể tích phổi tăng gấp đôi. 52 Nói cách khác, ở áp lực cao hơn, nghịch lý là các phế nang trở nên vừa nhỏ vừa nhiều hơn. Người ta đưa ra giả thuyết rằng việc kéo căng thành phế nang làm tăng đường kính của các lỗ của Kohn. Điều này đến lượt nó lại làm mỏng chất lỏng niêm mạc phế nang thường bao phủcác lỗKohn, do đó tạo điều kiện thuận lợi cho việc truyền áp lực giữa các phế nang mẹ và con liền kề và dẫn đến sự huy động của phế nang sau này.
Tuy nhiên, những điều kiện thử nghiệm này khác với những điều kiện gặp phải trong ARDS (nếu nó thực sự xảy ra trong quá trình thủ thuật huy động) có thể đòi hỏi một khoảng thời gian dài hơn. Trong ARDS giai đoạn đầu, dịch phù phổi có tính thấm bị thay đổi có chứa nồng độ protein tương tự như huyết tương.53,54 Phù phế nang giàu protein và fibrin, cùng với các gốc oxy, làm bất hoạt chất hoạt động bề mặt, dẫn đến TOP cao hơn ở cả đường thở xa và phế nang.55
Tùy thuộc vào mức độ nghiêm trọng của rò rỉ mao mạch phổi, khi tràn ngập phế nang liên quan đến các ống phế nang, sự hình thành cầu chất lỏng tăng lên theo cấp số nhân, đặc biệt khi FRC giảm và lực đàn hồi tăng lên. 56 Tổn thương và viêm biểu mô phế quản cũng xuất hiện và liên quan đến mức độ nghiêm trọng của ARDS,45,57 do đó làm tăng khả năng dịch tiết viêm gây tắc nghẽn cả lòng đường thở và lỗ của Kohn. Bởi vì độ nhớt của chất lỏng tăng lên khi nồng độ protein tăng lên,58 độ nhớt tăng của đường thở và chất lỏng lót phế nang (cùng với các mảnh vụn tế bào khác tích tụ trong khoang ngoại vi) có thể kéo dài thời gian cần thiết để đạt được sự huy động tối đa cho bất kỳ P plat mục tiêu nào trong một thủ thuật huy động.
Thời gian cần thiết để mở lại các đường thở nhỏ bị xẹp hoặc tắc nghẽn cũng phụ thuộc vào mức độ hình thành các nốt sần (menisci formation) hoặc các nút nhày bịt các đường thở bị xẹp hoặc tắc nghẽn liên tiếp, có thể được khuếch đại bởi sự hiện diện của chất nhầy trong ARDS liên quan đến viêm phổi hoặc ở những bệnh nhân có tiền sử hút thuốc nhiều.48, 50, 59 Nói cách khác, mức độ huy động báo cáo ở mức P plat trích dẫn trong nghiên cứu thủ thuật huy động đã được duy trì trong 1-2 phút không phải là bằng chứng dứt khoát của hiệu quả tối đa ở cấp độ áp lực áp dụng đó (xem dưới đây).
Các khía cạnh tạm thời của việc huy động phổi
Hai khía cạnh thời gian ảnh hưởng đến hiệu quả của việc huy động: (1) thời gian của bất kỳ thủ thuật huy động cụ thể nào, và (2) thời gian hít vào do bác sĩ thiết lập được chọn trong quá trình thủ thuật. Một số điều được thảo luận dưới đây phản ánh sựmơ hồ này về chính xác những gì xảy ra khi chúng tôi quan sát việc huy động. Một số điều này (nhưng không phải là tất cả) đã được làm rõ nhờ sự ra đời của vi mô phổi trong mô hình động vật, như đã thảo luận ở trên. Hai phần sau đây cung cấp một câu chuyện lịch sử về sự phát triển hiểu biết của chúng ta cũng như sự mơ hồ dai dẳng xung quanh việc huy động từ những năm 1960 đến những năm 1990.
Creep: Khoang phổi nhanh so với chậm
Thuật ngữ “creep” được đặt ra vào những năm 1960 để mô tả sự gia tăng thể tích dần dần lên theo thời gian khi phổi phải chịu áp lực “hằng định”.60, 61 Được gọi rộng rãi hơn là hiện tượng trễ (hysteresis) hoặc thích ứng với căng thẳng (stress adaptation), creep thể hiện cách mô, một khi đã bị biến dạng, chống lại việc quay trở lại hình dạng cũ của nó. Điều này được cho là do lực căng bề mặt thích ứng trong phổi và đặc tính đàn hồi nội tại của cả mô phổi và thành ngực (ví dụ, sự hiện diện của các sợi đàn hồi trong cơ trơn, cơ xương, dây chằng và gân) cũng như các cơ quan trong ổ bụng.61
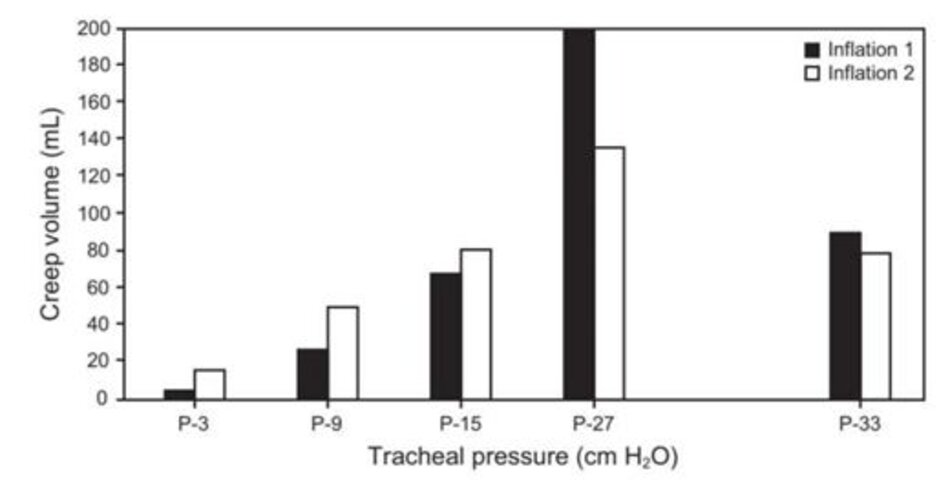
Theo sinh lý học bình thường, một quá trình 2 giai đoạn bao gồm ngăn nhanh và ngăn chậm đã được mô tả ở động vật. 60 Trong thời gian giữ bơm phồng 10 giây, giai đoạn nhanh (2 giây) ban đầu được theo sau bởi giai đoạn chậm (8 giây) là tiếp tục kéo dài mô; giai đoạn thứ hai được cho là chủ yếu do huy động phế nang và giảm sức căng bề mặt phế nang, và thay đổi ở mức độ thấp hơn trong các đặc tính đàn hồi của mô.62 Thích ứng với căng thẳng có liên quan trực tiếp đến việc tăng áp lực đẩy và đạt đến creep tối đa ở 33 cm H 2O. Cường độ bơm phồng tăng lên kéo dài (tức là 120 giâyở 33 và 39 cm H 2O) làm tăng thêm sự thích ứng với ứng suất (Hình 1).60
Sự thích ứng với căng thẳng đã được quan sát thấy ở những đối tượng bình thường được gây mê trải qua quá trình thổi phồng từng bước (tương tự như xây dựng đường cong áp lực-thể tích), ổn định ở 5–7 giây ở các thể tích khác nhau.61 Hai phần ba sự thích ứng với căng thẳng là do phổi, với thành ngực biểu hiện thời gian ngắn hơn, chậm hơn. Điều này được quy cho các đặc tính của mô trong cả hai cấu trúc chứ không phải là sự huy động phế nang và phân bố lại khí.
Bằng chứng hỗ trợ hiện tượng creep trong ARDS
Trong ARDS, sự thay đổi thể tích chậm sau khi tăng 10 cm H2O PEEP được báo cáo lần đầu tiên bởi Katz và cộng sự,4 theo đó 67% sự thay đổi thể tích xảy ra trong lần thở đầu tiên và 90% ở lần thở thứ năm. Sự gia tăng còn lại xảy ra trong hơn 40 phút và được cho là do sự thích ứng với căng thẳng hoặc sự huy động phế nang. Tương tự như các phát hiện khác,61 62% thay đổi là do phổi và 38% là do thành ngực.4
Các ngăn phổi căng lên chậm trong ARDS nặng đã được báo cáo bởi những người khác. 63 Sử dụng mức PEEP tăng thêm 5 cm H2O, chỉ 37% đối tượng có ngăn huy động chậm, trong khi 79% cho thấy ngăn mất huy động chậm, phù hợp với các nghiên cứu khác báo cáo mất huy động chậm sau khi giảm PEEP từng bước.26 Hằng số thời gian bơm phồng trung bình (τ) của ngăn chậm là 9,4 ± 7,3 giây. Khi cân bằng 95% xảy ra ở 3 τ và 99% ở 5 τ, 64 sự huy động (hoặc thích ứng với căng thẳng) của các ngăn phổi chậm sẽ đạt đến sự cân bằng thể tích 95–99% ở thời điểm trung bình 28–47 giây với giới hạn tin cậy trên 95% là 43–72 giây. Như một tài liệu tham khảo, ở những đối tượng bình thường được gây mê toàn thân, xẹp phổi đảo ngược xảy raở τ 2,6 giây (95–99% đảo ngược ở 8–13 giây).12
Ngược lại, khi oxygen hóa là yếu tố được quan tâm, thì tác động về mặt thời gian đối với việc huy động sẽ bị phóng đại. Một sốnghiên cứu đã kiểm tra thời gian cần thiết để thiết lập oxygen hóa ở trạng thái ổn định trong ARDS sau khi tăng PEEP hoặc sau khi bắt đầu thở sâu.27,65,66 Đặt PEEP trên điểm uốn dưới (PEEP 14 ± 3 cm H2O), 90% sự cải thiện tối đa xảy ra ở 20 ± 19 phút.65 Tuy nhiên, trong một nghiên cứu khác, mức tăng PEEP 10 cm H2O không tạo ra mức oxygen hóa rõ ràng (tức là, PaO2 tăng dần từ 5– 60 phút).66 Khi tăng LPV bằng cách thở sâu ngắt quãng (Pplat 45 cm H2O; PEEP 14 cm H2O), sự cải thiện tối đa xảy ra ở 30 phút đối với cả PaO 2 và thể tích phổi cuối thì thở ra.27
Một khía cạnh hấp dẫn của việc huy động là các trạng thái thoáng qua (phổi) được quan sát thấy trong ARDS khi kiểu thông khí bị thay đổi. 67 Tác động kéo dài của việc huy động đã được ghi nhận sau nhiều thao tác khác nhau, bao gồm một bước PEEP duy nhất, thủ thuật sóng PEEP (PEEP wave maneuver) và mô hình PEEP nhấp nhô (undulating PEEP pattern). Một giờ sau khi PEEP tăng từ 13 đến 21 cm H 2O, FRC đã tăng cao hơn 150% so với dự đoán của C RS của ngăn phổi nhanh (tức là phổi em bé).68 Những kết quả này tương tự như những kết quả được báo cáo bởi Katz và cộng sự.4
Trong nghiên cứu sóng PEEP, một chu kỳ lặp lại ngắn của PEEP tăng dần và giảm dần với mức thay đổi PEEP tối đa là 10 cm H 2O được lặp lại 5 lần trong vài giờ. Khi PEEP được đưa trở lại cài đặt ban đầu, PaO 2 ổn định ở mức 10 mm Hg so với đường cơ sở trước đó. Hiện tượng xảy ra với mỗi sóng PEEP liên tiếp để vào cuối quá trình thử nghiệm, PaO2 cao hơn 80 mm Hg so với giá trị cơ sở ban đầu.67
Nghiên cứu PEEP nhấp nhô đã đánh giá giới hạn trên của sự phân bố hằng số thời gian bằng cách sử dụng chu trình PEEP trên và dưới PEEP cơ bản là 14 cm H2O. PEEP được chuẩn độ theo từng bước từ 7 cm H2O đến 29 cm H 2O và giảm xuống 0 cm H2O trong 9 giờ. FRC được đo trong 1 giờ sau bất kỳ thay đổi nào của PEEP không cho thấy trạng thái ổn định về huy động hoặc mất huy động. Ấn tượng chung là “độ dài của các hằng số thời gian riêng lẻ trong ARDS có thể tồn tại trong vài giờ.”67
Huy động phổi chậm, tiến triển thường xuyên được quan sát thấy trong khi điều trị tư thế nằm sấp hỗ trợ sự tồn tại của các ngăn phổi chậm trong ARDS.69 Cải thiện ban đầu trong oxygen hóa thường xảy ra trong vòng 30-60 phút, nhưng không có gì lạ khi những cải thiện trở nên rõ ràng chỉ sau 6 giờ, với cải thiện liên tục đôi khi được quan sát thấy trong 20–36 giờ.69
Thủ thuật kéo dài thời gian huy động (tức là, 6– 14 giờ) để đảo ngược tình trạng giảm oxy máu nặng kháng trị đã được báo cáo giai đoạn trong ARDS phức tạp bởi hội chứng khoang bụng70 và béo phì rõ rệt khi kết hợp với tư thếnằm sấp. 69
Những phát hiện này nhấn mạnh sựkhác biệt đáng kể trong các khung thời gian được chọn để đánh giá phản ứng oxygen hóa sau một đợt thủ thuật huy động. Một số nghiên cứu thủ thuật huy động sẽ được thảo luận trong phần tiếp theo đã sử dụng khoảng thời gian cân bằng 2 phút giữa tất cả hoặc một số bước PEEP,17,40,71-73 phù hợp với các nghiên cứu sinh lý học cổ điển.60,67,74 Trong khi giới hạn 2 phút tối thiểu cho phép thích ứng với căng thẳng, nó cũng hạn chế việc tiếp xúc với toan hô hấp nghiêm trọng40 và khả năng mất ổn định tim mạch tiềm ẩn do thay đổi chức năng thất phải và trái. 75-78 Quan trọng nhất, những hạn chế về thời gian cần thiết do các kỹ thuật thủ thuật huy động áp lực rất cao hạn chế khả năng của chúng ta để hiểu đầy đủ về tiềm năng huy động thực tế trong ARDS.
Chọn thời gian hít vào trong quá trình huy động
Khía cạnh thời gian khác là liệu thời gian hít vào trên mỗi nhịp thở có ảnh hưởng đến hiệu quả tổng thể của một thủ thuật huy động hay không. Điều này có thểphụthuộc vào việc liệu thời gian hít vào do bác sĩ cài đặt có phù hợp với hằng số thời gian hít vào của cá thể bệnh nhân hay không. Nói chung, các đối tượng ARDS có τ hít vào 0,17–0,41 giây,2 (tùy thuộc vào mức độ nghiêm trọng của hội chứng) sẽ dẫn đến sự cân bằng ước tính 95% và 99% giữa áp lực đường thở và phế nang ở ∼0,5–1,2 giây và 0,9–2,1 giây, tương ứng. Tuy nhiên, những ước tính này dựa trên các giả định về hàm số mũ đơn của độ đàn hồi và sức cản không đổi trong suốt quá trình hít vào, và do đó bỏ qua tác động của tính không đồng nhất cơ học trong ARDS.)79 Hơn nữa, họ bỏ qua tác động của việc tiếp tục trộn khí và phân phối lại (tức là chuyển động pendelluft) và tăng thời gian khuếch tán trên cả oxygen hóa và thông khí trong khoảng chết, qua đó thường đánh giá hiệu quả của thủ thuật huy động.
Phạm vi thời gian hít vào được báo cáo trong các nghiên cứu về thủ thuật huy động đã thay đổi: 1,5 giây (bước PEEP đơn), 63 2,5 ± 1,1 giây (đối với các nhịp thở sâu),27 2–3 giây17,71,72,80 (đối với các nghiên cứu về thủ thuật huy động theo theo bậc thang hoặc không xác định), 40 trong khi những người khác sử dụng thời gian dừng cuối thì hít vào là 5-7 giây.34,81 Trong một mô hình rửa phổi của chấn thương phổi cấp tính, các nghiên cứu trên kính hiển vi in vivo về phế nang dưới màng phổi trong một thủ thuật huy động ở 40 cm H 2O đã phát hiện ra rằng, trong một khoảng thời gian 40 giây, ∼ 85% huy động xảy ra sau 2 giây. 82 Dữ liệu này hỗ trợ việc sử dụng lâm sàng thời gian hít vào từ 2–3 giây để tối đa hóa tiềm năng huy động theo từng nhịp thở trong quá trình thủ thuật huy động.
Thủ thuật huy động và mất huy động
Phần lớn các nghiên cứu sinh lý học và lâm sàng điều tra việc huy động trong ARDS đã bắt đầu một cách nghiêm túc trong thập kỷ đầu tiên của thế kỷ này và đã tạo ra phần lớn cơ sở kiến thức và bằng chứng lâm sàng hiện tại của chúng tôi. Do đó, tường thuật trong phần này chủ yếu xuất phát từ các nghiên cứu chọn lọc mà chúng tôi tin rằng tạo thành những phát hiện quan trọng nhất liên quan đến thủ thuật huy động và chuẩn độ PEEP cung cấp thông tin cho thực tiễn hiện tại.
Năm 2000, một biến thể của thao tác huy động ban đầu được sử dụng trong OLV, 14 được giới thiệu bởi Medoff và cộng sự,83 người đã áp dụng thông khí kiểm soát áp lực ở Pplat 60 cm H2O và PEEP 40 cm H2O trong 2 phút. Trong một nghiên cứu tiếp theo so sánh các thao tác huy động thông khí kiểm soát áp lực với các thao tác huy động bơm phồng bền vững (CPAP 45 cm H2O), một bài kiểm tra thông khí kiểm soát áp lực thử nghiệm kéo dài 2 phút (sử dụng Pplat thấp hơn là 45 cm H2O và thời gian hít vào là 2,5 giây) được tạo ra. Cải thiện oxygen hóa nhiều hơn đáng kể (80% so với 19%).75
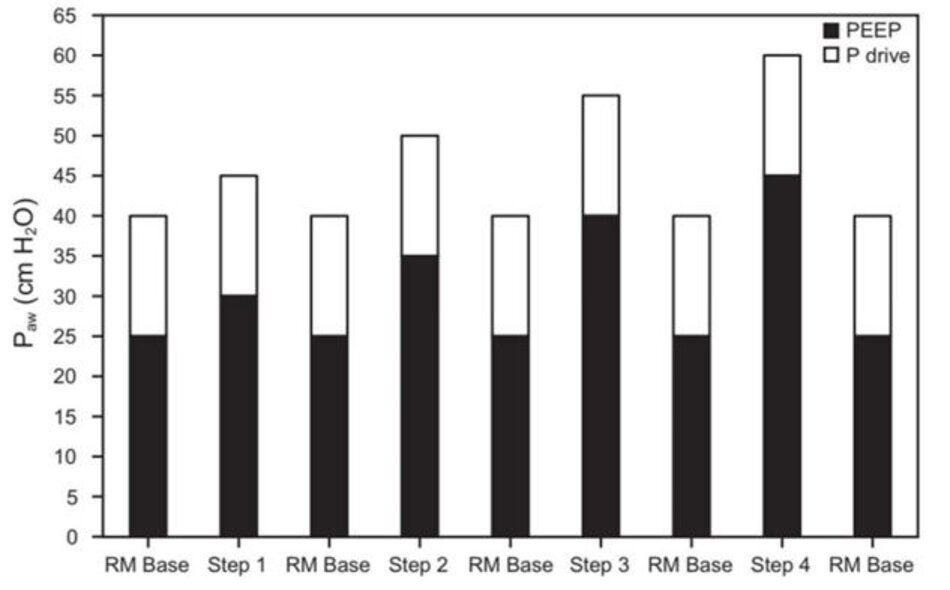
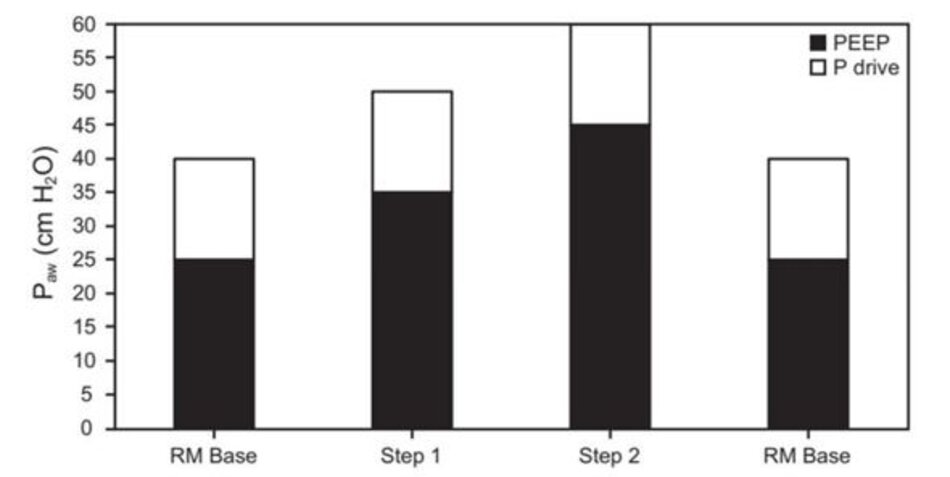
Kể từ khi báo cáo trường hợp của Medoff và cộng sự,83 phương pháp thủ thuật huy động thông khí kiểm soát áp lực đã trở thành một cách tiếp cận phổ biến và là cơ sở của chiến lược được sử dụng trong thử nghiệm ART.17 Mô tả khái quát về cách tiếp cận này như sau: Pplat ban đầu là 40 cm H2O được tăng từ từ theo từng bước từ 5 cm H2O đến mức 50 hoặc 60 cm H2O. Thủ thuật huy động được thực hiện bằng cách sử dụng 2–3 phút lên thang/giảm thang theo từng bước của siêu PEEP (tức là 20–45 cm H2O) với áp lực đẩy cố định (tức là, sự khác biệt giữa Pplat và PEEP) là 15 cm H2O (Hình 2).40,84 Điều này dựa trên các quan sát rằng TOP (Pplat là tương quan lâm sàng) tăng dần từ phổi không phụ thuộc sang phổi phụ thuộc trong khoảng 20–60 cm H2O.40,85 Một biến thể của kỹ thuật này đã được sử dụng trong thử nghiệm ART nhưng với khoảng thời gian ổn định chỉ 1 hoặc 2 phút giữa các bước (Hình 3).17
Khi xẹp phổi hấp thụ lan rộng, cần có Pplat lên đến 70 cm H2O,85 và áp lực lên đến 80 cm H2O đã được sử dụng trong ARDS liên quan đến chấn thương lồng ngực 86 hoặc hội chứng khoang bụng.70
Để đặt những áp lực bất thường này vào quan điểm, một số hơi thở sau sinh, làm giãn nở phổi không sục khí, chứa đầy một phần chất lỏng (tức là độ nhớt gấp 100 lần không khí), đòi hỏi TOP là 40 cm H2O và áp lực xuyên phổi cao nhất là 60–100 cm H2O để đạt được bơm phồng hoàn toàn.87,88 Các trường hợp đặc biệt trong những thời điểm sau khi sinh, trong đó phổi bị xẹp xuống hoàn toàn, không bị tổn thương ban đầu được mở rộng, khác biệt rõ rệt so với tổn thương phổi không đồng nhất và đường thở xa có trong ARDS (ngoài các thay đổi bệnh lý trong cơ học thành ngực). Tuy nhiên, vật lý học minh họa sự cần thiết hoàn cảnh mà đôi khi đòi hỏi phải áp dụng áp lực xuyên phổi cực kỳ cao để di chuyển chất lỏng và tái bơm phồng phổi trong những điều kiện khắc nghiệt.
Phân phối TOP và Huy động
Các nghiên cứu sinh lý học nhỏ cho thấy các mức độ huy động khác nhau xảy ra khắp phổi. Một nghiên cứu CT ban đầu báo cáo rằng phổi có khả năng huy động trong ARDS từ trung bình đến nặng trung bình là 21 ± 10% và yêu cầu Pplat 45 cm H2O (trong khi ∼ 25% vẫn bị xẹp). 80 Ngoài ra, có thể tồn tại các điểm nút theo đó chuyển tiếp huy động đầy đủ xuống phổi từ vùng giữa đến lưng khi đạt đến P plat 30, 35 và 45 cm H2O (với lượng mô không sục khí ít nhất được quan sát ở 45 cm H 2O).40,85 Các nghiên cứu tiếp theo đã khẳng định lại rằng TOP thay đổi theo trục bụng-lưng trong ARDS. Vùng trên có TOP 0– 4 cm H2O không đáng kể, trong khi vùng giữa có TOP 4–7 cm H2O và quá trình huy độngở phổi lưng bắt đầu ở ∼ 20 cm H2O.81
Tương tự như hơi thở ban đầu sau sinh, đạt được TOP trong ARDS không đồng nghĩa với việc được huy động đầy đủ. Các nghiên cứu ban đầu về đường cong áp lực-thể tích của ARDS đã giải thích điểm uốn dưới là TOP cần thiết để huy động các phế nang và đường thở ngoại vi bị xẹp xuống, nhưng nó đã bị hiểu nhầm là điểm neo để thiết lập PEEP tốt nhất.89 Sau đó, rõ ràng rằng việc huy động chỉ bắt đầu ở phía trên vùng phổi ở điểm uốn dưới và tiếp tục trong suốt nhánh hít vào của đường cong áp lực – thể tích.90,91 Tương tự như vậy, mặc dù TOP 4–7 cm H2O (giữa) và ∼ 20 cm H2O (lưng), sựhuy động tối đa ở những vùng này xảy ra ở 20 –30 cm H2O và 45 cm H2O tương ứng.81,85
Các nghiên cứu hình ảnh CT khác báo cáo rằng mô phổi không sục khí giảm dần từ 55% (ở mức thông khí ban đầu với 10 cm H2O của PEEP) xuống 23% ở P plat 40 cm H2O và 10% ở P plat 50 cm H2O.71 Cải thiện việc huy động được quan sát thấy ngay cả khi Pplat tăng từ mức cơ bản 28–32 cm H2O lên 36–41 cm H2O về cơ bản ở cùng mức PEEP 60 cm H2O chỉ làm giảm mô không sục khí 5%. Huy động đầy đủ đã được báo cáo ở P plat 40– 51 cm H2O,72 trong khi những người khác đã báo cáo tỷ lệ phần trăm đối tượng đạt được huy động đầy đủ tăng lên khi P plat tăng lên: 46% ở 40 cm H2O, ∼ 60% ở 45 cm H 2O và ∼ 70% ở 50 cm H2O).40 Trong nghiên cứu nhỏ về thời gian cải thiện FRC với PEEP ở những đối tượng bị suy hô hấp cấp tính, phần lớn trong số họ có thể đã đáp ứng định nghĩa hiện tại của ARDS, Pplat là 40 cm H2O và PEEP là 18 cm H2O là cần thiết để đưa FRC trở lại bình thường.4 Do đó, trong bối cảnh giảm oxy máu kháng trị ngay cả ở mức PEEP vừa đến cao, nên Pplat của thủ thuật huy động nhắm mục tiêu ít nhất 40 cm H2O.
Hơn nữa, có suy đoán rằng phổi có thể được huy động đại diện cho một khối mô bị viêm xung quanh một ổ chính của tổn thương có ngăn, tạo thành một hỗn hợp khoảng khí bị xẹp hoặc tràn ngập một phần.21,92 25% mô phổi không sục khí còn lại, mặc dù có áp lực huy động áp dụng 45 cm H2O,80 nhưng có khả năng biểu thị mô đông đặc, ít nhất là ở những người có thói quen cơ thể bình thường (xem bên dưới).
Giới hạn diễn giải của các nghiên cứu thủ thuật huy động
Việc diễn giải các nghiên cứu về thủ thuật huy động này đặt ra một số vấn đề. Thứ nhất, các yếu tố gây nhiễu ảnh hưởng đến hiệu quả tiềm năng của các thủ thuật huy động trong ARDS. Chúng có thể bao gồm: (1) bản chất vốn có không đồng nhất và các kiểu tổn thương phổi cấp tính giữa các bệnh nhân; (2) sự khác biệt rõ ràng trong đáp ứng với thủ thuật huy động liên quan đến bệnh lý khởi đầu (trực tiếp so với gián tiếp, phù nề mô kẽ so với phế nang) hoặc mức độ nghiêm trọng của chấn thương (ví dụ, mức độ viêm và mức độ hình thành phù); (3) thời gian thủ thuật huy động liên quan đến khởi phát hội chứng; (4) chiến lược thông khí được sử dụng trước khi bắt đầu thủ thuật huy động; (5) thay đổi cơ học thành ngực; và (6) tình trạng huyết động (ví dụ, các loại thuốc vận mạch khác nhau có thể ảnh hưởng đến cung lượng tim và phân phối lưu lượng máu ở phổi). 24,93-98 Hơn nữa, các nghiên cứu thủ thuật huy động cơ học đòi hỏi các phương pháp luận lâm sàng không thực tế phức tạp, hạn chế số lượng đối tượng có thể được nghiên cứu và do đó hạn chế tính tổng quát của kết quả đối với từng bệnh nhân.
Thứ hai, các biến được chọn để biểu thị việc huy động đầy đủ khác nhau giữa các nghiên cứu, điều này dẫn đến sự mơ hồ về diễn giải. Borges và cộng sự40 đã sử dụng PaO 2 + PaCO2> 400 mm Hg. Điều chỉnh cho phạm vi của PaCO 2 trung bình qua các bước thủ thuật huy động (70– 95 mm Hg) sẽ tạo ra PaO2 tương ứng là ∼ 300– 330 mm Hg. Povoa và cộng sự72 đã sử dụng PaO2 250 mm Hg trên FiO2 là 1, và de Matos và cộng sự71 đã báo cáo P plat mà tại đó các phế nang không thông khí là tối thiểu. Các nghiên cứu của cả Crotti cộng sự85 và Caironi cộng sự 92 chỉ đơn thuần báo cáo mức độ huy động được quan sát ở Pplat cố định là 45 cm H2O như một thước đo đại diện cho tổng dung tích phổi.
Thứ ba, trong những năm qua, các nghiên cứu về thủ thuật huy động đã sử dụng các kỹ thuật đo lường khác nhau đã ảnh hưởng đến cả kết quả và cách giải thích chúng.32 Việc huy động được suy ra từ cơ học lồng ngực (ví dụ: sự thay đổi thể tích phổi cuối kỳ thở ra được đo trong quá trình xây dựng các đường cong áp lực – thể tích hoặc sau thay đổi từng bước trong PEEP) phản ánh sự gia tăng thông khí của các phế nang được bơm phồng một phần và hoàn toàn, cũng như việc huy động các phế nang đã xẹp hoặc không sục khí trước đó. Trong bài đánh giá này, chúng tôi đã tập trung vào các nghiên cứu dựa trên CT. Mặc dù kỹ thuật này còn tồn tại những điểm mơ hồ, nhưng nó vẫn cung cấp mức độ phân biệt cao giữa các phế nang không bơm phồng, kém bơm phồng và bơm phồng tốt (xem bên dưới). Như dự đoán, việc huy động được suy ra từ phân tích cơ học lồng ngực ước tính lượng huy động lớn hơn nhiều so với việc huy động dựa trên phân tích CT.32
Tổng hợp lại, những biến số gây nhiễu tiềm ẩn này (tức là, số lượng đối tượng nghiên cứu tương đối nhỏ, sự khác biệt về cảkỹ thuật và điểm cuối chính) hạn chế khả năng tổng quát của kết quả nghiên cứu thủ thuật huy động đối với từng bệnh nhân, chưa nói đến việc điều hướng diễn giải gây tranh cãi về cách giải thích của họ.
Lý thuyết bọt biển và áp lực thủy tĩnh chồng chất
Bỏ qua các nguyên nhân thường gặp trên lâm sàng (ví dụ: ngắt kết nối máy thở, hút đàm qua nội khí quản), tình trạng mất huy động phổi trong ARDS được cho là phần lớn do áp lực thủy tĩnh chồng lên trên mô phổi phù nề bên trên và cấu trúc trung thất, cũng như tăng trọng lượng của thành ngực (ví dụ: sưng phù thành ngực, cổ trướng).94 Điều này dựa trên lý thuyết bọt biển được đưa ra để giải thích sự phân bố lại nhanh chóng mật độ phổi trên chụp CT từ vùng lưng đến vùng bụng khi đặt ở tư thế nằm sấp.76 Hai sự kiện ủng hộ quan điểm mà điều này thể hiện sự thay đổi lực hấp dẫn tác dụng lên phổi. Thứ nhất, mật độ phổi tổng thể không thay đổi, cho thấy khối lượng mô phổi (tức là phù, máu, thành phần tế bào hoặc mảnh vụn) vẫn ổn định. 99 Thứ hai, mặc dù độ thanh thải phù phổi trong ARDS bị suy giảm nghiêm trọng (6%/giờ),100 chất lỏng phù nề được loại bỏ qua hệ thống bạch huyết và không tựdo phân phối lại qua mô phổi. 99
PEEP và mất huy động
Một phát hiện lặp lại và tương đối thống nhất trong nhiều nghiên cứu về thủ thuật huy động ban đầu là, khi hệ thống thông khí được nối lại ở mức PEEP trước đó, những cải thiện về oxygen hóa sẽ tiêu tan nhanh chóng theo thời gian mặc dù PEEP cơ bản tương đối cao (∼ 12– 15 cm H2O).22,23, 27,101,102 Ngược lại, sự cải thiện oxygen hóa có thể được duy trì sau đợt thủ thuật huy động khi mức PEEP sau đợt huy động cao hơn được duy trì (ví dụ: ∼ 6–7 cm H2O trên mức cơ bản).21 Các mô hình chấn thương phổi cấp cũng báo cáo rằng oxygen hóa sau đợt thủ thuật huy động là phụ thuộc PEEP, với sựcải thiện bền vững cao nhất xảy ra ở PEEP là 16 cm H 2O (so với 12 hoặc 8 cm H2O).77 Việc cải thiện bền vững không phụ thuộc vào phương pháp thủ thuật huy động cho thấy việc huy động và mất huy động xảy ra thông qua các cơ chế khác nhau.
Khi áp lực màng phổi vượt quá áp lực phế nang ở cuối thời kỳ thở ra, hiện tượng mất huy động xảy ra theo thời gian bất kểtiền sửthểtích trước đó. 73 Trong ARDS, mất huy động là một quá trình liên tục trở nên nổi bật ở PEEP <15 cm H2O.85 Quá trình mất huy động dường như chấm dứt ở vùng phổi trên và rốn phổi ở mức PEEP 10 cm H2O, trong khi nó tiếp tục ở vùng lưng, đạt đến tốc độ xẹp tối đa ở 5 cm H 2O.85 Mô hình mất huy động cho thấy tốc độ xẹp cũng tăng khi PEEP giảm.59 Tương tự, một nghiên cứu PEEP giảm dần ghi nhận rằng áp lực màng phổi vượt quá áp lực phế nang khi PEEP giảm xuống dưới ∼ 9 ± 5 cm H2O, trong khi ở một số đối tượng, tình trạng mất huy động xảy ra ở PEEP <20 cm H2O.73
Những phát hiện này gợi ý 3 mục tiêu PEEP tiềm năng có thể làm giảm sự mất huy động trong giai đoạn cấp tính của ARDS: (1) PEEP tối thiểu là 10–12 cm H2O, (2) mục tiêu chung là 16 cm H2O và (3) ≥20 cm H 2O trong những trường hợp rất nghiêm trọng, đặc biệt là những trường hợp giảm độ giãn nở thành ngực. Điều này tương tựnhư chiến lược PEEP tốt hơn do Gattinoni và các đồng nghiệp đề xuất.103
Áp lực chồng chất, mất huy động và mức độ nghiêm trọng của ARDS
Nghiên cứu CT lớn nhất và có lẽ là toàn diện nhất đã báo cáo phạm vi tối đa của áp lực thủy tĩnh chồng lên vùng bụng-lưng là 6–18 cm H2O.94 Điều thú vị là áp lực thủy tĩnh trung bình tương tự nhau giữa các phân loại ở Berlin của ARDS nhẹ, trung bình và nặng (lần lượt là 12 ± 3, 12 ± 2, 13 ± 1 cm H2O, P =.053). PEEP được yêu cầu để chống lại cả áp lực thủy tĩnh chồng chất và độ đàn hồi thành ngực mang lại ước tính PEEP tương ứng là 16 ± 8, 16 ± 5 và 18 ± 5 cm H2O (P =.48).
Một phát hiện đặc biệt thú vị là các yêu cầu PEEP không khác nhau giữa các yêu cầu được đặc trưng là có tiềm năng huyđộng thấp hoặc cao và dựa trên quan sát rằng áp lực thủy tĩnh chồng chất tối đa giữa hai nhóm chỉ chênh lệch 1–2 cm H2O. Do đó, áp lực thủy tĩnh chồng chất và độ đàn hồi thành ngực không tương quan đáng kểvới tiềm năng huy động.
Điều này ngụ ý rằng áp lực thủy tĩnh chồng chất sẽ đi vào tính toán thiết lập PEEP để duy trì sự ổn định của phổi sau quá trình huy động hơn là gây ra hiện tượng huy động. Những quan sát này đã khiến các tác giả khuyên can các bác sĩ lâm sàng điều trị theo phản xạ khả năng huy động thấp (tức là ARDS thùy) với mức PEEP 15 cm H2O chỉ đơn giản là để ngăn ngừa chấn thương do cắt ở “một vài gam mô phổi”, do nguy cơ tổn thương huyết động cao hơn và quá căng khu vực ở vùng phổi giữa và phổi bụng.94
Tăng áp lực trong ổ bụng trong ARDS
Độ chênh lệch áp lực màng phổi vùng ngực – vùng lưng ở tư thế nằm ngửa xác định kích thước phế nang khi nghỉ ngơi và phản ánh phần lớn trọng lực do ổ bụng tác động, là một ngăn giống như chất lỏng, dày đặc hơn với thể tích gấp đôi lồng ngực chứa đầy không khí. 104,105 Áp lực ổ bụng (IAP, intra-abdominal pressure) trong lúc bình thường là ∼ 5–7 mm Hg (7–10 cm H2O), trong khi tăng áp lực trong ổ bụng được định nghĩa là IAP> 12 mm Hg (16 cm H2O) với 20–60% áp lực truyền đến lồng ngực. 106 Do đó, giảm oxy máu nặng đồng thời với tăng áp lực trong ổ bụng là một chỉ định thuyết phục cho OLVT.
Cơ học ngực-bụng, mất huy động và tăng áp lực trong bụng
IAP nâng cao dịch chuyển cơ hoành vào lồng ngực và làm cứng phần bụng của thành ngực, do đó áp lực màng phổi trở nên dương tính hơn. Điều này đặc biệt cấp tính ở vùng lưng – phía dưới ở tư thế nằm ngửa, gây giảm độ giãn nở của phổi và thành ngực, tăng sức cản của mô và đường thở, và xẹp phổi do nén. Trong những điều kiện này, phế nang bị mất huy động do nén mô (so với sự đông đặc của phế nang) có nhiều khả năng là nguyên nhân chính gây ra tình trạng giảm oxy máu kháng trị, do đó thủ thuật huy động có nhiều khả năng hiệu quả hơn.
Hội chứng khoang bụng (IAP> 25 mm Hg;> 34 cm H2O)110 liên quan đến mô phổi không sục khí và kém thông khí đáng kể (tương ứng là 23% và 18%).111 Ở những áp lực bất thường này, quán tính của hệ hô hấp, thường được coi là không đáng kể, có thể trở nên đáng kể và do đó sẽ làm tăng TOP.112 Quán tính đề cập đến gia tốc của các phân tử khí cũng như sự dịch chuyển của các mô phổi và thành ngực đang nghỉ ngơi, bao gồm cả các chất chứa trong bụng.109
Trong quá trình thở yên tĩnh với thói quen cơ thể bình thường, quán tính chiếm <5% áp lực đẩy.113 Trong bệnh béo phì, quán tính cao hơn ∼4 lần, và mô thành ngực có thểchiếm tới 68%.109 Mặc dù mức độ liên quan của nó đối với ARDS chưa được biết rõ, điều đáng chú ý là ở những đối tượng béo phì mắc bệnh, áp lực đẩy cần thiết để vượt qua quán tính trong quá trình vận động thông khí tối đa đạt tới 40 cm H 2O.109 Trong trường hợp ARDS và hội chứng khoang bụng, áp lực đẩy tương tự (P plat 80 cm H2O và PEEP 45–50 cm H2O) được yêu cầu để tăng PaO 2 từ 23 lên 350 mm Hg khi không thể cố giải nén bằng phẫu thuật.70
Tăng áp lực trong ổ bụng và ARDS
Tăng áp lực trong ổ bụng thường gặp trong ARDS108 nặng và đặc biệt phổ biến ở các trường hợp ngoài phổi.43 Nó xảy ra trong ARDS tại phổi phức tạp do bệnh lý béo phì (tức là tăng tải trọng), trong đó IAP là ∼ 12–19 cm H 2O,114 cũng như các bệnh lý khác chẳng hạn như cổ trướng do nhiễm trùng bụng, viêm tụy hoặc suy gan.115,116 Trong các mô hình tổn thương phổi cấp tính, IAP 20 cm H2O làm trầm trọng thêm sự hình thành phù phổi và tăng shunt trong phổi.117,118 IAP trung bình của ∼ 22 cm H2O43,116,119 và áp lực thực quản cuối thở ra ∼ 20 cm H2O đã được báo cáo trong các trường hợp ARDS nặng.120
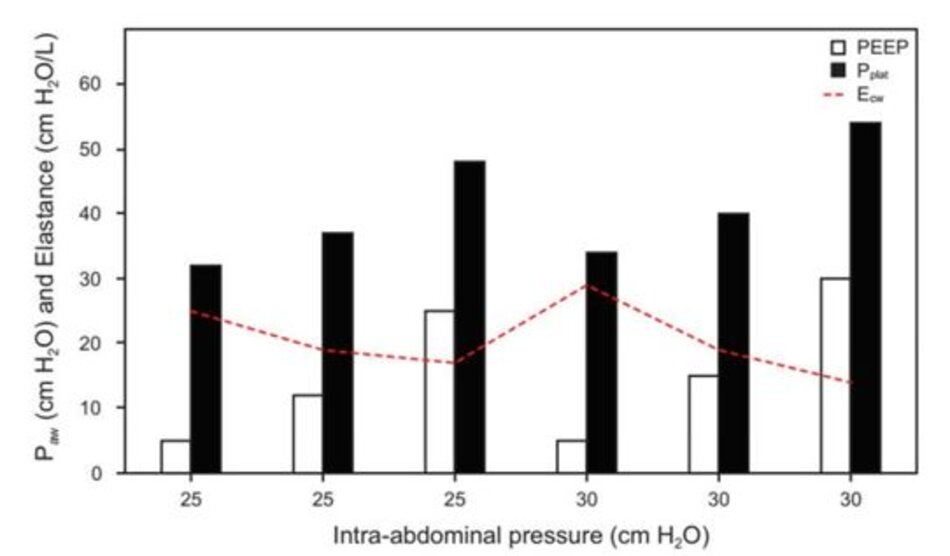
IAP đặc biệt có liên quan trong điều trị giảm oxy máu kháng trị. Một nghiên cứu tiền lâm sàng báo cáo rằng, ở IAP 24–35 cm H 2O, PEEP cao (tức là 15 cm H2O) không hiệu quả tương đương với PEEP thấp đến trung bình (tức là 5–12 cm H2O) trong việc cải thiện FRC và PaO2/FiO2.121 Điều này dẫn đến một nghiên cứu tiếp theo về PEEP phù hợp với IAP trong tổn thương phổi cấp tính có tăng áp lực trong ổ bụng (tức là 16–25 cm H2O). Cần có mức Pplat và PEEP cao hơn được sử dụng trong các chiến lược thủ thuật huy động thông khí kiểm soát áp lực được mô tả ở trên để cải thiện FRC và oxygen hóa (Hình 4).117
Đã đềxuất thêm một nửa IAP đo được vào mục tiêu áp lực thủ thuật huy động. 106 Ví dụ, áp dụng phương pháp thủ thuật huy động 45 cm H2O92 cho IAP thể hiện tình trạng tăng áp lực trong ổ bụng (16 cm H 2O), IAP trung bình trong báo cáo trong ARDS (22 cm H2O) hoặc hội chứng khoang bụng nghiêm trọng (≥ 50 cm H2O)110,122 sẽ yêu cầu điều chỉnh P plat lên tương ứng là 53, 56 và 70 cm H2O.
Thử nghiệm thủ thuật huy động ở bệnh nhân tăng áp lực trong ổ bụng đòi hỏi phải đánh giá tỷ lệ nguy cơ/lợi ích tổng thể. Áp lực màng phổi và trong ổ bụng tăng cao cản trở chức năng huyết động và dẫn lưu bạch huyết và do đó có nguy cơ làm trầm trọng thêm cả phù phổi và tăng áp lực trong ổ bụng cũng như nguy cơ suy sụp huyết động.123 Trong bối cảnh hội chứng khoang bụng, có lẽ chỉ nên xem xét huy động phế nang trong khi giải nén bằng phẫu thuật mang lại một nguy cơ thậm chí còn lớn hơn.
Tác động của PEEP đến phân phối thể tích trong ARDS
Cuối cùng, bất kể Pplat hay PEEP, sự phân phối khí trong ARDS giảm đều đặn xuống theo trục bụng-lưng với tỷ lệ phân phối thể tích phổi từ trên xuống dưới là 2,2:1 ở áp lực cuối thở ra bằng áp lực khí quyển Ở PEEP là 20 cm H 2O sự phân bố khí ở bụng-lưng về cơ bản là tương đương (1,1:1).81 Đối với vùng lưng (tức là những vùng có tác động lớn nhất đến sự traođổi khí), sự phân bố lại thể tích này chuyển thành thể tích phổi cuối thở ra tăng lên từ ∼ 10% đến 25% và tăng thể tích phổi cuối thì hít vào từ 15% lên 35%. Những phát hiện này được hỗ trợ bởi một nghiên cứu chụp cắt lớp trở kháng điện của OLV, trong đó tỷ lệ thể tích khí lưu thông ở bụng/lưng giảm từ 2,01 ± 0,36 xuống 1,19 ± 0,10 (P<0,01).124
Bản chất mơ hồ và khó hiểu của hiện tượng huy động
Trong ARDS, những cải tiến trong hình ảnh X quang, trao đổi khí và cơ học phổi trong và sau quá trình thủ thuật huy động thể hiện các phản ứng mô bệnh học phức tạp của phổi bị tổn thương và lực thành ngực đối với áp lực tác dụng, và do đó có thểgiải thíchđược. Phần này mô tả một số điểm mơ hồ hạn chế việc giải thích của chúng tôi về hiệu quả của thủ thuật huy động.
Yếu tố X quang
Chụp CT là tiêu chuẩn được chấp nhận để đánh giá sựphân bố địa hình của mô phổi có khí và không có khí trong ARDS, suy ra bởi khả năng làm suy giảm tia X của phổi. Định nghĩa X quang của sự đông đặc là sựsuy giảm phổi tăng lên rõ rệt che lấp các mạch phổi do xẹp phổi hoặc dịch đầy phế nang gây ra, trong khi trong bệnh học, thuật ngữ này đặc biệt đề cập đến dịch lấp đầy phế nang.126 Suy giảm được đo bằng thang mật độ tuyến tính Hounsfield chỉ định một giá trị số (đơn vị Hounsfield [HU]) phân biệt giữa xương (+1.000 HU), nước (0 HU) và không khí (–1,000 HU).127 Các giá trị giữa 3 điểm này được sử dụng để truyền tải các trạng thái khác nhau của mô phổi, với các giá trị từ −100 HU đến +100 HU được coi là đại diện cho mô xẹp ( Bảng 2).12,81,94,128
Bảng 2. Giải thích chức năng phổi dựa trên hình ảnh chụp cắt lớp vi tính
| Định lượng X quang, Đơn vị Hounsfield | Được sử dụng với ý nghĩa |
| +1.000 | Mật độ xương |
| 0 | Mô (được định nghĩa là 50% mô, 50% không khí) |
| —1,000 | Không khí |
| —1,000 đến —900 | Mô siêu bơm phồng |
| —900 đến —500 | Mô sục khí thông thường |
| —500 đến —100 | Mô kém sục khí |
| —100 đến +100 | Mô không sục khí |
Từ những diễn giải này, tỷ lệ khí phổi-mô được tính toán và sử dụng để suy ra đáp ứng với thủ thuật huy động và PEEP. Tuy nhiên, việc chỉ định “mô” phổi cũng bao gồm dịch ngoại mạch và máu.127 Do đó, hình ảnh CT thể hiện “lượng không khí được đưa vào phổi bị bệnh,” do đó tuyên bố, “một pixel không phải là phế nang.”115 Việc giải thích hình ảnh CT phổi dựa trên một giả định không thể chứng minh được về việc lấp đầy phế nang đồng nhất trong mô phổi cô đặc, trong khi trên thực tế, nó có thể bao gồm các phế nang đã được thông khí. 56,115 Ngoài ra, việc ước tính mức giảm mô không sục khí phụ thuộc vào số lượng phần CT được lấy mẫu (so với chụp toàn bộ phổi). Ví dụ, một phần hoành cách cạnh nhau có thể dẫn đến việc đánh giá huy động quá mức hoặc quá thấp, trong khi việc thêm các mẫu của các vùng đỉnh và vùng cao có xu hướng đánh giá thấp hơn so với việc huy động.129
Mặc dù có mối liên hệ chặt chẽ được tìm thấy giữa đánh giá X quang về sự huy động phế nang và oxygen hóa,40,130 một tương tác phức tạp của các yếu tố khác góp phần cải thiện oxygen hóa (ví dụ, tăng kết hợp thông khí-tưới máu,131 giảm cung lượng tim với tái phân phối tưới máu phổi,132 giảm hình thành phù,133 và sự phân bố lại của nó vào các khoảng quanh mạch56,134). Những người hoài nghi cho rằng bằng chứng X quang hỗ trợcho việc huy động phổi là “những suy luận về vi cơ học phế nang từ các phép đo được thực hiện trên thang đo lớn hơn vài bậc của độ lớn so với cấu trúc được quan tâm.” 135 Phần tử thể tích của hình ảnh CT (tức là voxel) là ∼ 2−2,6 mm3,32,127 trong khi một phếnang là ∼0,12 mm3.136 Như vậy, một voxel đơn lẻcó thể đại diện cho một phần mô bao gồm ∼ 15 phế nang rời rạc.
Tầm quan trọng của hạn chế này trở nên rõ ràng trong việc xác định vi hình ảnh mô phổi của động lực khí trong các cụm phế nang. Các mô hình động vật bị chấn thương phổi cấp tính đã quan sát thấy chuyển động pendelluft rõ rệt giữa các phế nang liền kề (một số phồng lên từ từ trong quá trình thở ra, một số xẹp xuống trong khi thổi phồng), cũng như huy động và mất huy động đồng thời một cách nghịch lý, trong khi các phế nang khác đồng bộ phồng lên và xẹp xuống hoặc có vẻ im lặng (tức là, bất động với một thể tích không đổi).137,138 Sự không ổn định và không đồng bộ giữa các phế nang khu trú này là kết quả của sự phụ thuộc lẫn nhau cơ học giữa các phế nang lân cận và tăng theo mức độ nghiêm trọng của tổn thương.138 Mặc dù các nghiên cứu hình ảnh CT cung cấp thông tin vô giá vềbản chất của việc huy động và mất huy động, chúng không thực tế về mặt lâm sàng đối với việc sử dụng thường quy; ngoài ra, vẫn còn sự mơ hồ mang tính giả định và do đó có nguy cơ diễn giải quá mức.
Yếu tố lưu biến học (rheologic)
Trong quá trình thở ra, hiện tượng mất huy động đường thở xa xảy ra do sức căng bề mặt ngày càng tăng làm cho các cầu nối lỏng được cải tạo, kéo đường thở và thành phế nang lại với nhau.56,139 Một nghiên cứu in vivo vềtổn thương phổi cấp tính đã xác nhận sự hiện diện của các menisci lỏng tạo thành các cầu nối dày đặc qua các đường thở ngoại vi nhỏ. 138 Do đó, cảm nhận về sự huy động phế nang ở phổi bị tổn thương nặng có thể được giải thích là sự phá vỡ cầu bọt và dịch chuyển của dịch phù phổi, dẫn đến tăng thông khí phế nang.56,135,140 Do đó, các yếu tố khác xác định lực cần thiết để mở lại phổi: lực căng bề mặt (chiếm 50-60% độ đàn hồi của phổi), sự hiện diện của chất hoạt động bề mặt sinh học (ở cả phế nang và đường thở xa), độ nhớt và độ dày của phù nề đường thở, và khắc phục sức căng trong đường thở nhỏ bị xẹp (xem bên dưới).48-50,56,139,141
Ngay cả những người ủng hộ mô hình bọt biển cũng thừa nhận rằng xẹp phổi do nén có khả năng đại diện cho sựkết hợp giữa xẹp phế nang và đường thở nhỏ. 81 Điều còn lại không thể bàn cãi là các phạm vi áp lực đường thở cụ thể và có thể tái tạo được truyền đến nhu mô phổi là cần thiết để cải thiện thông khí khu vực và trao đổi khí trong ARDS, và việc huy động các đường thở và phế nang bị xẹp hoặc tắc nghẽn luôn liên quan đến biến dạng tế bào biểu mô và do đó có thể gây ra hiện tượng chấn thương do cắt139,140 và làm trầm trọng thêm tổn thương biểu mô đường thở ban đầu liên quan đến ARDS. 45 Tổn thương nặng hơn được cho là xảy ra khi mở lại đường thở bị sụp đổ hoặc bị tắc nghẽn.140
Yếu tố mô bệnh học
Sự mơ hồ xung quanh hiệu quả và tính thích hợp của các thủ thuật huy động một phần phụ thuộc vào việc xẹp phổi (tức là phế nang đã khửkhí), phù trong phếnang (tức là cácđơn vị phế nang và đường dẫn khí ngoại vi bị ngập), hoặc phù mô kẽ là tổn thương chủ yếu gây ra giảm oxy máu kháng trị, cũng như cường độ của phù.98 Trong lịch sử, những phát hiện khám nghiệm tửthi nổi bật nhất trong ARDS ban đầu bao gồm một số sự kết hợp của phù nề mô kẽ và phế nang hoặc xuất huyết và màng hyalin,142-152 cùng với một tập hợp con đáng kể báo cáo xẹp phổi.144,145,147,149,153 Cuối cùng sẽ được gọi là ARDS, thuật ngữ xẹp phổi sung huyết được sử dụng để mô tả “sự xẹp không do tắc nghẽn lan tỏa của phế nang phổi và phù nề mô kẽ dữ dội và tắc nghẽn mao mạch phổi,”147 dẫn đến lực căng bề mặt quá mức gây ra xẹp.148 Gần đây hơn, điều này đã được định nghĩa lại là viêm (tức là sung huyết) xẹp phổi so với xẹp phổi nén.154
Những đặc điểm này xác định tổn thương phế nang lan tỏa, dấu hiệu mô bệnh học của ARDS.142 Trong tuần đầu tiên của ARDS được xác nhận với tổn thương phếnang lan tỏa, phù trong phế nang có xu hướng cao nhất (90% trường hợp) nhưng vẫn phổ biến trong những tuần tiếp theo (74% trường hợp).155 Chỉ ∼ 50% trường hợp ARDS hiện có tổn thương phế nang lan tỏa,156 sự giảm của nó trùng với sự xuất hiện của LPV.157 ARDS không có tổn thương phế nang lan tỏa có liên quan chủ yếu đến viêm phổi. Điều này được đặc trưng ít hơn bởi phù nề mô kẽ dữ dội và thâm nhiễm bạch cầu trung tính ở phế nang khu trú ở các tiểu phế quản tận cùng.156,158
Một nghiên cứu phù hợp với khả năng đáp ứng của PEEP với mẫu sinh thiết phổi và khám nghiệm tử thi đã báo cáo rằng các đối tượng biểu hiện đáp ứng oxygen hóa tối thiểu bị lấp đầy phế nang với mủ hoặc xuất huyết. Những người biểu hiện đáp ứng oxygen hóa mạnh nhất có phù phếnang ít dữdội hơn và được phân biệt bằng hình thành màng hyalin, phù mô kẽ và xẹp phổi.159
Tổn thương trực tiếp so với gián tiếp và Mức độ nghiêm trọng của tổn thương
Cả hai dạng ARDS trực tiếp và gián tiếp đều bao gồm xẹp phế nang,42 nhưng tổn thương trực tiếp (tức là biểu mô phế nang) được đặc trưng bởi sự xẹp xuống dữ dội và phù nề phế nang nhưng phù nề mô kẽ tối thiểu, trong khi tổn thương gián tiếp (tức là nội mô mao mạch) được kết hợp với mức độ dữdội phù mô kẽ hơn phù phế nang.160 Phát hiện tương tự cũng được báo cáo trong các nghiên cứu khác.126 Hơn nữa, chấn thương trực tiếp có liên quan đến tính thấm vi mạch phổi cao hơn, trong một khoảng thời gian dài, đồng thời với mức nước phổi ngoài mạch cao hơn.161 Một số bằng chứng cho thấy thủ thuật huy động (ít nhất là khi sử dụng kỹthuật bơm phồng kéo dài) có thể không hiệu quả khi có nước ngoài mạch máu phổi cao (∼ 16 mL/kg).98
Sự không nhất quán giữa các phát hiện mô học trong ARDS có thể có nhiều nguồn do số lượng mẫu hạn chế, bản chất không đồng nhất của ARDS và các tổn thương liên quan, và thời gian của nó liên quan đến khởi phát hội chứng. Không phân biệt những điều này, sựmâu thuẫn như vậy cho thấy rằng các mô hình khái niệm đơn giản hướng dẫn thủ thuật huy động có công dụng hạn chế vì những thay đổi mô bệnh học đa dạng trong ARDS cùng tồn tại trên một phổ và các tổn thương tiến triển theo thời gian.159 Hơn nữa, tổn thương trực tiếp do viêm phổi làm phá vỡ tính toàn vẹn của màng phế nang (tức là mất khả năng ngăn vi khuẩn) có thể gây ra tổn thương gián tiếp, thứ phát cho các vùng phổi không bị nhiễm trùng thông qua giải phóng cytokine toàn thân.162 Trên thực tế, một số lượng đáng kể đối tượng mắc ARDS hít sặc hoặc viêm phổi như căn nguyên chính cũng có nhiễm trùng huyết là nguồn thứ phát của tổn thương phổi (tương ứng là 20% và 40%).163
Hơn nữa, phân tích thứcấp của một số nghiên cứu CT thủ thuật huy động kết luận rằng việc huy động có khả năng được xác định nhiều hơn bởi mức độ nghiêm trọng của chấn thương và sự hình thành phù nề tương ứng hơn là cơ chế chấn thương. 93 Khi mức độ tổn thương phổi tăng lên, mức độ thấm mao mạch phổi và độ lớn của nước phổi ngoài mạch máu.164 Nói chung, bất kể cơ chế tổn thương là gì, tiềm năng huy động lớn hơn hiện diện trong ARDS được đặc trưng bởi hình mờ lan tỏa so với chủ yếu ở lưng. Thật không may, đây không phải là sự khác biệt mà các bác sĩ lâm sàng có thể thực hiện được khi X quang phổi là công cụ thực hành duy nhất có sẵn khi cân nhắc xem có nên theo đuổi điều trị giảm oxy máu kháng trị bằng thủ thuật huy động hay không.
Trong một phân tích thứ cấp của các nghiên cứu về thủ thuật huy động được đánh giá bằng CT, các ước tính về khả năng huy động thực sự cao hơn khi bị tổn thương trực tiếp. Thứ nhất, thời gian của thủ thuật huy động so với thời điểm bắt đầu ARDS ảnh hưởng đến khả năng huy động. Theo thời gian, chất lỏng phù nề chậm được tái hấp thu trong khi cơ chế sửa chữa mô và sợi đồng thời phát triển. Thứ hai, thời hạn và độ trung thực với LPV trước khi bắt đầu thủ thuật huy động sẽ ảnh hưởng đến tiềm năng huy động bất kể cơ chế chấn thương. Thứ ba, mối tương quan cao hơn giữa tổn thương trực tiếp và mức độ nghiêm trọng của ARDS có thể phản ánh mức độ lan truyền của vi khuẩn trong nhu mô phổi.93 Điều này cho thấy sự đông đặc tương đối lớn hơn trong chấn thương trực tiếp (với sự hình thành phù nề phản ứng nhanh tương ứng) có thể tạo ra phù nề lớn hơn so với tổn thương cơ quan ở xa. Tuy nhiên, các nhà điều tra nhấn mạnh rằng chấn thương ngoài phổi hoặc nhiễm trùng có thể gây ra mức độ nghiêm trọng tương đương. Do đó, khi chỉ một số ít đối tượng được nghiên cứu (tức là sai lệch lựa chọn), kết quả có thể cho thấy khả năng huy động phổi tương đương, tương đối lớn hơn hoặc tương đối thấp hơn giữa tổn thương trực tiếp và gián tiếp.
Pplat và PEEP trong LPV
Mục tiêu oxygen hóa trong LPV có xu hướng phù hợp với triết lý PEEP ít nhất, theo đó mục tiêu sử dụng PEEP thấp nhất để cung cấp PaO2 hợp lý (≥ 70 mm Hg) ở FiO 2 tương đối không độc hại (≤ 0,60).168 Chỉ khi mức độ độc hại rõ ràng của FiO2 (≥ 0,70)169 là cần thiết vì mức PEEP thường được sử dụng cao hơn (> 10 cm H2O).18
Trong LPV truyền thống, thể tích khí lưu thôngđược chuẩn độ để đạt được Pplat ≤30 cm H2O.18 Các biến thể LPV nghiêm ngặt hơn một chút đã tập trung vào việc giảm thiểu nguy cơ rối loạn chức năng thất phải và tâm phế cấp (Pplat ≤ 26 cm H2O)170,171 hoặc nguy cơ căng quá mức (Pplat ≤ 27 cm H 2O).172 Với sự không đồng nhất của ARDS và sự thay đổi lớn trong rối loạn chức năng oxygen hóa, điều quan trọng là phải có một số quan điểm về tần suất các mục tiêu LPV truyền thống không đảm bảo đủ oxygen hóaở mức tương đối không độc hại của FiO2.
Các nghiên cứu cơ học được xem xét ở trên cho thấy rằng Pplat 30 cm H2O ảnh hưởng gần như hoàn toàn việc huy động ở giữa phổi (vùng CT 4–7) và đồng thời những thay đổi gia tăng lớn nhất ở phổi lưng (vùng 8–10). Ngoài ra, sự mất huy động trở nên rõ ràng ở PEEP <15 cm H2O và đặc biệt nổi bật ở vùng lưng chỉ ở PEEP <10 cm H2O.85,92 Do đó, giả sử môi trường sống bình thường của cơ thể, PEEP là 10–15 cm H2O và Pplat từ 26–30 cm H2O xuất hiện đủ để đảm bảo đủ oxygen ở mức tương đối không độc hại của FiO2 trong phần lớn các trường hợp ARDS.
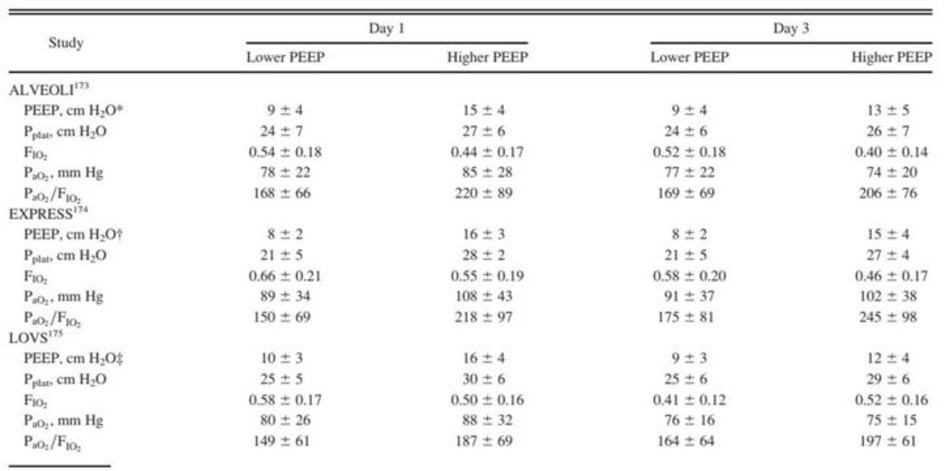
Dữ liệu từ 3 thử nghiệm LPV chính173-175 liên quan đến> 2.300 đối tượng mắc ARDS sớm so với 2 chiến lược PEEP hỗ trợ cách giải thích này. Các nghiên cứu này phát hiện ra rằng: (1) PEEP vừa phải 8–10 cm H2O tạo ra Pplat trung bình là 21–25 cm H2O và nói chung là đủ để đạt được PaO2 bình thường ở mức tương đối không độc hại của FiO2; (2) PEEP cao hơn (tức là ∼ 15 cm H2O) với Pplat trung bình <30 cm H2O được cải thiện hơn nữa PaO2 ở mức FiO2 ít độc hại hơn; và (3) vào ngày nghiên cứu thứ ba, quá trình oxygen hóa đã ổn định hoặc được cải thiện bất kể chiến lược PEEP. Những phát hiện này cho thấy rõ ràng rằng thủ thuật huy động là không cần thiết để quản lý phần lớn các trường hợp ARDS và làm tăng tỷ lệ nguy cơ/lợi ích một cách không cần thiết (Bảng 3).
Tuy nhiên, dữ liệu trung bình không thể làm sáng tỏ liệu Pplat được tạo ra bởi các mức PEEP được sử dụng trong LPV truyền thống sẽ:
(1) có khả năng đạt đến các điểm nút đề xuất của TOP liên quan đến việc huy động đầy đủ các vùng lưng hay không; (2) ước tính tỷ lệ đối tượng yêu cầu mức độ độc hại của PaO 2; và (3) đánh giá xem có bao nhiêu đối tượng sẽ là ứng viên hợp lý cho liệu pháp thủ thuật huy động. Chúng tôi đã kiểm tra những vấn đề này bằng cách truy vấn cơ sở dữ liệu được sử dụng trong các nghiên cứu trước đây của chúng tôi.163,176 Kết quả của chúng tôi được thảo luận chi tiết trong các tài liệu bổ sung trực tuyến (xem tài liệu bổ sung tại http://www.rcjournal.com); Tuy nhiên, 2 phát hiện chính là: (1) chuẩn độ thể tích khí lưu thông có hiệu quả hạn chế Pplat đến mức mong muốn mặc dù mức PEEP cao; và (2) điều này hạn chế khả năng huy động đáng kể ở phổi lưng trong tình trạng giảm oxy máu nặng kháng trị, vì ngay cả khi PEEP> 16 cm H2O chỉ có 5% đối tượng đạt ngưỡng huy động đủ cao là 45 cm H 2O. Do đó, có một nhóm nhỏ các trường hợp ARDS nặng trong đó LPV truyền thống là không đủvà thủ thuật huy động có vẻ là một lựa chọn hợp lý để đảo ngược tình trạng giảm oxy máu kháng trị.
Tối ưu hóa quá trình oxygen hóa và giảm thiểu nguy cơ mắc atelectrauma
FRC đại diện cho thể tích phế nang và là yếu tố quyết định chính của PaO2.177 Do đó, PaO2 tăng lên để đáp ứng với PEEP tăng hoặc thủ thuật huy động là một tiện ích để suy ra những thay đổi trong FRC và, nói rộng ra là nguy cơ chấn thương do cắt. Thật không may, logic liên kết 3 hiện tượng này là không ổn định.
Tùy thuộc vào Pplat, một phần đáng kể của sự gia tăng FRC sớm (tức là khoang phổi nhanh) thể hiện sự giãn nở của các phế nang được bơm phồng bình thường hoặc được bơm phồng dưới mức bình thường và không được huy động. 4 Ngoài ra, các ngưỡng PaO2/FiO2 tùy ý được sử dụng để biểu thị sựhuy động đầy đủ (tức là 250– 330 mm Hg)40,72 là sai theo nghĩa đen. Huy động đầy đủ có nghĩa là chức năng khuếch tán oxy ở phổi bình thường (ví dụ: PaO2/FiO2 ≥ 450 mm Hg). Điều này không xảy ra trong ARDS vì mức độ đông đặc mô khác nhau và phù phổi giải quyết chậm. Do đó, ngưỡng PaO2/FiO2 250–330 mm Hg được sử dụng để đánh giá hiệu quả thủ thuật huy động gợi ý một sự thừa nhận ngầm rằng thuật ngữ huy động đầy đủ có nghĩa bóng.
Ngoài những điều mơ hồ này, mấu chốt của cuộc tranh luận là: Liệu OLV có làm giảm nguy cơ chấn thương do cắt lặp đi lặp lại nhiều lần so với LPV truyền thống không? Điều này khó xảy ra đối với đa số các trường hợp ARDS. Đầu tiên, Pplat ≥ 40 cm H 2O là cần thiết để mở lại đường thở và phế nang ở xa trong phổi lưng; các đơn vị này vẫn đóng và được bảo vệ khỏi chấn thương do cắt khi Pplat được giới hạn ở ≤30 cm H2O. Thứ hai, trong ARDS, các phần đáng kể của mô phổi dường như đạt đến sự huy động đầy đủ ở Pplat ≤ 30 cm H2O, và sự ổn định của nó dường như được duy trì khi PEEP được đặt ở 10–15 cm H2O. Ngoài ra, bằng chứng từ một số nghiên cứu tiền lâm sàng cho thấy rằng các vùng xẹp phổi được bảo vệ tương đối khỏi chấn thương cắt do phù nề trong phế nang, với hầu hết các tổn thương do căng thẳng quá mức phát triển ở đường hô hấp ngoại vi. biểu hiện cytokine tiền viêm hơn là tổn thương do cắt. Thứ ba, hình ảnh vi mô của các phế nang dưới màng phổi trong các mô hình tổn thương phổi cấp tính cho thấy rằng, mặc dù mức độ ổn định của áp lực đẩy và PEEP, vẫn tồn tại các mô hình huy động và giảm huy động giữa các phế nang phụ thuộc lẫn nhau, ngay cả ở mức PEEP cao, dường như dao động từng phút.138 Do đó, khái niệm loại bỏ tình trạng giảm huyđộng và tổn thương do xẹp phổi trong ARDS có vẻ viển vông.
Các tác động của các ngăn phổi chậm
Lồng ghép các vấn đề thời gian liên quan đến việc huy động, với bằng chứng cho thấy hầu hết việc huy động xảy ra ở ≤ 50 cm H 2O và nguy cơ tử vong tăng được báo cáo trong nghiên cứu ART,17 giúp chúng ta phản ánh nhu cầu về thủ thuật huy động và cách tiếp cận tiến về phía trước. Bằng chứng thuyết phục về ngăn phổi chậm trong ARDS trái ngược với chiến lược thủ thuật huy động hiện tại và đặt ra câu hỏi liệu các giai đoạn huy động ngắn có phản ánh hiệu quả thực tế của một Pplat cụ thể hay không. Nói rộng ra, điều này ảnh hưởng đến quyết định sử dụng áp lực cao hơn với nguy cơ chấn thương và tổn thương huyết động ngày càng tăng. Hơn nữa, các nghiên cứu vềthủ thuật huyđộng cường độhạn chế như thở sâu kéo dài, kéo dài và thao tác huy động chậm vừa phải được trích dẫn ở trên tất cả đã quan sát thấy việc huy động đáng kể ở áp lực ≤ 40 cm H2O trong khoảng thời gian vài phút, không có nghiên cứu nào điều tra xem liệu một thử nghiệm kéo dài của super-PEEP giới hạn ở 25–30 cm H2O và áp lực thúc đẩy 15 cm H 2O có thể cung cấp đủ tình trạng oxygen hóa ổn định trong khoảng thời gian vài giờ.
Ngoài ra, tầm quan trọng tương đối của việc sửdụng thời gian hít vào từ2đến 3 giây trong quá trình thủ thuật huy động, mặc dù được hỗ trợ bởi dữ liệu tiền lâm sàng, vẫn chưa được đánh giá trên lâm sàng. Chiến lược này hạn chế đáng kể các thủ thuật huy động vì nó hạn chế thông khí phút trong các biểu hiện trầm trọng hơn của ARDS có liên quan đến khoảng chết sinh lý tăng cao179 và gây thêm căng thẳng cho chức năng thất phải.78,170 Trong các nghiên cứu tiền lâm sàng, thời gian hít vào là 1,4 giây nói chung là đủ 180 Trong các nghiên cứu mô tả trạng thái [phổi] thoáng qua, cũng như các trạng thái nằm sấp, cần xem xét liệu thời gian thở thích hợp hơn về mặt lâm sàng được sử dụng trong LPV, nếu không phải là tối ưu, có thể đủ để phát huy tác dụng huy động đủ theo thời gian để đạt được mục tiêu oxygen hóa.
Hậu quả huyết động của OLV
Mặc dù nó không phải là trọng tâm của tổng quan này, nhưng tỷ lệ tử vong bất ngờ cao hơn bất ngờ ở nhánh OLVT của nghiên cứu ART, và mối liên quan của nó với tỷ lệ suy giảm huyết động cao hơn, đòi hỏi một đánh giá ngắn gọn về mối quan hệ giữa hệ tim-phổi trong ARDS và tác động tiềm tàng của các chiến lược OLV. Hệ thống mạch máu phổi có chức năng như một hệ thống có sức cản thấp, điện dung cao phản ánh trong tâm thất phải có thành mỏng, hệ thống này dễ có dấu hiệu rối loạn chức năng và cuối cùng suy theo nhu cầu công việc liên tục do sức cản mạch máu phổi cao trong ARDS.170
Tăng áp động mạch phổi cấp thường phát triển trong ARDS do giảm oxy máu, tăng CO2 máu, nhiễm toan và tắc nghẽn mạch phổi do phù kẽ, và thuyên tắc động mạch và vi mạch lan tỏa.181-184 Trong điều kiện thở máy, các điều kiện về thể tích cuối thì hít vào cao (ví dụ, PEEP cao, áp lực đẩy hoặc kết hợp cả hai) làm tăng rõ rệt sức cản mạch máu phổi tác động tiêu cực đến chức năng thất phải.185-187 Chức năng thất phải bị tổn hại thêm do giảm đồng thời hồi lưu tĩnh mạch và tiền tải tâm thất. Rối loạn nhịp tim cấp tính phát triển khi tâm thất phải bị thiếu máu cục bộ do thể tích công việc quá mức kéo dài; điều này xảy ra ở 22–25% bệnh nhân ARDS, với tỷ lệ tăng lên 50% ở bệnh nhân ARDS nặng. Thuật ngữ không ổn định huyết động thoáng qua, đó là một phát hiện phổbiến trong các nghiên cứu thủ thuật huy động, 189 hoặc quan trọng hơn là khả năng gây ra các vấn đề lâu dài hơn về rối loạn chức năng thất phải và sự phát triển của mạch vành, làm tăng nguy cơ tử vong ở bệnh nhân ARDS.190
Nguy cơ tiềm ẩn của chấn thương phổi do máy thở
Một nhận xét ngắn gọn cũng có vẻ thích hợp liên quan đến nguy cơ tiềm ẩn của các chiến lược thủ thuật huy động thông khí kiểm soát áp lực đối với tổn thương phổi do máy thở. Mặc dù áp lực đẩy được kiểm soát ở mức dường như an toàn trong quá trình tăng từng bước của siêu PEEP (tức là 15 cm H2O), mức độ tổng thể của những thay đổi theo từng bước trong áp lực đường thở tăng đột ngột từ 5 hoặc 10 cm H 2O đến 20 cm H2O khi PEEP tăng từ 25đến 45 cm H2O40,72 hoặc bằng cách thay đổi liên tục gia tăng 10 cm H2O.17 Bất kể, những thao tác này lên đến đỉnh điểm tạo ra áp lực cực kỳ cao cho cuối thì hít vào là 60 cm H2O. Điều đáng quan tâm hơn là, trong các thử nghiệm giảm PEEP tiếp theo trong một số nghiên cứu, khi mức PEEP tối ưu được xác định, “bệnh nhân đã trải qua một quy trình huy động khác sử dụng cùng áp lực huy động được sử dụng trong bước cuối cùng của quy trình huy động tối đa.” 40 Quy trình này là được đưa vào thử nghiệm ART.17 Như những người khácđã lưu ý, bất kể mức độ an toàn được nhận thức của việc giới hạn áp lực đẩy xuống 15 cm H2O, có một giới hạn trên của căng thẳng phổi có thể chịu đựng được mà không dẫn đến tổn thương phổi nghiêm trọng.140 Như mô tả trong tài liệu này xem xét lại, dường như tồn tại những tình huống cần thận trọng cao trong đó điều này có thể thích hợp (ví dụ, bệnh lý béo phì, hội chứng khoang bụng), mặc dù các bác sĩ lâm sàng phải luôn nhận thức được mối nguy hiểm này.
Ý nghĩa của nghiên cứu ART
Cuối cùng, kết quả đáng thất vọng của thử nghiệm ART nhấn mạnh vấn đề lâm sàng chính của liệu pháp thủ thuật huy động trong ARDS, cụ thể là sự phụ thuộc cần thiết vào X quang phổi và các suy luận rút ra từ các nghiên cứu cơ giới hạn chế các bác sĩ lâm sàng chỉ suy đoán về khả năng thành công của điều trị. Do đó, vấn đề gây khó chịu cho các bác sĩ lâm sàng là việc phân biệt xem liệu một người không đáp ứng rõ ràng có phản ánh không đủ TOP, không đủ thời gian dành cho huy động, hay đơn giản là tiềm năng huy động kém. Từnhững gì chúng tôi có thểnhận thấy ítỏi từ thử nghiệm ART, đây dường như là những gì đã xảy ra: phần lớn các trường hợp ARDS là do chấn thương trực tiếp chỉ biểu hiện đáp ứng nhẹ với thủ thuật huy động, với tỷ lệ quá căng phổi tương ứng cao hơn (phỏng đoán từ tỷ lệ chấn thương barotrauma và cần điều trị bằng thuốc vận mạch) có liên quan đáng kể đến nguy cơ tử vong trong nhóm nghiên cứu OLV.
Như đã đề cập ở trên, tiêu chuẩn được chấp nhận để đánh giá huy động phổi là chụp CT, cung cấp thông tin tốt hơn để xácđịnh cả những bệnh nhân có nhiều khả năng được hưởng lợi nhất từ phương pháp huy động (ví dụ: mô hình tổn thương lan tỏa) và các giới hạn của Pplat và PEEP dựa trên hình ảnh thời gian thực. Thật không may, điều này là không thực tế về mặt lâm sàng, và do đó chúng tôi vẫn ở trong tình trạng khó khăn giống như các nhà điều tra nghiên cứu ART. Tuy nhiên, việc sử dụng siêu âm tại giường trong đánh giá huy động phổi là một công cụ đầy hứa hẹn và cần được đưa vào quản lý lâm sàng khi đánh giá hiệu quả của phương pháp huy động.
Tóm tắt
Trong bối cảnh ARDS nghiêm trọng, việc cân nhắc thủ thuật huy động nên được dành cho một số ít các trường hợp bị giảm oxy máu dai dẳng hoặc tái phát xảy ra bất chấp mức PEEP từ 15–20 cm H2O và cần tiếp xúc kéo dài (tức là nhiều ngày) với FiO2 ≥ 0,70 để ổn định oxy, đặc biệt bệnh nhân bị tăng áp lực trong ổ bụng hoặc béo phì nặng. Trong những trường hợp này, nguy cơ làm trầm trọng thêm tổn thương phổi do căng thẳng oxygen hóa do tiếp xúc lâu dài với mức độ độc hại của FiO2 đi vào tính toán.169 Khi IAP tăng cao không phải là một yếu tố nổi bật, một thử nghiệm kéo dài về super-PEEP và áp lực đẩy thấp tạo ra một Pplat 40–45 cm H2O (có thể kết hợp với tư thế nằm sấp) có thể là một cách tiếp cận thận trọng hơn để ổn định oxygen hóa. Cuối cùng, thủ thuật huy động ở những người bị tổn thương trực tiếp và khả năng đông đặc mô rõ rệt cao hơn có lẽ chỉ mang lại lợi ích hạn chếvà có liên quan đến nguy cơ tử vong cao hơn.
Xem thêm:
