Bệnh huyết học
Cung cấp Oxy trong điều trị thiếu máu – Bác sĩ Thành Minh Khánh
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Để tải file PDF bài viết Cung cấp Oxy trong điều trị thiếu máu hãy click tại đây.
Dịch bởi BS. Thành Minh Khánh
Đánh giá các thuốc mới được thiết kế để điều trị các tình trạng THIÊU MÁU đặc trưng phải bao gồm sự hiểu rõ ràng về sinh lý bệnh cơ bản của thiếu máu, với sự tập trung vào cải thiện cung cấp oxy. Trong bài tổng quan này, tôi thảo luận tầm quan trọng của việc cân nhắc cung cấp oxy trong điều trị thiếu máu.
SINH LÝ HỌC
Các tế bào hồng cầu người cũng như ở hầu hết các động vật có vú khác, được tự nhiên ưu đãi với đồng độ 2,3-bisphosphoglycerate (2,3-BPG) cao gấp 1000 lần so với nồng độ ở tất cả các tế bào khác và xấp xỉ bằng với nồng độ mol của hemoglobin tetramer. Chất trung gian chuyển hóa của con đường đường phân này gắn kết đặc hiệu với deoxyhemoglobin và làm giảm ái lực của nó với oxy.1 Do đó, khi hemoglobin tiếp xúc với áp suất oxy tăng, sự hiện diện của 2,3-BPG làm giảm độ bão hòa oxy phân lượng (fractional oxygen saturation) và đường cong phân ly oxy-hemoglobin được chuyển dịch sang phải.
Gần như tất cả các bệnh nhân bị thiếu máu dù bất kể nguyên nhân nào, đều có nồng độ 2,3-BPG trong hồng cầu tăng. Như được thể hiện trong Hình 1A, sự thích ứng này giúp tăng cường đáng kể việc cung cấp oxy. Ở bất kỳ mức áp suất oxy nhất định nào (được đo bằng áp suất riêng phần của oxy [PO2]), độ bão hòa oxy ở người bị thiếu máu bị giảm. Máu động mạch thường có PO2 khoảng 95 torr (hoặc 95 mm Hg) và gần như bão hòa 100% với oxy. Khi các hồng cầu đi từ tiểu động mạch qua giường mao mạch và đến tĩnh mạch, oxy được giải phóng cho các tế bào đang hô hấp. Do đó, khoảng 20% lượng oxy trong máu được giải phóng khỏi hồng cầu. Ngược lại, ở những bệnh nhân bị thiếu máu và có nồng độ 2,3-BPG tăng trong hồng cầu, ái lực với oxy của máu thấp hơn cho phép nhiều oxy hơn (khoảng 30%) sẽ được giải phóng khỏi hồng cầu. Lợi ích này có thể được thể hiện một cách định lượng bằng cách đánh giá khả năng vận chuyển oxy thay vì nồng độ hemoglobin. Ở một người có nồng độ hemoglobin bình thường là 15 g/dL, khả năng vận chuyển oxy của máu là 20 ml oxy mỗi 1 deciliter máu. Khi đi qua các tiểu động mạch và giường mao mạch, khoảng 20% lượng oxy này sẽ được giải phóng khỏi hồng cầu – tức là khoảng 4 ml oxy mỗi 1 deciliter máu. Ngược lại, một bệnh nhân có thiếu máu và nồng độ hemoglobin là 7,5 g/dL thì có khả năng vận chuyển oxy bằng một nửa giá trị bình thường (nghĩa là 10 ml oxy mỗi 1 deciliter máu). Nếu các tế bào hồng cầu của bệnh nhân này có ái lực với oxy bình thường thì có 20% lượng oxy hay khoảng 2 ml, sẽ được giải phóng khỏi hồng cầu mỗi 1 deciliter máu. Tuy nhiên, do các tế bào hồng cầu của bệnh nhân này có nồng độ 2,3-BPG cao và do đó ái lực với oxy thấp hơn, khoảng 3 ml oxy sẽ được giải phóng, cho phép bù trừ một phần cho sự thiếu hụt về lượng hemoglobin.
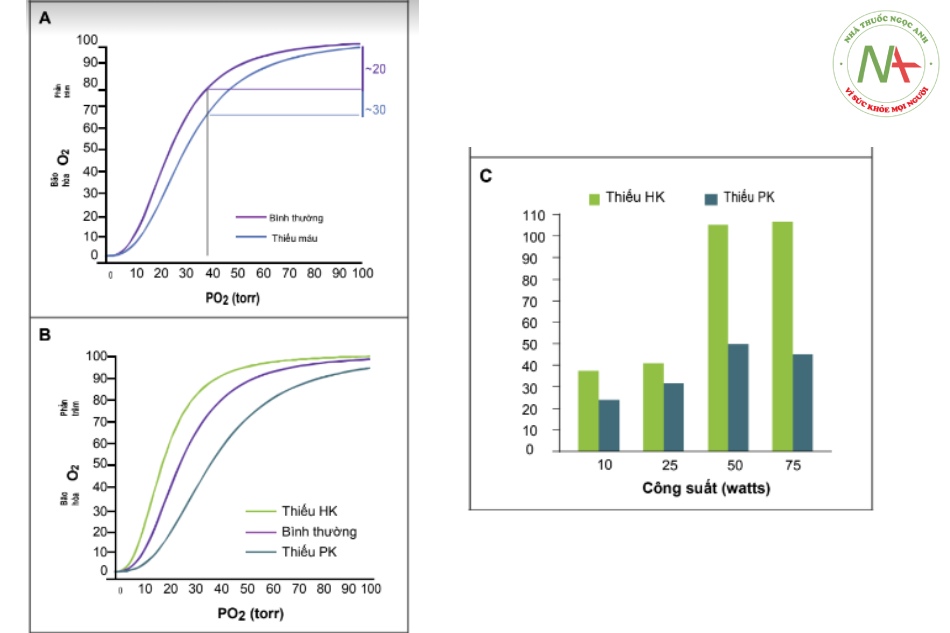
Hình A cho thấy các đường cong phân ly oxyhemoglobin của một người bình thường và một bệnh nhân có thiếu máu. Độ bão hòa của hemoglobin với oxy theo phần trăm được biễu diễn theo áp suất riêng phần của oxy (PO2). Các đường nét nhạt cho thấy tại điểm PO2 bằng 40 torr, khoảng 20% oxy được phân ly khỏi hồng cầu ở một người không bị thiếu máu, trong khi đó có khoảng 30% oxy được phân ly ở một bệnh nhân bị thiếu máu. Hình B hiển diễn các đường cong phân ly oxy-hemoglobin của một bệnh nhân bị thiếu hexokinase (HK) và một bệnh nhân bị thiếu pyruvate kinase (PK). Dữ liệu của Delivoria-Papadopoulos và cộng sự.2 Hình C cho thấy sự thay đổi về cung lượng tim trong quá trình gắng sức được phân nhóm ở bệnh nhân thiếu HK và bệnh nhân thiếu PK. Dữ liệu của Bunn và Forget.
SỰ KHÁC NHAU GIỮA THIẾU HỤT
Một trong những khía cạnh phấn khởi hơn của y học lâm sàng là nhận ra những hiểu biết quan trọng về sinh lý bệnh xuất hiện từ những quan sát kỹ lưỡng trên một số lượng nhỏ bệnh nhân. Khoảng 50 năm trước, Frank Oski và các cộng sự2’4 đã đánh giá hai trẻ vị thành niên mắc bệnh thiếu máu tán huyết do khiếm khuyết di truyền ở các enzyme hồng cầu. Một bệnh nhân bị thiếu hexokinase, enzyme tham gia bước đầu tiên ở con đường đường phân trung gian cho quá trình phosphoryl hóa glucose. Kết quả là hồng cầu bị thiếu 2,3-BPG (chỉ 67% so với nồng độ bình thường). Như thể hiện trong Hình 1B, các tế bào hồng cầu có ái lực với oxy tăng và do đó đường cong phân ly oxy-hemoglobin dịch chuyển sang trái. Bệnh nhân còn lại bị thiếu pyruvate kinase, một loại enzyme ở hạ nguồn giúp chuyển phosphoenolpyruvate thành pyruvate. Kết quả là, nồng độ 2’3-BPG trong hồng cầu tăng lên gấp 2’5 lần, cao hơn đáng kể so với nồng độ ở hầu hết các bệnh nhân thiếu máu khác, với sự dịch chuyển rõ rệt sang phải của đường cong phân ly oxy-hemoglobin. Mặc dù hai bệnh nhân có mức độ thiếu máu tương đương nhau (nồng độ hemoglobin khoảng 10 g/dL), bệnh nhân thiếu hexokinase có tình trạng khó thở và mệt’ trong khi đó bệnh nhân thiếu pyruvate kinase không có triệu chứng. Sự khác biệt về biểu hiện lâm sàng này phù hợp với các phép đo cung lượng tim trong quá trình gắng sức được phân loại trên máy đo công suất bằng đạp xe’ khi đó cho thấy cung lượng tim tăng lên gấp 2’5 lần ở bệnh nhân thiếu hụt hexokinase, so với mức tăng khiêm tốn hơn ở bệnh nhân bị thiếu pyruvate kinase (Hình 1C).
THUỐC ĐƯỢC THIẾT KẾ ĐỂ LÀM TĂNG NỒNG ĐỘ HEMOGLOBIN
Các nghiên cứu của Oski và các cộng sự, cho thấy ái lực với oxy của hồng cầu là yếu tố chính quyết định việc cung cấp oxy, rất phù hợp để đánh giá các loại thuốc được thiết kế để làm gia tăng nồng độ hemoglobin ở bệnh nhân thiếu máu. Gần đây, hai loại thuốc đã được giới thiệu là làm gia tăng nồng độ hemoglobin ở những bệnh nhân mắc hai loại bệnh hemoglobin: bệnh hồng cầu hình liềm và bệnh thalassemia.
Vào năm 2019, voxelotor (Oxbryta) đã được Cục Quản lý Thực phẩm và Dược phẩm (FDA) phê duyệt để điều trị bệnh hồng cầu hình liềm, đây là loại thuốc đầu tiên nhận được sự chấp thuận như vậy kể từ khi hydroxyurea được chứng minh là hiệu quả cách đây 21 năm. Hydroxyurea đã trở thành một tiêu chuẩn điều trị vì hiệu quả của nó trong việc giảm tần suất các cuộc khủng hoảng tắc mạch (vaso-occlusive crises) và cải thiện tình trạng thiếu máu. Mặc dù voxelotor có hiệu quả trong việc tăng nồng độ hemoglobin ở bệnh nhân mắc bệnh hồng cầu hình liềm, các thử nghiệm mù đôi giai đoạn 3 đã cho thấy không có tác dụng đáng kể nào đối với tần suất hoặc mức độ nặng của các biến cố tắc mạch. Thuốc này liên kết cộng hóa trị với đầu tận N của a-globin trong oxyhemoglobin S (và F), dẫn đến ổn định cấu trúc của hemoglobin không thể polyme hóa, cũng như làm tăng đáng kể ái lực với oxy. Các nghiên cứu in vitro cho thấy loại thuốc này là một chất ức chế mạnh hồng cầu hình liềm, phụ thuộc vào quá trình khử oxy của hemoglobin để tạo thành cấu dạng T trùng hợp. Việc thiếu hiệu quả của voxelotor trong việc cải thiện tình trạng tắc mạch có thể là do giảm khả năng giải phóng oxy trong vi tuần hoàn của các cơ quan và mô do ái lực với oxy tăng. Một nghiên cứu trên mô hình in vitro gần đây dựa trên đánh giá nghiêm ngặt về tác dụng của thuốc đối với động học của hình dàng liềm ở điều kiện dòng chảy trong vi tuần hoàn đã cho thấy rằng hydroxyurea tăng cường cung cấp oxy, trong khi voxelotor thì không.
Vào năm 2022, mitapivat (Pyrukynd) đã được FDA chấp thuận để điều trị bệnh nhân bị thiếu máu tán huyết do thiếu pyruvate kinase. Thuốc này liên kết và làm ổn định enzyme đột biến, làm tăng hemoglobin và giảm tán huyết ở những bệnh nhân này chủ yếu là do tăng khoảng 40% ATP hồng cầu. Ngoài ra, thuốc làm giảm khoảng 35% 2,3-BPG trong hồng cầu ở cả những bệnh nhân này và tình nguyện viên khỏe mạnh. Những kết quả này đã thúc đẩy một thử nghiệm nhãn mở giai đoạn 2 liên quan đến bệnh nhân p-thalassemia hoặc a-thalassemia có thiếu máu nhưng không phụ thuộc truyền máu, với ý tưởng là quá trình tạo hồng cầu không hiệu quả và tán huyết cũng có thể được giảm thiểu bằng cách gia tăng ATP trong hồng cầu. Tất cả năm bệnh nhân mắc bệnh a-thalassemia, cùng với 11 trong số 15 bệnh nhân mắc bệnh p-thalassemia, có sự gia tăng mức độ huyết sắc tố hơn 1 g mỗi 1 deciliter. Không có đề cập nào trong báo cáo về các thay đổi nồng độ 2,3-BPG trong hồng cầu, nhưng thuốc này gần như chắc chắn gây ra giảm đáng kể 2,3-BPG, như đã quan sát trước đây ở những người không bị ảnh hưởng.
Trong một thử nghiệm lâm sàng giai đoạn 1 gần đây liên quan đến 16 bệnh nhân, Xu và cộng sự đã đánh giá việc sử dụng mitapivat để điều trị bệnh hồng cầu hình liềm. Ở liều cao nhất của mitapivat, hơn một nửa bệnh nhân có đáp ứng hemoglobin, được định nghĩa là sự gia tăng hemoglobin ít nhất 1 g/dL. Ngoài ra, sự giảm nồng độ 2,3-BPG trong hồng cầu phụ thuộc vào liều lượng thuốc đã được ghi nhận.
Sự gia tăng ái lực với oxy của hồng cầu ở bệnh nhân được điều trị bằng voxelotor hoặc mitapivat sẽ gây ra một động lực do giảm oxy tại mô đủ để gây gia tăng khiêm tốn có thể ghi nhận trên nồng độ hemoglobin, tương tự như nồng độ hemoglobin ở những người đã thừa hưởng hemoglobin đột biến làm tăng ái lực với oxy.
KẾT LUẬN
Các tình huống điều trị bằng voxelotor hoặc mitapivat này nên cảnh tỉnh bác sĩ biết rằng ở một nồng độ hemoglobin nhất định, những thay đổi do thuốc gây ra lên đường cong phân ly oxyhemoglobin có thể gây ảnh hưởng ấn tượng đến việc cung cấp oxy, tương tự như quan sát của Oski và cộng sự2, 4 ở hai trẻ thành niên bị thiếu các enzyme hồng cầu. Sinh viên y khoa được dạy chính xác rằng các triệu chứng cơ năng hiệu và thực thể của thiếu máu là do sự không cung cấp đủ oxy cho các cơ quan và mô. Các bác sĩ thực hành sử dụng nồng độ hemoglobin máu như một đánh giá dễ đo lường và chính xác về mức độ nghiêm trọng của bệnh thiếu máu và đáp ứng của thiếu máu với điều trị. Tuy nhiên, trong việc đánh giá hiệu quả của các loại thuốc được thiết kế để điều trị thiếu máu, sự gia tăng nồng độ hemoglobin do thuốc gây ra có thể gây hiểu nhầm, thậm chí là ảo tưởng. Điều quan trọng là nhận ra thuốc đó có ảnh hưởng không mong đợi đến sự cung cấp oxy, đối nghịch với việc tăng cường khả năng vận chuyển oxy.
Việc phát triển các loại thuốc mới đặt ra gánh nặng tài chính lớn cho hệ thống chăm sóc sức khỏe của chúng ta và khơi dậy hy vọng từ phía bệnh nhân về thuốc mà học được kê đơn thuốc.
Một đánh giá chính xác sự hiệu quả và giá trị của một loại thuốc thường phụ thuộc vào sự hiểu biết chắc chắn về sinh lý cơ bản.
REFERENCES
- Benesch R, Benesch RE. Intracellular organic phosphates as regulators of oxygen release by haemoglobin. Nature 1969; 221:618-22.
- Delivoria-Papadopoulos M, Oski FA, Gottlieb AJ. Oxygen-hemoglobulin dissociation curves: effect of inherited enzyme defects of the red cell. Science 1969;165: 601-2.
- Oxygen and carbon dioxide transport. In Bunn HF, Forget BG. Hemoglobin: molecular, genetic, and clinical aspects. Philadelphia:W.B. Saunders, 1986:117.
- Oski FA, Marshall BE, Cohen PJ, Sug-erman HJ, Miller LD. The role of the left-shifted or right-shifted oxygen- hemoglo-bin equilibrium curve. Ann Intern Med 1971;74:44-6.
- Vichinsky E, Hoppe CC, Ataga KI, et al. A phase 3 randomized trial of voxelo- tor in sickle cell disease. N Engl J Med 2019;381:509-19.
- Howard J, Ataga KI, Brown RC, et al. Voxelotor in adolescents and adults with sickle cell disease (HOPE): long-term follow-up results of an international, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Haematol 2021;8(5): e323-e333.
- Oksenberg D, Dufu K, Patel MP, et al. GBT440 increases haemoglobin oxygen affinity, reduces sickling and prolongs RBC half-life in a murine model of sickle cell disease. Br J Haematol 2016;175:141- 53.
- Hebbel RP, Hedlund BE. Sickle hemo-globin oxygen affinity-shifting strategies have unequal cerebrovascular risks. Am J Hematol 2018;93:321-5.
- Henry ER, Metaferia B, Li Q, et al. Treatment of sickle cell disease by increasing oxygen affinity of hemoglobin. Blood 2021;138:1172-81.
- Kung C, Hixon J, Kosinski PA, et al. AG-348 enhances pyruvate kinase activity in red blood cells from patients with pyruvate- kinase deficiency. Blood 2017; 130:1347-56.
- Grace RF, Rose C, Layton DM, et al. Safety and efficacy of mitapivat in pyruvate kinase deficiency. N Engl J Med 2019; 381:933-44.
- Yang H, Merica E, Chen Y, et al. Phase 1 single- and multiple-ascending-dose randomized studies of the safety, pharmacokinetics, and pharmacodynamics of AG-348, a first-in-class allosteric activator of pyruvate kinase R, in healthy volunteers. Clin Pharmacol Drug Dev 2019;8:246-59.