Chưa có sản phẩm trong giỏ hàng.
Pazopanib

Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
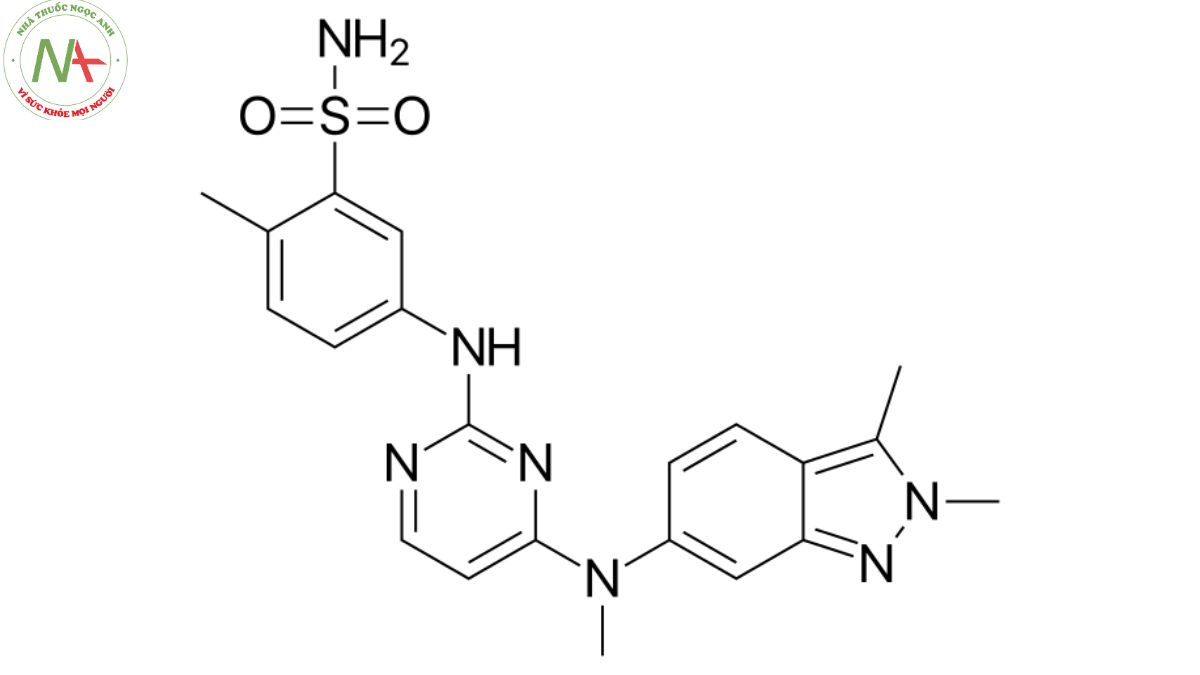
5-[[4-[(2,3-dimethylindazol-6-yl)-methylamino]pyrimidin-2-yl]amino]-2-methylbenzenesulfonamide
Nhóm thuốc
Pazopanib thuộc nhóm nào? Thuốc chống ung thư
Mã ATC
L – Chất chống ung thư và điều hòa miễn dịch
L01 – Thuốc chống ung thư
L01E – Chất ức chế protein kinase
L01EX – Chất ức chế protein kinase khác
L01EX03 – Pazopanib
Phân loại nguy cơ cho phụ nữ có thai
D
Mã UNII
7RN5DR86CK
Mã CAS
444731-52-6
Cấu trúc phân tử
Công thức phân tử
C21H23N7O2S
Phân tử lượng
437.5 g/mol
Cấu trúc phân tử
Pazopanib là một pyrimidine có 5-(pyrimidin-2-yl}amino-2-methylbenzensulfonamit được thay thế ở vị trí 4 bằng nhóm (2,3-dimethylindazol-6-yl)(methyl)amino. Nó là một dẫn xuất của indazole, một aminopyrimidine và một sulfonamide.
Các tính chất phân tử
Số liên kết hydro cho: 2
Số liên kết hydro nhận: 8
Số liên kết có thể xoay: 5
Diện tích bề mặt tôpô: 127Ų
Số lượng nguyên tử nặng: 31
Các tính chất đặc trưng
Điểm sôi: 728.8±70.0 °C ở 760 mmHg
Tỷ trọng riêng: 1.4±0.1 g/cm3
Độ tan trong nước: 0.0433 mg/mL
Hằng số phân ly pKa: 4.36
Chu kì bán hủy: 35 giờ
Khả năng liên kết với Protein huyết tương: >99%
Dạng bào chế
Viên nén: 200 mg, Pazopanib 400 mg

Độ ổn định và điều kiện bảo quản
Nên bảo quản pazopanib ở nơi khô ráo, thoáng mát, tránh ánh nắng trực tiếp và xa tầm tay trẻ em.
Nguồn gốc
Pazopanib là thuốc gì? Pazopanib là một loại chất ức chế phân tử nhỏ với khả năng ức chế nhiều protein tyrosine kinase, đặc biệt là trong việc chống lại sự phát triển của ung thư. Loại thuốc này đã trải qua quá trình nghiên cứu và phát triển bởi công ty dược phẩm GlaxoSmithKline, và đã nhận được sự chấp thuận từ Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) vào ngày 19 tháng 10 năm 2009.
Dược lý và cơ chế hoạt động
Pazopanib có tác dụng gì? Pazopanib là một loại thuốc ức chế tyrosine kinase đa mục tiêu thế hệ thứ hai, có khả năng chống lại nhiều thụ thể quan trọng như thụ thể yếu tố tăng trưởng nội mô mạch máu-1, -2 và -3, thụ thể-alpha của yếu tố tăng trưởng có nguồn gốc từ tiểu cầu, thụ thể-beta của yếu tố tăng trưởng có nguồn gốc từ tiểu cầu và thụ thể c-kit. Những thụ thể này đóng vai trò quan trọng trong quá trình hình thành mạch máu cung cấp cho sự phát triển và tồn tại của khối u.
Pazopanib là một hợp chất tổng hợp thuộc loại indazolylpyrimidine và có khả năng duy trì nồng độ ổn định ở mức >15 μg/ml trong hệ thống cơ thể. Nồng độ này đủ cao để đạt hiệu suất tối đa trong việc ức chế quá trình phosphoryl hóa của thụ thể VEGFR2 và nhiều hoạt động chống khối u khác (được xác định rằng nồng độ cần thiết để ức chế thụ thể là từ 0,01 đến 0,084 μmol/L).
Kết quả của việc sử dụng pazopanib bao gồm việc giảm lưu lượng máu cung cấp cho khối u, thúc đẩy sự tử vong tự nhiên của các tế bào khối u, ngăn chặn sự phát triển của khối u, giảm áp lực dịch kẽ xung quanh khối u và tạo điều kiện thiếu oxi trong mô tế bào của khối u, điều này có thể được quan sát thấy ở những bệnh nhân đang điều trị.
Ứng dụng trong y học
Pazopanib chỉ định? Pazopanib đã nhận được sự phê duyệt từ nhiều cơ quan quản lý y tế trên toàn thế giới, bao gồm Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) vào ngày 19 tháng 10 năm 2009, Cơ quan Quản lý Dược phẩm Châu Âu của Liên minh Châu Âu (EMA) vào ngày 14 tháng 6 năm 2010, Cơ quan Quản lý Thuốc và Sản phẩm Chăm sóc Sức khỏe của Vương quốc Anh (MHRA) vào ngày 14 tháng 6 năm 2010, và Cơ quan Quản lý Sản phẩm Trị liệu Úc (TGA) vào ngày 30 tháng 6 năm 2010. Pazopanib được phê duyệt để sử dụng trong việc điều trị ung thư biểu mô tế bào thận tiến triển/di căn và sarcoma mô mềm tiến triển.
Ở Úc và New Zealand, thuốc này được hỗ trợ trong Chương trình Phúc lợi Dược phẩm (PBS) và bởi Pharmac tương ứng, với một số điều kiện cụ thể:
- Pazopanib được sử dụng để điều trị ung thư biểu mô tế bào thận rõ ràng, loại phụ mô học phổ biến nhất.
- Giai đoạn điều trị được kéo dài sau ít nhất 3 tháng.
- Bệnh nhân phải được cấp đơn thuốc pazopanib bởi thẩm quyền thích hợp.
- Bệnh nhân phải có tình trạng bệnh ổn định hoặc đáp ứng theo Tiêu chí đánh giá đáp ứng ở khối u rắn (RECIST).
- Phương pháp điều trị này phải là thuốc ức chế tyrosine kinase duy nhất được hỗ trợ cho tình trạng này.
Ngoài ra, Pazopanib đã được nghiên cứu và chứng minh có hiệu quả trong việc điều trị ban đầu ở bệnh nhân mắc ung thư buồng trứng và ung thư phổi không phải tế bào nhỏ. Tuy nhiên, kế hoạch nộp đơn liên quan đến ung thư buồng trứng tiến triển đã bị rút lại và không được xin giấy phép ở bất kỳ quốc gia nào.
Dược động học
Hấp thu
Sự hấp thu của pazopanib ở bệnh nhân mắc ung thư có tính chất chậm và không hoàn toàn hiệu quả. Trong khoảng liều từ 50 đến 2000 mg, hấp thu pazopanib không theo luật tỷ lệ. Ngoài ra, đã quan sát thấy sự tích lũy đáng kể của pazopanib ở những bệnh nhân dùng 800 mg một lần mỗi ngày trong suốt 22 ngày. Việc nghiền viên nén có thể làm tăng sự phơi nhiễm (tăng Cmax và AUC), đồng thời giảm Tmax xuống 2 giờ. Sự hấp thu qua đường tiêu hóa có thể không hoàn toàn hiệu quả, và sinh khả dụng của viên uống 800 mg ở bệnh nhân ung thư chỉ là khoảng 21%.
Pazopanib chủ yếu duy trì dạng không chuyển hóa trong hệ thống cơ thể và không phải là chất chuyển hóa. Nồng độ tối đa trung bình trong huyết tương đạt khoảng 58,1 µg/mL, còn AUC trung bình là 1037 µg · h/mL.
Phân bố
Pazopanib có khả năng phân bố rộng trong trạng thái ổn định, với dạng tự do trong huyết tương khoảng 11,1 L (trong khoảng từ 9,15 đến 13,4). Hơn 99% pazopanib liên kết với protein, và mức độ liên kết này không phụ thuộc vào nồng độ, trong khoảng từ 10 đến 100 μg/mL.
Chuyển hóa
Pazopanib trải qua quá trình chuyển hóa chủ yếu bởi enzym CYP3A4, và ở mức độ thấp hơn bởi CYP1A2 và CYP2C8. Các chất chuyển hóa này có hoạt động kém hơn pazopanib nhiều lần (ít hoạt động hơn từ 10 đến 20 lần). Ba trong số chất chuyển hóa này có thể được tìm thấy trong hệ thống và chiếm dưới 10% hoạt tính phóng xạ trong huyết tương.
Thải trừ
Pazopanib chủ yếu được tiết ra qua phân (82,2%) và ở mức độ không đáng kể qua nước tiểu (<4%) ở bệnh nhân mắc ung thư. Hầu hết liều dùng được bài tiết dưới dạng không đổi. Khoảng 10% của liều dùng được chuyển hóa thành sản phẩm oxy hóa và hầu hết được tiết ra qua phân. Tốc độ tiết trừ của pazopanib là khoảng 4 mL/phút ở bệnh nhân mắc ung thư sau tiêm tĩnh mạch 5 mg. Một nửa của liều hấp thụ được đào thải thông qua quá trình chuyển hóa oxy hóa. Thời gian bán hủy của pazopanib là 35 giờ. Điều này cho thấy rằng quá trình hấp thu qua đường uống không phải là yếu tố hạn chế tốc độ tiết trừ từ huyết tương.
Độc tính ở người
Các tác dụng phụ của pazopanib phổ biến bao gồm buồn nôn, nôn mửa, tiêu chảy (xảy ra ở khoảng một nửa số bệnh nhân), thay đổi màu tóc, tăng huyết áp (thường xảy ra trong vài tuần đầu điều trị), chán ăn, tăng đường huyết, hạ đường huyết, rối loạn điện giải (bao gồm hạ canxi máu, hạ magie máu, hạ phosphat máu), các biến đổi không bình thường trong kết quả xét nghiệm máu (bao gồm tăng enzym AST, ALT và protein trong nước tiểu), phù nề, rụng tóc hoặc thay đổi màu tóc, thay đổi vị giác, đau bụng, phát ban, mệt mỏi và ức chế tủy xương (bao gồm giảm số lượng bạch cầu, bạch cầu trung tính, tiểu cầu và bạch cầu lympho). Ngoài ra, pazopanib cũng có nguy cơ gây tổn thương gan thấp, tuy nhiên, có khả năng gây tử vong.
Việc điều trị quá liều pazopanib hoàn toàn là quá trình hỗ trợ và có thể xuất hiện các triệu chứng như tăng huyết áp độ 3 và mệt mỏi.
Tính an toàn
Nhiễm độc gan nghiêm trọng hoặc tử vong liên quan đến sự gia tăng nồng độ aminotransferase và bilirubin trong huyết thanh đã được ghi nhận ở những bệnh nhân sử dụng pazopanib. Trong trường hợp xảy ra nhiễm độc gan, điều quan trọng là giảm liều pazopanib hoặc ngừng điều trị, và đôi khi cần ngừng vĩnh viễn.
Phụ nữ nên tránh sử dụng pazopanib khi mang thai, dù hiện chưa có nghiên cứu đầy đủ và được kiểm soát tốt về tác động của nó đối với thai nhi. Pazopanib đã được xác định gây quái thai, độc hại cho phôi thai, tổn thương thai nhi và gây sẩy thai trong nghiên cứu trên động vật. Nếu một phụ nữ mang thai hoặc có nguy cơ mang thai khi đang sử dụng pazopanib, cần thông báo về nguy cơ tiềm ẩn đối với thai nhi.
Pazopanib cũng đã được chứng minh là có liên quan với kéo dài khoảng QT, xoắn đỉnh và các biến cố xuất huyết nghiêm trọng, đôi khi dẫn đến tử vong ở một số bệnh nhân.
Thủng hoặc rò đường tiêu hóa cũng là một tình huống có nguy cơ tử vong và có liên quan đến việc sử dụng pazopanib.
Tương tác với thuốc khác
Sử dụng đồng thời pazopanib với các chất ức chế mạnh men gan CYP3A4 như ketoconazol, ritonavir, clarithromycin hoặc nước ép bưởi có thể dẫn đến tăng nồng độ pazopanib trong huyết thanh, do pazopanib là chất được chuyển hoá bởi men gan CYP3A4.
Các loại thuốc kích thích men gan CYP3A4 như rifampin và carbamazepine có khả năng làm giảm nồng độ pazopanib trong huyết thanh khi sử dụng cùng lúc.
Pazopanib cũng là một chất nền của p-glycoprotein (PGP), do đó, các chất ức chế PGP như quinidine có thể tương tác với pazopanib.
Tuy nhiên, pazopanib không phải là chất nền cho men gan OATP1B1 hoặc OATP1B3. Pazopanib có khả năng ức chế men gan OATP1B1, nhưng không có khả năng ức chế men gan OATP1B3.
Lưu ý khi sử dụng Pazopanib
Lái xe trong khi sử dụng thuốc này được coi là không an toàn và có thể ảnh hưởng đến khả năng lái xe của bạn. Nó có thể làm giảm sự tỉnh táo, gây buồn ngủ và mệt mỏi.
Tính an toàn và hiệu quả của pazopanib chưa được xác định ở trẻ em dưới 18 tuổi, vì vậy, nên tham khảo ý kiến bác sĩ điều trị trước khi sử dụng cho trẻ em.
Cần thận trọng khi sử dụng pazopanib ở những bệnh nhân thuộc nhóm tuổi cao, vì điều này có thể dẫn đến sự phát triển thêm các vấn đề y tế và làm tình trạng sức khỏe của họ trở nên tồi tệ hơn. Bệnh nhân trên 65 tuổi đang đối diện với nguy cơ cao hơn về nhiễm độc gan khi sử dụng thuốc này.
Có thể quan sát sự tăng cao của men gan như ALT, AST và bilirubin khi sử dụng pazopanib. Tăng bilirubin máu gián tiếp do pazopanib có thể xuất hiện ở bệnh nhân mắc hội chứng Gilbert.
Các tình trạng nghiêm trọng như xuất huyết, sự hình thành cục máu và xuất huyết nội sọ não đã được báo cáo. Cũng đã có báo cáo về các vấn đề liên quan đến tắc nghẽn động mạch và tĩnh mạch, cũng như viêm phổi, viêm mạch huyết khối và thủng đường tiêu hóa.
Sử dụng thuốc này cũng có thể gây suy giảm miễn dịch, nhiễm trùng và thay đổi protein niệu. Mang thai nên được tránh vì có thể gây hại cho thai nhi.
Nếu bạn có kế hoạch phẫu thuật, nên tránh sử dụng thuốc này, vì nó có thể làm giảm khả năng lành vết thương.
Trước khi sử dụng, hãy đọc kỹ tờ hướng dẫn sử dụng thuốc Pazopanib.
Một vài nghiên cứu của Pazopanib trong Y học
Liệu pháp nhắm mục tiêu cho ung thư biểu mô tế bào thận di căn
Bối cảnh: Một số thử nghiệm so sánh ngẫu nhiên có đối chứng (RCT) đã được thực hiện bao gồm sự kết hợp giữa thuốc ức chế tyrosine kinase (TKI) và thuốc ức chế điểm kiểm soát miễn dịch kể từ khi xuất bản Tạp chí Cochrane về liệu pháp nhắm mục tiêu cho ung thư biểu mô tế bào thận di căn (mRCC) vào năm 2008. Đánh giá này thể hiện bản cập nhật của đánh giá ban đầu đó.
Mục tiêu: Để đánh giá hiệu quả của các liệu pháp nhắm mục tiêu đối với mRCC tế bào sáng ở những bệnh nhân chưa từng điều trị toàn thân.
Phương pháp tìm kiếm: Chúng tôi đã thực hiện tìm kiếm toàn diện mà không có hạn chế về ngôn ngữ hoặc trạng thái xuất bản. Ngày tìm kiếm gần đây nhất là ngày 18 tháng 6 năm 2020.
Tiêu chí lựa chọn: Chúng tôi bao gồm các thử nghiệm ngẫu nhiên có đối chứng, tuyển chọn những bệnh nhân mắc mRCC tế bào sáng chưa từng điều trị toàn thân trước đó. Sự can thiệp chỉ số là bất kỳ liệu pháp nhắm mục tiêu nào dựa trên TKI.
Thu thập và phân tích dữ liệu: Hai tác giả đánh giá đã đánh giá độc lập các nghiên cứu được đưa vào và trích xuất dữ liệu cho các kết quả chính: tỷ lệ sống sót không tiến triển (PFS), tỷ lệ sống sót chung (OS) và các biến cố bất lợi nghiêm trọng (SAE); và các kết quả phụ: chất lượng cuộc sống liên quan đến sức khỏe (QoL), tỷ lệ đáp ứng và các tác dụng phụ nhỏ (AE). Chúng tôi đã thực hiện các phân tích thống kê bằng mô hình hiệu ứng ngẫu nhiên và đánh giá mức độ chắc chắn của bằng chứng theo phương pháp GRADE.
Kết quả chính: Chúng tôi bao gồm 18 RCT báo cáo về 11.590 người tham gia được chọn ngẫu nhiên qua 18 so sánh. Bản tóm tắt này tập trung vào các kết quả chính của các so sánh chọn lọc.
1. Pazopanib so với sunitinib:
Pazopanib có thể tạo ra ít hoặc không có sự khác biệt về PFS so với sunitinib (tỷ lệ rủi ro (HR) 1,05, khoảng tin cậy (CI) 95% 0,90 đến 1,23; 1 nghiên cứu, 1110 người tham gia; bằng chứng chắc chắn thấp). Dựa trên rủi ro biến cố đối chứng là 420 trên 1000 trong thử nghiệm này trong 12 tháng, điều này tương ứng với số người tham gia gặp phải PFS ít hơn 18 người (95% CI 76 ít hơn và nhiều hơn 38) trên 1000 người tham gia.
Pazopanib có thể tạo ra ít hoặc không có sự khác biệt về OS so với sunitinib (HR 0,92, KTC 95% 0,80 đến 1,06; 1 nghiên cứu, 1110 người tham gia; bằng chứng có độ chắc chắn thấp). Dựa trên rủi ro sự kiện đối chứng là 550 trên 1000 trong thử nghiệm này lúc 12 tháng, con số này tương ứng với thêm 27 OS (95% CI 19 ít hơn đến nhiều hơn 70) trên 1000 người tham gia.
Pazopanib có thể tạo ra ít hoặc không có sự khác biệt về SAE so với sunitinib (tỷ lệ rủi ro (RR) 1,01, KTC 95% 0,94 đến 1,09; 1 nghiên cứu, 1102 người tham gia; bằng chứng có độ chắc chắn thấp). Dựa trên rủi ro sự kiện đối chứng là 734 trên 1000 trong thử nghiệm này, điều này tương ứng với việc có thêm 7 người tham gia gặp phải SAE (95% CI 44 ít hơn và nhiều hơn 66) trên 1000 người tham gia.
2. Sunitinib so với avelumab và axitinib:
Sunitinib có thể làm giảm PFS so với avelumab cộng với axitinib (HR 1,45, KTC 95% 1,17 đến 1,80; 1 nghiên cứu, 886 người tham gia; bằng chứng chắc chắn vừa phải). Dựa trên rủi ro biến cố đối chứng là 550 trên 1000 trong thử nghiệm 12 tháng này, điều này tương ứng với số người tham gia gặp phải PFS ít hơn 130 (KTC 95% 209 ít hơn đến ít hơn 53) trên 1000 người tham gia.
Sunitinib có thể tạo ra ít hoặc không có sự khác biệt về OS (HR 1,28, KTC 95% 0,92 đến 1,79; 1 nghiên cứu, 886 người tham gia; bằng chứng có độ chắc chắn thấp). Dựa trên rủi ro biến cố đối chứng là 890 trên 1000 trong thử nghiệm 12 tháng này, điều này sẽ dẫn đến số OS ít hơn 29 (95% CI 78 ít hơn và nhiều hơn 8) trên 1000 người tham gia.
Sunitinib có thể tạo ra ít hoặc không có sự khác biệt về SAE (RR 1,01, KTC 95% 0,93 đến 1,10; 1 nghiên cứu, 873 người tham gia; bằng chứng có độ chắc chắn thấp). Dựa trên rủi ro sự kiện đối chứng là 705 trên 1000 trong thử nghiệm này, điều này tương ứng với thêm 7 SAE (95% CI 49 ít hơn đến nhiều hơn 71) trên 1000 người tham gia.
3. Sunitinib so với pembrolizumab và axitinib:
Sunitinib có thể làm giảm PFS so với pembrolizumab cộng với axitinib (HR 1,45, KTC 95% 1,19 đến 1,76; 1 nghiên cứu, 861 người tham gia; bằng chứng chắc chắn vừa phải). Dựa trên rủi ro biến cố đối chứng là 590 trên 1000 trong thử nghiệm 12 tháng này, điều này tương ứng với số người tham gia gặp phải PFS ít hơn 125 (KTC 95% 195 ít hơn đến ít hơn 56) trên 1000 người tham gia.
Sunitinib có thể làm giảm OS (HR 1,90, KTC 95% 1,36 đến 2,65; 1 nghiên cứu, 861 người tham gia; bằng chứng chắc chắn vừa phải). Dựa trên rủi ro biến cố đối chứng là 880 trên 1000 trong thử nghiệm này trong 12 tháng, điều này sẽ dẫn đến số OS ít hơn 96 (CI 95% 167 ít hơn đến ít hơn 40) trên 1000 người tham gia.
Sunitinib có thể làm giảm SAE so với pembrolizumab cộng với axitinib (RR 0,90, KTC 95% 0,81 đến 1,02; 1 nghiên cứu, 854 người tham gia; bằng chứng có độ chắc chắn thấp) mặc dù CI bao gồm khả năng không có tác dụng. Dựa trên rủi ro sự kiện đối chứng là 604 trên 1000 trong thử nghiệm này, điều này tương ứng với ít hơn 60 SAE (95% CI 115 ít hơn đến 12 nhiều hơn) trên 1000 người tham gia.
4. Sunitinib so với nivolumab và ipilimumab:
Sunitinib có thể làm giảm PFS so với nivolumab cộng với ipilimumab (HR 1,30, KTC 95% 1,11 đến 1,52; 1 nghiên cứu, 847 người tham gia; bằng chứng có độ chắc chắn thấp). Dựa trên nguy cơ biến cố đối chứng là 280 trên 1000 trong thử nghiệm này sau 30 tháng theo dõi, điều này tương ứng với ít hơn 89 PFS (95% CI 136 ít hơn đến 37 ít hơn) trên 1000 người tham gia.
Sunitinib làm giảm OS (HR 1,52, KTC 95% 1,23 đến 1,89; 1 nghiên cứu, 847 người tham gia; bằng chứng có độ chắc chắn cao). Dựa trên rủi ro sự kiện kiểm soát là 600 trên 1000 trong thử nghiệm này trong 30 tháng, điều này sẽ dẫn đến số OS ít hơn 140 (CI 95% 219 ít hơn đến ít hơn 67) trên 1000 người tham gia.
Sunitinib có thể làm tăng SAE (RR 1,37, KTC 95% 1,22 đến 1,53; 1 nghiên cứu, 1082 người tham gia; bằng chứng có độ tin cậy vừa phải). Dựa trên rủi ro sự kiện kiểm soát là 457 trên 1000 trong thử nghiệm này, điều này tương ứng với thêm 169 SAE (95% CI 101 tăng thêm đến 242 thêm) trên 1000 người tham gia.
Kết luận của tác giả: Dựa trên bằng chứng có độ chắc chắn từ thấp đến cao, một số sự kết hợp của thuốc ức chế điểm kiểm soát miễn dịch dường như vượt trội hơn so với liệu pháp nhắm mục tiêu một tác nhân về mặt PFS và OS, đồng thời có đặc điểm AE thuận lợi. Một số liệu pháp nhắm mục tiêu đơn lẻ đã chứng minh kết quả điều trị ung thư tương tự hoặc được cải thiện so với các liệu pháp khác; sự khác biệt nhỏ đã được quan sát thấy đối với AE trong nhóm này. Độ chắc chắn của bằng chứng rất khác nhau, từ cao đến rất thấp và tất cả các so sánh đều dựa trên các thử nghiệm đơn lẻ.
Tài liệu tham khảo
- Drugbank, Pazopanib, truy cập ngày 16 tháng 11 năm 2023.
- Hofmann F, Hwang EC, Lam TB, Bex A, Yuan Y, Marconi LS, Ljungberg B. Targeted therapy for metastatic renal cell carcinoma. Cochrane Database Syst Rev. 2020 Oct 14;10(10):CD012796. doi: 10.1002/14651858.CD012796.pub2. PMID: 33058158; PMCID: PMC8094280.
- Pubchem, Pazopanib, truy cập ngày 16 tháng 11 năm 2023.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội.
Liệu pháp nhắm trúng đích
0 đ
Xuất xứ: United Kingdom
Liệu pháp nhắm trúng đích
0 đ
Xuất xứ: Ấn Độ