Chưa có sản phẩm trong giỏ hàng.
Mobocertinib
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
propan-2-yl 2-[4-[2-(dimethylamino)ethyl-methylamino]-2-methoxy-5-(prop-2-enoylamino)anilino]-4-(1-methylindol-3-yl)pyrimidine-5-carboxylate
Nhóm thuốc
Thuốc chống ung thư
Mã ATC
L – Chất chống ung thư và điều hòa miễn dịch
L01 – Thuốc chống ung thư
L01E – Chất ức chế protein kinase
L01EB – Thuốc ức chế thụ thể yếu tố tăng trưởng biểu bì (egfr) tyrosine kinase
L01EB10 – Mobocertinib
Mã UNII
39HBQ4A67L
Mã CAS
1847461-43-1
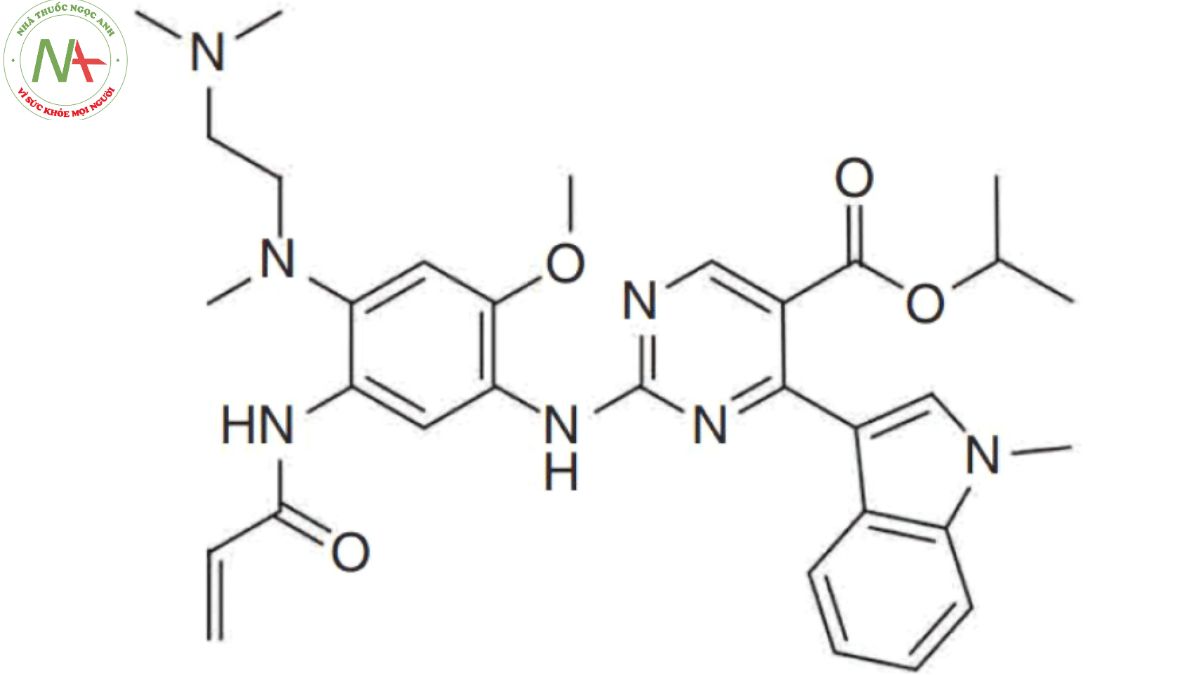
Cấu trúc phân tử
Công thức phân tử
C32H39N7O4
Phân tử lượng
585.7 g/mol
Cấu trúc phân tử
Mobocertinib có cấu trúc tương tự như osimertinib (chỉ khác nhau bởi sự có mặt của một nhóm este isopropyl thêm vào).
Các tính chất phân tử
Số liên kết hydro cho: 2
Số liên kết hydro nhận: 9
Số liên kết có thể xoay: 13
Diện tích bề mặt tôpô: 114Ų
Số lượng nguyên tử nặng: 43
Các tính chất đặc trưng
Tỷ trọng riêng: 1.2±0.1 g/cm3
Độ tan trong nước: 152mg/mL (pH 1.0); >17.6 mg/mL (pH 6.8)
Hằng số phân ly pKa: 8.87
Chu kì bán hủy: 18 giờ
Khả năng liên kết với Protein huyết tương: 99,3%
Dạng bào chế
Viên nang Mobocertinib 40 mg

Độ ổn định và điều kiện bảo quản
Để bảo quản Mobocertinib, nên tuân thủ các hướng dẫn sau:
- Giữ thuốc ở nơi khô ráo, thoáng mát và tránh ánh nắng trực tiếp.
- Không để thuốc ở nơi có nhiệt độ cao hơn 30 độ C hoặc thấp hơn 15 độ C.
- Không để thuốc trong tủ lạnh hoặc đông lạnh.
- Không để thuốc gần các nguồn nhiệt, lửa hoặc điện.
- Không để thuốc tiếp xúc với nước, hơi nước hoặc độ ẩm cao.
- Không mở nắp chai thuốc trừ khi cần thiết và đóng kín sau khi sử dụng.
- Không sử dụng thuốc quá hạn sử dụng hoặc có dấu hiệu biến đổi màu sắc, hình dạng hoặc mùi.
Nguồn gốc
Mobocertinib là thuốc gì? Mobocertinib, được bán dưới tên thương hiệu Exkivity của Takeda Pharmaceuticals Inc., là một loại chất ức chế kinase nhắm mục tiêu đối với thụ thể yếu tố tăng trưởng biểu bì ở con người (EGFR). Loại thuốc này đã đạt được sự chú ý đặc biệt trong việc điều trị ung thư phổi không phải tế bào nhỏ (NSCLC) do có đột biến chèn exon 20 trong gen EGFR. Điều này thường đi kèm với tiên lượng kém hơn so với các biến thể EGFR “cổ điển” gây ra NSCLC và có xu hướng kháng lại các loại chất ức chế EGFR tiêu chuẩn.
Mobocertinib xuất hiện như một lựa chọn hứa hẹn trong việc điều trị NSCLC kháng điều trị này, có khả năng ức chế các biến thể đột biến chèn EGFR exon 20 ở nồng độ thấp hơn 1,5 đến 10 lần so với mức cần thiết để ức chế EGFR loại hoang dã. Điều này làm cho nó trở thành một phương pháp hiệu quả trong điều trị bệnh lý này.
Quan trọng hơn, Mobocertinib đã nhận được sự chấp thuận từ Cơ quan Quản lý Dược phẩm và Thực phẩm Hoa Kỳ (FDA) vào tháng 9 năm 2021 một cách nhanh chóng. Nó được phê duyệt để điều trị NSCLC ở bệnh nhân tiến triển cục bộ hoặc đã di căn, đặc biệt là ở những bệnh nhân đã trải qua thất bại trong các liệu pháp điều trị trước đó sử dụng các phương pháp khác.
Dược lý và cơ chế hoạt động
Thụ thể yếu tố tăng trưởng biểu bì (EGFR) đóng vai trò quan trọng trong việc điều chỉnh các tín hiệu điều tiết sự tăng sinh tế bào. Đột biến trong protein này liên quan đến nhiều loại ung thư phổi, trong đó có ung thư phổi không phải tế bào nhỏ (NSCLC).
Trong khi hầu hết các đột biến EGFR liên quan đến NSCLC thường xuất hiện ở dạng đột biến điểm EGFR L858R hoặc mất đoạn exon 19, thường được gọi là đột biến EGFR “cổ điển”, thì đột biến chèn EGFR exon 20 ít phổ biến hơn. Những đột biến này thường đi kèm với tiên lượng tồi tệ hơn và có khả năng chống lại các loại chất ức chế EGFR tiêu chuẩn.
Mobocertinib cơ chế là một chất ức chế EGFR được thiết kế đặc biệt để tác động lên các biến thể đột biến chèn exon 20. Nó có dạng viên nang uống có thể dùng cùng hoặc không cùng với thức ăn mỗi ngày.
Mobocertinib có khả năng gây ra tăng độ dài khoảng QTc, với mức độ tăng phụ thuộc vào nồng độ thuốc. Điều này có thể dẫn đến các biến chứng đe dọa tính mạng như xoắn đỉnh. Bệnh nhân có các yếu tố nguy cơ cơ bản về kéo dài khoảng QTc cần xem xét sử dụng các phương pháp điều trị thay thế hoặc được giám sát chặt chẽ trong suốt quá trình điều trị.
Đồng thời, nên tránh sử dụng cùng lúc các loại thuốc có khả năng kéo dài QTc và các thuốc ức chế CYP3A, vì những loại thuốc này có thể làm tăng nồng độ mobocertinib và do đó tăng nguy cơ kéo dài QTc.
Ứng dụng trong y học
Mobocertinib chỉ định cho việc điều trị bệnh nhân trưởng thành mắc bệnh ung thư phổi không phải tế bào nhỏ (NSCLC) tiến triển cục bộ hoặc di căn, đặc biệt là cho những bệnh nhân có đột biến chèn exon 20 của thụ thể yếu tố tăng trưởng biểu bì (EGFR) và đã trải qua hóa trị liệu dựa trên bạch kim trước đó mà bệnh vẫn tiến triển hoặc tái phát.
Dược động học
Hấp thu
Sinh khả dụng tuyệt đối trung bình của mobocertinib là 37%, và thời gian đạt đỉnh tuyệt đối trung bình (Tmax) là khoảng 4 giờ sau khi uống một liều duy nhất 160 mg mobocertinib khi đang đói. Cmax (độ cao tương ứng của nồng độ thuốc) và AUC0-inf (diện tích dưới đường cong nồng độ thời gian vô hạn) trung bình lần lượt là 45,8 ng/mL và 862 ng·h/mL.
Phân bố
Thể tích phân bố biểu kiến trung bình của mobocertinib là khoảng 3.509 L ở trạng thái ổn định. Mobocertinib và các chất chuyển hóa của nó gắn kết nhiều với protein trong huyết tương, tuy nhiên, các protein cụ thể mà chúng kết nối vẫn chưa được làm rõ. Sau khi uống, mobocertinib liên kết với protein 99,3%, AP32960 liên kết với protein 99,5%, và AP32914 liên kết với protein 98,6%.
Chuyển hóa
Mobocertinib chủ yếu được chuyển hóa thông qua enzyme CYP3A thành hai chất chuyển hóa có hoạt tính là AP32960 và AP32914, chiếm lần lượt 36% và 4% AUC mol kết hợp của nó.
Thải trừ
Sau khi uống mobocertinib, khoảng 76% liều dùng được tìm thấy trong phân (trong đó có 6% ở dạng thuốc gốc không đổi), và chỉ có 4% được tìm thấy trong nước tiểu (trong đó có 1% ở dạng thuốc gốc không đổi). Chất chuyển hóa AP32960 được tìm thấy ở mức 12% trong phân và 1% trong nước tiểu, trong khi chất chuyển hóa AP32914 nằm dưới giới hạn phát hiện ở cả hai.
Ở trạng thái ổn định, độ thanh thải qua đường uống trung bình rõ ràng của mobocertinib và hai chất chuyển hóa có hoạt tính của nó, AP32960 và AP32914, lần lượt là 138 L/giờ, 149 L/giờ và 159 L/giờ. Thời gian bán hủy trung bình của mobocertinib và hai chất chuyển hóa có hoạt tính của nó, AP32960 và AP32914, lần lượt là 18 giờ, 24 giờ và 18 giờ.
Độc tính ở người
Các tác dụng phụ của Mobocertinib có thể gồm kích động, sưng mắt, sưng môi và sưng chân, mất tầm nhìn, mất ý thức, giảm lượng nước tiểu, đau đầu, tình trạng thù địch, tiêu chảy, trầm cảm, chói mắt, ngất xỉu, tình trạng thờ ơ, lo lắng, buồn nôn, co giật, tăng cân và mệt mỏi cùng với sưng phù. Các tác dụng phụ khác có thể ít phổ biến hơn, bao gồm cảm giác ớn lạnh, ho, giãn tĩnh mạch cổ, khó chịu và khó thở.
Ngoài ra, khi sử dụng Mobocertinib, còn cần lưu ý đến các tác dụng phụ đáng chú ý như đau bụng, ợ chua, ợ nóng, rụng tóc hoặc tóc mỏng đi, đau xương, đau họng, nghẹt mũi, khó nuốt, buồn nôn và yếu tay chân.
Đối với quá liều Mobocertinib, hiện chưa có dữ liệu cụ thể. Tuy nhiên, các triệu chứng quá liều có thể tương tự với các tác dụng phụ của Mobocertinib, bao gồm vấn đề về tiêu hóa, đau, mệt mỏi và phát ban.
Tính an toàn
Dựa trên cơ chế hoạt động và dữ liệu từ các nghiên cứu trên động vật, Mobocertinib có tiềm năng gây hại cho thai nhi khi sử dụng trong phụ nữ mang thai. Vì vậy, phụ nữ có khả năng sinh sản nên áp dụng biện pháp tránh thai không liên quan đến nội tiết một cách hiệu quả trong suốt quá trình điều trị bằng Mobocertinib và trong khoảng thời gian một tháng sau khi dùng liều cuối cùng của thuốc.
Đối với nam giới có bạn tình nữ có khả năng sinh sản, cũng được khuyến cáo sử dụng biện pháp tránh thai hiệu quả trong quá trình điều trị bằng Mobocertinib và trong vòng một tuần sau khi dùng liều cuối cùng.
Hiện chưa có dữ liệu về việc Mobocertinib hoặc các chất chuyển hóa của nó có tồn tại trong sữa mẹ hoặc có tác động đối với trẻ khi được bú sữa mẹ. Tuy nhiên, vì có thể xảy ra các phản ứng bất lợi nghiêm trọng đối với trẻ khi được bú sữa mẹ, phụ nữ nên tránh cho con bú trong suốt thời gian điều trị bằng Mobocertinib và trong một tuần sau khi dùng liều cuối cùng của thuốc.
Tương tác với thuốc khác
Khi sử dụng Mobocertinib cùng với các chất ức chế CYP3A mạnh hoặc trung bình, có khả năng tăng nồng độ của Mobocertinib trong huyết tương, dẫn đến tăng nguy cơ xảy ra các tác dụng phụ, bao gồm việc kéo dài khoảng QTc.
Tương tự, việc sử dụng Mobocertinib đồng thời với các chất nền CYP3A có thể làm giảm nồng độ của chất nền CYP3A trong huyết tương.
Ngoài ra, khi sử dụng Mobocertinib đồng thời với các loại thuốc có tác dụng kéo dài khoảng QTc, có thể tăng nguy cơ kéo dài khoảng QTc.
Lưu ý khi sử dụng Mobocertinib
Trước khi bắt đầu sử dụng Mobocertinib, cần thực hiện kiểm tra giá trị khoảng QTc cơ bản. Sau đó, quá trình theo dõi thường xuyên của khoảng QTc và chất điện giải trong huyết thanh là quan trọng. Để đảm bảo an toàn, tránh sử dụng Mobocertinib cùng lúc với các loại thuốc kéo dài khoảng QTc và chất ức chế CYP3A mạnh.
Trong thử nghiệm, 4,3% bệnh nhân gặp vấn đề về bệnh phổi kẽ/viêm phổi. Nếu bạn bắt gặp các triệu chứng như khó thở, ho, sốt, hãy ngừng sử dụng ngay lập tức và tìm kiếm sự chăm sóc y tế.
Trước và trong quá trình sử dụng Mobocertinib, cần kiểm tra chức năng tim và tần suất tống máu để đảm bảo tình trạng sức khỏe của bạn.
Nếu bạn gặp tiêu chảy, hãy nhớ rằng nó có thể gây mất nước và rối loạn điện giải. Do đó, bạn nên sử dụng thuốc chống tiêu chảy và bổ sung nước cũng như điện giải theo hướng dẫn.
Cuối cùng, trước khi sử dụng Mobocertinib, đừng quên đọc kỹ tờ hướng dẫn sử dụng thuốc để đảm bảo sử dụng đúng cách và an toàn.
Một vài nghiên cứu của Mobocertinib trong Y học
Kết quả điều trị và độ an toàn của Mobocertinib ở những bệnh nhân được điều trị trước bằng bạch kim mắc bệnh ung thư phổi không phải tế bào nhỏ di căn dương tính với EGFR Exon 20: Giai đoạn 1/2 Thử nghiệm lâm sàng không ngẫu nhiên nhãn mở
Tầm quan trọng: Ung thư phổi không phải tế bào nhỏ di căn (mNSCLC) có đột biến chèn EGFR exon 20 (EGFRex20ins) có liên quan đến tiên lượng xấu. Mobocertinib là một chất ức chế tyrosine kinase đường uống được thiết kế để nhắm mục tiêu có chọn lọc các đột biến EGFRex20ins.
Mục tiêu: Để đánh giá kết quả điều trị và độ an toàn của mobocertinib ở những bệnh nhân mắc mNSCLC dương tính với EGFRex20ins đã được điều trị trước đó.
Thiết kế, bối cảnh và người tham gia: Thử nghiệm lâm sàng không ngẫu nhiên gồm 3 phần, nhãn mở, giai đoạn 1/2 này với đoàn hệ tăng liều/mở rộng liều (28 địa điểm ở Hoa Kỳ) và đoàn hệ mở rộng một cánh tay (EXCLAIM; 40 ở Châu Á, Châu Âu và Bắc Mỹ) được tiến hành trong khoảng thời gian từ tháng 6 năm 2016 đến tháng 11 năm 2020 (ngày ngừng dữ liệu).
Nhóm phân tích chính là đoàn hệ bệnh nhân được điều trị trước bằng bạch kim (PPP) và đoàn hệ EXCLAIM. Nhóm thuần tập PPP bao gồm 114 bệnh nhân mắc mNSCLC dương tính với EGFRex20ins đã được điều trị trước bằng bạch kim đã nhận được mobocertinib 160 mg một lần mỗi ngày từ các nhóm thuần tập tăng liều (n = 6), mở rộng liều (n = 22) và EXCLAIM (n = 86). Đoàn hệ EXCLAIM bao gồm 96 bệnh nhân có mNSCLC dương tính với EGFRex20ins đã được điều trị trước đó (10 bệnh nhân không được điều trị trước bằng bạch kim và do đó đã bị loại khỏi đoàn hệ PPP).
Can thiệp: Mobocertinib 160 mg mỗi ngày một lần.
Các kết quả và thước đo chính: Điểm cuối chính của nhóm thuần tập PPP và EXCLAIM đã được xác nhận là tỷ lệ phản hồi khách quan (ORR) được đánh giá bởi ủy ban đánh giá độc lập (IRC). Các điểm cuối thứ cấp bao gồm ORR được xác nhận bởi người nghiên cứu, thời gian đáp ứng, sống sót không tiến triển, sống sót tổng thể và độ an toàn.
Kết quả: Trong số các nhóm thuần tập PPP (n = 114) và EXCLAIM (n = 96), độ tuổi trung bình (phạm vi) lần lượt là 60 (27-84) và 59 (27-80); hầu hết bệnh nhân là phụ nữ (lần lượt là 75 [66%] và 62 [65%]) và thuộc chủng tộc châu Á (lần lượt là 68 [60%] và 66 [69%]).
Tại thời điểm dừng dữ liệu, thời gian theo dõi trung bình là 14,2 tháng trong nhóm PPP (trung bình 2 chế độ điều trị chống ung thư trước đó; 40 [35%] có di căn não cơ bản), với ORR được xác nhận là 28% (KTC 95%, 20% -37%) theo đánh giá của IRC và 35% (95% CI, 26%-45%) theo đánh giá của người điều tra; thời gian đáp ứng trung bình theo đánh giá của IRC là 17,5 tháng (95% CI, 7,4-20,3).
Tỷ lệ sống sót không tiến triển trung bình theo đánh giá của IRC là 7,3 tháng (95% CI, 5,5-9,2). Thời gian sống thêm trung bình là 24,0 tháng (95% CI, 14,6-28,8).
Trong đoàn hệ EXCLAIM, thời gian theo dõi trung bình là 13,0 tháng, với đánh giá ORR được xác nhận bởi IRC là 25% (95% CI, 17%-35%) và theo đánh giá của người nghiên cứu là 32% (95% CI, 23-43%). Các tác dụng phụ liên quan đến điều trị phổ biến nhất là tiêu chảy và phát ban.
Kết luận và mức độ liên quan: Trong thử nghiệm lâm sàng không ngẫu nhiên giai đoạn 1/2, nhãn mở này, mobocertinib có liên quan đến lợi ích có ý nghĩa lâm sàng ở những bệnh nhân mắc mNSCLC dương tính với EGFRex20ins đã được điều trị trước đó, với hồ sơ an toàn có thể kiểm soát được.
Tài liệu tham khảo
- Drugbank, Mobocertinib, truy cập ngày 15 tháng 11 năm 2023.
- Pubchem, Mobocertinib, truy cập ngày 15 tháng 11 năm 2023.
- Zhou C, Ramalingam SS, Kim TM, Kim SW, Yang JC, Riely GJ, Mekhail T, Nguyen D, Garcia Campelo MR, Felip E, Vincent S, Jin S, Griffin C, Bunn V, Lin J, Lin HM, Mehta M, Jänne PA. Treatment Outcomes and Safety of Mobocertinib in Platinum-Pretreated Patients With EGFR Exon 20 Insertion-Positive Metastatic Non-Small Cell Lung Cancer: A Phase 1/2 Open-label Nonrandomized Clinical Trial. JAMA Oncol. 2021 Dec 1;7(12):e214761. doi: 10.1001/jamaoncol.2021.4761. Epub 2021 Dec 16. Erratum in: JAMA Oncol. 2022 Feb 24;: Erratum in: JAMA Oncol. 2022 Sep 1;8(9):1359. PMID: 34647988; PMCID: PMC8517885.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội.
Liệu pháp nhắm trúng đích
0 đ
Xuất xứ: Nhật Bản