Chưa có sản phẩm trong giỏ hàng.
Lenalidomine

Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
3-(4-amino-1-oxo-2,3-dihydro-1H-isoindol-2-yl)piperidine-2,6-dione
Nhóm thuốc
Thuốc ức chế tăng sinh mạch máu; thuốc trị ung thư
Mã ATC
L — Chất kháng nhựa và điều chỉnh miễn dịch
L04 – Thuốc ức chế miễn dịch
L04A — Thuốc ức chế miễn dịch
L04AX — Thuốc ức chế miễn dịch khác
L04AX04 — Lenalidomide
Phân loại nguy cơ cho phụ nữ có thai
X
Mã UNII
F0P408N6V4
Mã CAS
191732-72-6
Cấu trúc phân tử
Công thức phân tử
C13H13N3O3
Phân tử lượng
259.2606 Da
Cấu trúc phân tử
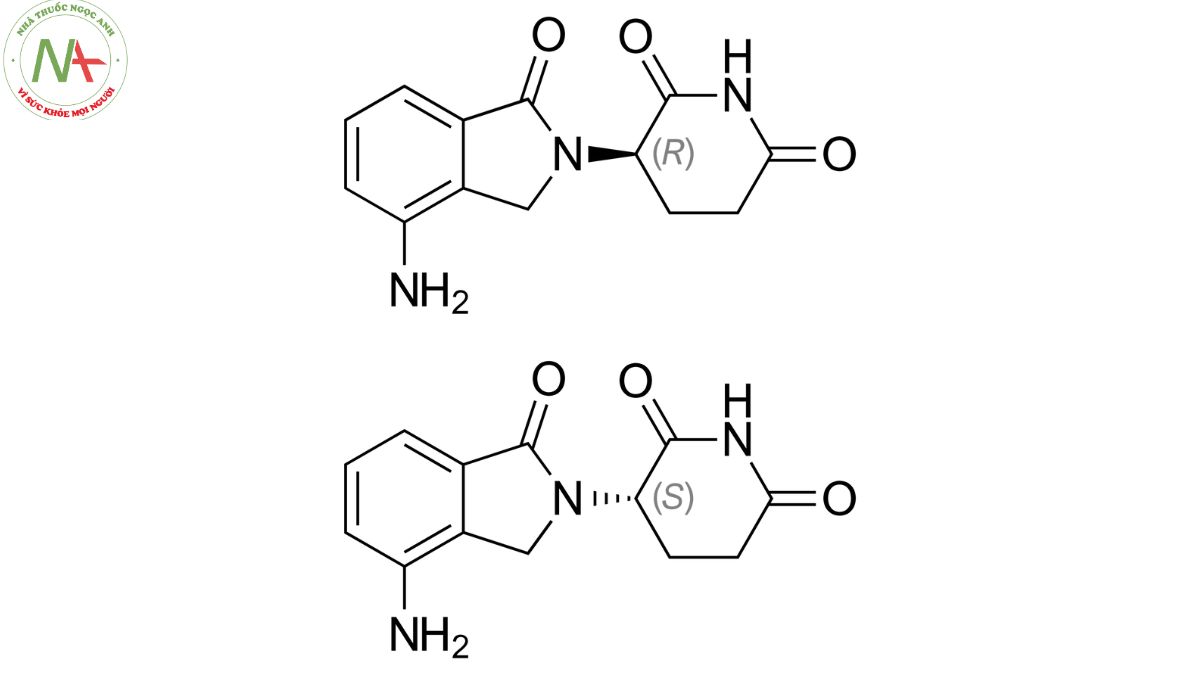
Lenalidomide là một chất tương tự 4-amino-glutamyl của thalidomide và giống như thalidomide, lenalidomide tồn tại dưới dạng hỗn hợp racemic của các dạng hoạt động S(-) và R(+).
Các tính chất phân tử
Số liên kết hydro cho: 2
Số liên kết hydro nhận: 4
Số liên kết có thể xoay: 1
Diện tích bề mặt tôpô: 92.5Ų
Số lượng nguyên tử nặng: 19
Các tính chất đặc trưng
Điểm sôi: 614.0±55.0 °C ở 760 mmHg
Tỷ trọng riêng: 1.5±0.1 g/cm3
Độ tan trong nước: 49 mg/mL
Hằng số phân ly pKa: 2.31
Chu kì bán hủy: 3 – 5 giờ
Khả năng liên kết với Protein huyết tương: 30%
Dạng bào chế
Viên nang: 2.5 mg, 5 mg, 7.5 mg, Thuốc lenalidomide 10mg (Lenalid 10), 15 mg, 25 mg (Revlimid)

Độ ổn định và điều kiện bảo quản
Theo hướng dẫn của nhà sản xuất, Thuốc Lenalidomide nên được bảo quản ở nhiệt độ phòng (15-30°C) và tránh ánh sáng trực tiếp. Ngoài ra, thuốc cũng nên được giữ khô ráo và không tiếp xúc với không khí. Nếu thuốc bị ẩm, mốc, nứt vỡ hoặc thay đổi màu sắc, hình dạng hoặc mùi, người dùng không nên sử dụng và nên liên hệ với bác sĩ hoặc dược sĩ để được tư vấn.
Nguồn gốc
Lenalidomide là thuốc gì? Lenalidomide, trước đây được biết đến với tên gọi CC-5013, là một loại thuốc điều hòa hệ miễn dịch, sở hữu các đặc tính kháng ung thư, chống tạo mạch và chống viêm hiệu quả. Thuốc này là một dạng biến thể của thalidomide, cụ thể là một chất tương tự của 4-amino-glutamyl. Nổi bật với khả năng an toàn và hiệu quả cao hơn, lenalidomide vượt trội so với thalidomide trong việc giảm thiểu tác dụng phụ và độc tính, đánh dấu một bước tiến quan trọng trong lĩnh vực điều trị y tế.
Dược lý và cơ chế hoạt động
Lenalidomide có tác dụng gì? Trong bối cảnh các bệnh ung thư huyết học, hệ thống miễn dịch thường bị rối loạn, biểu hiện qua sự thay đổi của mạng lưới cytokine trong môi trường vi mô của khối u, sự suy giảm trong điều hòa tế bào T và giảm hoạt động của tế bào NK. Lenalidomide, một chất điều hòa miễn dịch với đặc tính chống ung thư, chống tạo mạch và chống viêm, tác động trực tiếp lên các tế bào ác tính tạo máu thông qua việc tăng cường apoptosis và ức chế tăng sinh tế bào. Thuốc này cũng chậm lại sự phát triển của các khối u máu trong mô hình thực nghiệm, bao gồm cả đa u tủy, và hạn chế sự xâm lấn hoặc di căn của tế bào khối u.
Lenalidomide còn thúc đẩy tác động chống ung thư gián tiếp qua việc điều chỉnh hệ miễn dịch. Nó giảm sản xuất các cytokine gây viêm, liên quan đến nhiều loại khối u ác tính huyết học, đồng thời tăng cường khả năng miễn dịch của cơ thể bằng cách kích thích tế bào T và tăng hoạt động của tế bào NK. Đáng chú ý, lenalidomide có khả năng tăng sinh tế bào T mạnh hơn nhiều so với thalidomide, và trong môi trường thí nghiệm, nó tăng cường độc tế bào thông qua tế bào phụ thuộc kháng thể (ADCC), đặc biệt khi kết hợp với rituximab. Lenalidomide cũng được nghiên cứu trong điều trị các bệnh viêm nhiễm và tự miễn dịch nhờ vào đặc tính chống viêm của nó.
Lenalidomide cơ chế: Về mặt cơ chế hoạt động, lenalidomide là một loại thuốc đa chức năng. Nó thực hiện vai trò điều hòa miễn dịch bằng cách can thiệp vào quá trình sản xuất cytokine, tăng cường hoạt động của tế bào T và nâng cao khả năng tiêu diệt tế bào của tế bào NK. Đặc biệt, lenalidomide ức chế phức hợp ligase E3 ubiquitin vòng cullin một cách hiệu quả: khi gắn kết với cereblon, một thành phần chuyển đổi cơ chất của phức hợp, lenalidomide điều chỉnh phức hợp này để thu hút các protein cơ chất của ligase, bao gồm Ikaros (IKZF1), Aiolos (IKZF3) và CK1α.
Các chất nền này sau đó được gán nhãn và phân hủy qua hệ thống proteasomal. IKZF1 và IKZF3, các yếu tố phiên mã quan trọng cho sự biệt hóa tế bào B và tồn tại của tế bào ác tính, đặc biệt quan trọng trong quá trình này. Sự biểu hiện của yếu tố điều hòa interferon 4 (IRF4), yếu tố phiên mã quan trọng cho gen đặc trưng của u tủy, cũng được IKZF3 điều chỉnh. Điểm nổi bật của tác dụng điều hòa miễn dịch của lenalidomide có thể liên quan đến sự suy giảm của IKZF3, chất ức chế của gen interleukin 2 (IL2). Khi lenalidomide làm giảm mức IKZF3, sản xuất IL-2 tăng lên, từ đó kích thích sự tăng sinh của tế bào NK, tế bào NKT và tế bào T CD4+.
Lenalidomide cũng ức chế sản xuất các cytokine gây viêm như TNF-a, IL-1, IL-6 và IL-12, đồng thời thúc đẩy sản xuất cytokine IL-10 chống viêm. Hơn nữa, lenalidomide hoạt động như một phân tử đồng kích thích tế bào T, hỗ trợ tăng sinh tế bào TCD3 và tăng sản xuất IL-2 và IFN-γ trong tế bào lympho T, nhằm tăng cường độc tế bào của tế bào NK và ADCC. Nó còn ức chế sự biểu hiện và chức năng của các tế bào điều hòa T, thường xuất hiện dư thừa trong một số loại khối u ác tính huyết học.
Trong việc chống ung thư, lenalidomide thực hiện tác động trực tiếp bằng cách hạn chế sự tăng sinh và thúc đẩy quá trình apoptosis trong tế bào khối u. Thuốc này kích hoạt caspase-8, một enzyme có vai trò quan trọng trong quá trình apoptosis, làm tăng độ nhạy của tế bào khối u với quá trình tự hủy do FAS kích hoạt và đồng thời giảm hoạt động của NF-κB, một protein chống lại quá trình tự hủy tế bào.
Độc lập với khả năng điều hòa miễn dịch, lenalidomide cũng đóng vai trò quan trọng trong việc chống lại quá trình tạo mạch máu của khối u, thông qua việc ức chế các yếu tố tăng trưởng như yếu tố tăng trưởng nguyên bào sợi cơ bản (BFGF), yếu tố tăng trưởng nội mô mạch máu (VEGF), và yếu tố tăng trưởng tế bào gan. Trong môi trường thí nghiệm, lenalidomide đã chứng minh khả năng ức chế các phân tử kết dính tế bào như ICAM-1, LFA-1, β2 và β3, đồng thời cản trở chức năng nối khoảng cách giữa các tế bào, qua đó ngăn chặn hiệu quả sự di căn của tế bào ung thư.
Ứng dụng trong y học
Lenalidomide được ứng dụng rộng rãi trong việc chăm sóc bệnh nhân trưởng thành mắc các bệnh lý nghiêm trọng. Đối với bệnh đa u tủy (MM), lenalidomide kết hợp với dexamethasone làm liệu pháp chính, và cũng được sử dụng như một phương pháp duy trì sau quá trình ghép tế bào gốc tạo máu tự thân (auto-HSCT).
Trong trường hợp thiếu máu phụ thuộc vào truyền máu do hội chứng rối loạn sinh tủy (MDS) ở mức độ nguy cơ thấp hoặc trung bình 1, đặc biệt là những trường hợp có liên quan đến sự xóa bất thường về tế bào học 5q, lenalidomide được chỉ định như một lựa chọn điều trị hiệu quả.
Đối với bệnh nhân trưởng thành mắc bệnh ung thư hạch tế bào mantle (MCL), lenalidomide được áp dụng cho những trường hợp bệnh tái phát hoặc tiến triển sau hai phác đồ điều trị trước, trong đó ít nhất một liệu pháp đã bao gồm bortezomib.
Ngoài ra, lenalidomide còn được kết hợp với rituximab để điều trị cho bệnh nhân trưởng thành mắc bệnh u lympho nang (FL) và u lympho vùng biên (MZL) đã từng được điều trị trước đó, mở ra hướng tiếp cận mới trong việc chống lại các loại ung thư này.
Dược động học
Hấp thu
Lenalidomide có một quá trình hấp thu nhanh chóng và hiệu quả sau khi được dùng qua đường uống, với mức độ sinh khả dụng cao. Thời gian cực đại (Tmax) của nó có thể biến đổi từ 0,5 đến 6 giờ, thể hiện rõ tính tuyến tính trong dược động học: cả diện tích dưới đường cong (AUC) và nồng độ cực đại (Cmax) tăng tỷ lệ thuận với liều lượng. Điểm đáng chú ý là việc dùng nhiều lần không gây ra hiện tượng tích lũy thuốc trong cơ thể. Ở nam giới khỏe mạnh, Cmax đạt 413 ± 77 ng/ml và AUCinfinity là 1319 ± 162 h x ng/ml.
Phân bố
Lenalidomide có thể tích phân bố ở mức 75,8 ± 7,3 L ở nam giới khỏe mạnh. Khi xét nghiệm in vitro, lenalidomide có khoảng 30% liên kết với protein huyết tương, cho thấy mức độ tương tác đáng kể.
Chuyển hóa
Chuyển hóa của lenalidomide không chủ yếu diễn ra ở gan thông qua các enzyme CYP, và quá trình này chỉ đóng góp một phần nhỏ trong việc loại bỏ lenalidomide khỏi cơ thể người. Trong huyết tương, lenalidomide trải qua quá trình thủy phân tạo thành 5-hydroxy-lenalidomide và N-acetyl-lenalidomide. Tuy nhiên, lenalidomide không thay đổi vẫn là dạng chủ đạo trong máu, với các chất chuyển hóa chiếm dưới 5% so với nồng độ thuốc gốc.
Thải trừ
Thải trừ lenalidomide chủ yếu xảy ra qua đường tiểu ở dạng không thay đổi. Sau liều 25 mg lenalidomide đánh dấu phóng xạ, khoảng 90% liều (trong đó 4,59% dưới dạng chất chuyển hóa) được loại bỏ qua đường tiểu và 4% liều (1,83% dưới dạng chất chuyển hóa) qua phân trong vòng 10 ngày. Gần 85% liều được bài tiết qua nước tiểu trong 24 giờ đầu.
Ở người khỏe mạnh, thời gian bán hủy trung bình của lenalidomide là khoảng ba giờ trong phạm vi liều lâm sàng từ 5 đến 50 mg. Thời gian bán hủy này có thể biến đổi từ 3 đến 5 giờ đối với các bệnh nhân mắc bệnh đa u tủy, hội chứng loạn sản tủy hoặc u lympho tế bào vỏ. Độ thanh thải thận của lenalidomide thực sự vượt qua tốc độ lọc của cầu thận, ở mức 318 ± 41 mL/phút ở nam giới khỏe mạnh.
Độc tính ở người
Liều độc hại thấp nhất được ghi nhận (TDLo) khi sử dụng qua đường uống là 9 mg/kg trong vòng 4 tuần mỗi lần (không liên tục).
Trong lĩnh vực lâm sàng, kinh nghiệm quản lý tình trạng quá liều lenalidomide vẫn còn hạn chế. Trong các nghiên cứu với liều đơn, các đối tượng khỏe mạnh đã thử nghiệm với liều lên đến 400 mg.
Lenalidomide tác dụng phụ: Trong các thử nghiệm lâm sàng, độc tính được nhận thấy ở liều giới hạn chủ yếu bao gồm giảm bạch cầu trung tính và giảm tiểu cầu. Các tác động độc hại liên quan đến lenalidomide, trong một số trường hợp dẫn đến tử vong, bao gồm độc tính đối với phôi thai, giảm bạch cầu, giảm tiểu cầu, các vấn đề về tĩnh mạch (như huyết khối tĩnh mạch sâu và tắc mạch phổi), các sự cố huyết khối động mạch (bao gồm nhồi máu cơ tim và đột quỵ), phản ứng tim mạch nghiêm trọng, khối u ác tính nguyên phát thứ hai, nhiễm độc gan, phản ứng da nghiêm trọng, hội chứng ly giải khối u, phản ứng bùng phát khối u, suy giáp và cường giáp.
Tính an toàn
Lenalidomide đòi hỏi sự thận trọng cao do rủi ro gây dị tật bẩm sinh nghiêm trọng. Trước khi bắt đầu liệu pháp, việc xác nhận không mang thai là bắt buộc, và bệnh nhân cần tham gia vào Chương trình Chiến lược Giảm thiểu và Đánh giá Rủi ro Lenalidomide (REMS), một sáng kiến đảm bảo việc tuân thủ nghiêm ngặt các biện pháp phòng tránh thai.
Hiện chưa rõ liệu lenalidomide có mặt trong sữa mẹ hay không. Tuy nhiên, do nguy cơ gây ra các phản ứng nghiêm trọng ở trẻ sơ sinh, việc cho con bú không được khuyến khích trong thời gian sử dụng thuốc này. Điều này nhằm đảm bảo an toàn tối đa cho cả mẹ và trẻ.
Tương tác với thuốc khác
Digoxin: Khi sử dụng cùng lenalidomide với liều 10 mg mỗi ngày, có thể gây ra sự tăng 14% nồng độ digoxin trong máu, ảnh hưởng đến cách thức hoạt động của thuốc này.
Statin: Kết hợp lenalidomide với statin có thể nâng cao nguy cơ tiêu cơ vân, một tình trạng cần được quan tâm trong quá trình điều trị.
Dẫn xuất 5-Aminosalicylic Acid: Việc kết hợp chúng có thể tăng cường tác dụng ức chế tủy của lenalidomide, cần theo dõi chặt chẽ.
Vaccine BCG, varicella và vaccine bất hoạt: Lenalidomide có khả năng giảm hiệu quả của các loại vaccine này, làm thay đổi kết quả điều trị.
Dẫn xuất bisphosphonate, vaccine sống, tacrolimus, deferiprone: Khi dùng chung với lenalidomide, có thể gây tăng tác dụng phụ hoặc độc hại của các thuốc trên.
Dẫn xuất estrogen, dexamethasone: Sự kết hợp này có thể làm tăng khả năng hình thành huyết khối khi sử dụng lenalidomide, cần lưu ý trong quá trình điều trị.
Lưu ý khi sử dụng Lenalidomide
Khi dùng Lenalidomide, người dùng và nhà chăm sóc y tế cần lưu ý đến những vấn đề sau:
Ức chế tủy xương: Đa số bệnh nhân sử dụng Lenalidomide có thể gặp độc tính huyết học, biểu hiện qua giảm bạch cầu và giảm tiểu cầu.
Tác động lên thần kinh trung ương: Lenalidomide có thể gây chóng mặt hoặc mệt mỏi, đòi hỏi sự thận trọng khi bệnh nhân tham gia vào các hoạt động cần tập trung cao độ như lái xe hay vận hành máy móc.
Phản ứng da: Những phản ứng da nghiêm trọng như hội chứng Stevens-Johnson (SJS), hoại tử thượng bì nhiễm độc (TEN), và hội chứng DRESS có thể xảy ra và dẫn đến tử vong.
Độc tính gan: Trường hợp suy gan, thậm chí tử vong, đã được ghi nhận ở bệnh nhân dùng Lenalidomide kết hợp với dexamethasone.
Quá mẫn: Các tình trạng như phù mạch và phản ứng phản vệ đã được báo cáo. Thuốc nên được ngưng vĩnh viễn nếu xảy ra các phản ứng này.
Bệnh ác tính thứ phát: Các trường hợp bệnh huyết học ác tính (chủ yếu là bạch cầu cấp dòng tủy và hội chứng loạn sản tủy), khối u đặc ác tính và ung thư da không melanoma đã được ghi nhận trong điều trị bằng Lenalidomide.
Nguy cơ biến cố huyết khối: Sự gia tăng đáng kể nguy cơ biến cố huyết khối động mạch và tĩnh mạch ở bệnh nhân đa u tủy được điều trị bằng Lenalidomide kết hợp với dexamethasone.
Suy giáp và cường giáp: Đã được ghi nhận trong quá trình điều trị bằng Lenalidomide.
Bùng phát khối u: Xuất hiện trong điều trị bệnh bạch cầu mạn dòng lympho (CLL) và u lympho, với các triệu chứng như sốt nhẹ, đau, phát ban và sưng hạch bạch huyết.
Hội chứng ly giải khối u: Có trường hợp tử vong do hội chứng này đã được báo cáo khi sử dụng Lenalidomide.
Một vài nghiên cứu của Lenalidomide trong Y học
Phân tích tổng hợp về việc duy trì Lenalidomide sau ghép tế bào gốc tự thân (ASCT) trong bệnh đa u tủy mới được chẩn đoán (NDMM)
Mục đích: Đã có những thử nghiệm ngẫu nhiên có đối chứng (RCT) cho thấy rằng việc duy trì Lenalidomide sau ASCT có thể cải thiện thời gian sống không tiến triển (PFS) so với nhóm dùng giả dược hoặc chỉ quan sát. Tuy nhiên, không có RCT nào tập trung vào sống sót tổng thể (OS) làm mục tiêu chính. Vì vậy, một phân tích tổng hợp đã được thực hiện để đánh giá hiệu quả của Lenalidomide trong bối cảnh này một cách toàn diện.
Bệnh nhân và Phương pháp: Dữ liệu từ ba RCT (Cancer and Leukemia Group B 100104, Gruppo Italiano Malattie Ematologiche dell’Adulto RV-MM-PI-209 và Intergroupe Francophone du Myélome 2005-02) đã được sử dụng. Các nghiên cứu này đã đáp ứng các tiêu chí đặc biệt, bao gồm RCT ở bệnh nhân NDMM nhận ASCT, tiếp theo là duy trì bằng Lenalidomide so với giả dược hoặc quan sát, và có dữ liệu cấp độ bệnh nhân sẵn có.
Kết quả: Tổng cộng, 1.208 bệnh nhân đã được bao gồm trong phân tích (605 bệnh nhân trong nhóm duy trì Lenalidomide và 603 bệnh nhân trong nhóm giả dược hoặc quan sát). PFS trung bình là 52,8 tháng cho nhóm Lenalidomide so với 23,5 tháng cho nhóm giả dược hoặc quan sát. Về OS, sau thời gian theo dõi trung bình là 79,5 tháng, nhóm duy trì Lenalidomide chưa đạt đến mốc OS trung bình, trong khi nhóm giả dược hoặc quan sát đạt 86,0 tháng. Ngoài ra, nhóm duy trì Lenalidomide có tỷ lệ mắc bệnh ác tính nguyên phát thứ hai cao hơn so với nhóm giả dược hoặc quan sát, nhưng tỷ lệ tiến triển bệnh, tử vong hoặc tử vong do u tủy lại thấp hơn.
Kết luận: Phân tích này chứng minh rằng việc duy trì Lenalidomide sau ASCT không chỉ cải thiện PFS mà còn mang lại lợi ích về OS so với việc dùng giả dược hoặc chỉ quan sát ở bệnh nhân NDMM.
Tài liệu tham khảo
- Lenalidomide drugbank, Lenalidomide, truy cập ngày 24 tháng 12 năm 2023.
- McCarthy PL, Holstein SA, Petrucci MT, Richardson PG, Hulin C, Tosi P, Bringhen S, Musto P, Anderson KC, Caillot D, Gay F, Moreau P, Marit G, Jung SH, Yu Z, Winograd B, Knight RD, Palumbo A, Attal M. Lenalidomide Maintenance After Autologous Stem-Cell Transplantation in Newly Diagnosed Multiple Myeloma: A Meta-Analysis. J Clin Oncol. 2017 Oct 10;35(29):3279-3289. doi: 10.1200/JCO.2017.72.6679. Epub 2017 Jul 25. PMID: 28742454; PMCID: PMC5652871.
- Pubchem, Lenalidomide, truy cập ngày 24 tháng 12 năm 2023.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội.
Liệu pháp miễn dịch trong điều trị ung thư
3.800.000 đ
Xuất xứ: Ấn Độ