Chưa có sản phẩm trong giỏ hàng.
Gemcitabin
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
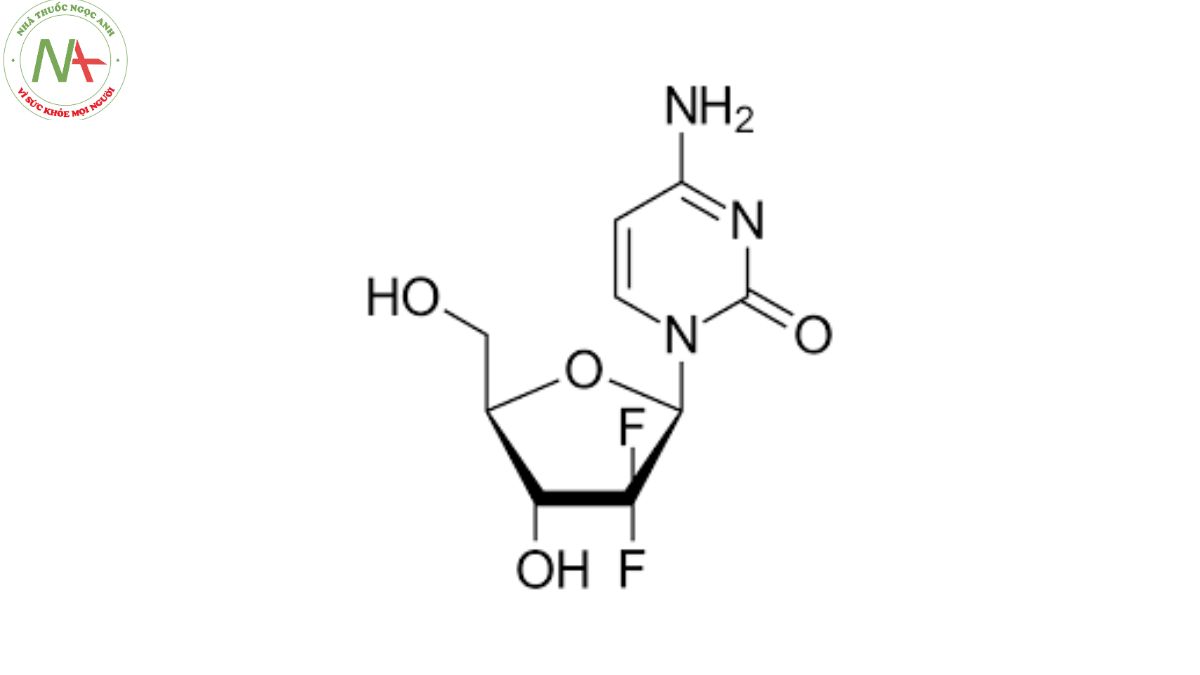
4-amino-1-[(2R,4R,5R)-3,3-difluoro-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidin-2-one
Nhóm thuốc
Thuốc chống ung thư, nhóm chống chuyển hóa, nucleosid pyrimidin tổng hợp
Mã ATC
L – Chất chống ung thư và điều hòa miễn dịch
L01 – Thuốc chống ung thư
L01B – Chất chống chuyển hóa
L01BC – Chất tương tự pyrimidine
L01BC05 – Gemcitabine
Mã UNII
B76N6SBZ8R
Mã CAS
95058-81-4
Cấu trúc phân tử
Công thức phân tử
C9H11F2N3O4
Phân tử lượng
263.20 g/mol
Cấu trúc phân tử
Gemcitabine là một 2′-deoxycytidine có các nhóm thế geminal fluoro ở vị trí 2′. Nó là một hợp chất organofluorine và pyrimidine 2′-deoxyribonucleoside.
Các tính chất phân tử
Số liên kết hydro cho: 3
Số liên kết hydro nhận: 6
Số liên kết có thể xoay: 2
Diện tích bề mặt tôpô: 108Ų
Số lượng nguyên tử nặng: 18
Các tính chất đặc trưng
Điểm nóng chảy: 168.64 °C
Điểm sôi: 482.7±55.0 °C ở 760mmHg
Tỷ trọng riêng: 1.8±0.1 g/cm3
Độ tan trong nước: 15.3g/L
Hằng số phân ly pKa: 3.6
Chu kì bán hủy: 42 – 94 phút và 4 – 10,5 giờ
Khả năng liên kết với Protein huyết tương:
Dạng bào chế
Thuốc bột: 200 mg (Gemcitabine Ebewe); Gemcitabine 1g; 1,5 g; 2 g dùng để pha dung dịch tiêm truyền tĩnh mạch.

Độ ổn định và điều kiện bảo quản
Bảo quản lọ thuốc bột nguyên vẹn ở nhiệt độ 20 – 25 °C.
Dung dịch thuốc đậm đặc (38 mg/ml) ổn định trong vòng 35 ngày. Dung dịch pha loãng trong natri clorid 0,9% ổn định trong 7 ngày ở nhiệt độ 23 °C và tránh ánh sáng. Tuy nhiên, nhà sản xuất khuyên nên sử dụng cả 2 dung dịch trên trong vòng 24 giờ. Không để trong tủ lạnh vì gây kết tinh.
Gemcitabine hydroclorid tương kỵ vật lý với aciclovir natri, amphotericin B, cefoperazon natri, cefotaxim natri, furosemid, ganciclovir natri, imipenem có cilastatin natri, irinotecan, methotrexate natri, methylprednisolon natri succinat, mezlocillin natri, mitomycin, piperacilin natri, piperacillin có tazobactam, prochlorperazine edisylate.
Không pha thuốc bằng các dung môi khác ngoài natri clorid 0,9%. Không trộn thuốc với bất kỳ thuốc nào khác.
Nguồn gốc
Trong những năm đầu thập niên 1980, tại phòng thí nghiệm của Eli Lilly and Company, nhà khoa học Larry Hertel đã chế tạo ra gemcitabine. Ban đầu, họ hy vọng rằng nó sẽ là một loại thuốc chống vi-rút. Tuy nhiên, các nghiên cứu tiền lâm sàng đã phát hiện ra khả năng tiêu diệt tế bào ung thư bạch cầu của nó trong môi trường ống nghiệm.
Chỉ sau khoảng một thập kỷ, vào đầu thập niên 1990, gemcitabine bước vào giai đoạn thử nghiệm lâm sàng. Thành quả từ các thử nghiệm trên bệnh nhân mắc ung thư tuyến tụy cho thấy thuốc này đã giúp gia tăng đáng kể thời gian sống sót sau một năm. Chính vì vậy, gemcitabine đã được Anh công nhận vào năm 1995 và một năm sau đó, nó nhận được sự chấp thuận từ FDA cho việc điều trị ung thư tuyến tụy. Đến năm 1998 và 2004, gemcitabine lần lượt được FDA và các cơ quan y tế khác phê duyệt để điều trị ung thư phổi không phải tế bào nhỏ và ung thư vú di căn.
Dược lý và cơ chế hoạt động
Thuốc Gemcitabine thuộc nhóm chất chống chuyển hóa pyrimidin, hoạt động bằng cách ngăn chặn sự tổng hợp DNA. Cơ chế hoạt động chính của nó là ức chế hai enzyme quan trọng: DNA polymerase và ribonucleotide reductase, chúng đặc trưng cho pha S của chu kỳ phân chia tế bào. Khi vào trong tế bào, gemcitabine được chuyển đổi thành gemcitabine monophosphat nhờ enzym deoxycytidine kinase. Sau đó, chất này tiếp tục được biến đổi thành hai dẫn xuất hoạt động: gemcitabine diphosphat và gemcitabine triphosphat. Trong đó, gemcitabine diphosphat làm giảm hoạt động của ribonucleotide reductase, làm chậm quá trình tổng hợp DNA, trong khi gemcitabine triphosphat liên kết với DNA và ngăn chặn hoạt động của DNA polymerase.
Ứng dụng trong y học
Gemcitabine là một loại thuốc hóa trị được sử dụng rộng rãi trong y học để điều trị nhiều loại bệnh ung thư. Gemcitabine hoạt động bằng cách ngăn chặn quá trình sao chép DNA của tế bào ung thư, từ đó gây chết tế bào ung thư và ngăn chặn sự phát triển của bệnh. Một số bệnh ung thư mà Gemcitabine thường được chỉ định gồm:
Ung thư tụy: Gemcitabine là một trong những lựa chọn thuốc hóa trị hàng đầu cho bệnh nhân mắc bệnh ung thư tụy ở giai đoạn tiến triển.
Ung thư phổi không tế bào nhỏ: Trong một số trường hợp, Gemcitabine có thể được sử dụng cùng với các loại thuốc khác để điều trị ung thư phổi không tế bào nhỏ.
Ung thư bàng quang: Gemcitabine thường được kết hợp với các thuốc khác như cisplatin để điều trị ung thư bàng quang.
Ung thư buồng trứng: Đôi khi, Gemcitabine cũng được chỉ định cho những bệnh nhân mắc bệnh ung thư buồng trứng đã tái phát hoặc không phản ứng với các liệu pháp điều trị khác.
Dược động học
Hấp thu và phân bố
Khi truyền qua tĩnh mạch, gemcitabine mau chóng được phân bố trong cơ thể, chủ yếu bị chuyển hóa bởi cytidine deaminase tại gan, thận, máu và nhiều mô khác. Chỉ sau 30 phút từ khi truyền, hàm lượng thuốc đạt đỉnh trong huyết tương. Thể tích phân bố dao động từ 50 lít/m2 nếu thời gian truyền dưới 70 phút và lên đến 370 lít/m2 nếu truyền kéo dài hơn. Một điểm đáng chú ý là thuốc chỉ ít kết hợp với protein trong huyết tương.
Chuyển hóa và thải trừ
Trong tế bào, gemcitabine biến đổi bởi nucleotide kinase thành các dẫn xuất diphosphat và triphosphate nucleotide có hoạt tính. Đáng lưu ý, phụ nữ có tỷ lệ loại bỏ thuốc chậm hơn khoảng 25% so với nam giới. Tùy vào thời gian truyền, nửa đời loại bỏ thuốc trong cơ thể có sự biến đổi: từ 42 – 94 phút nếu truyền trong vòng 1 giờ và từ 4 – 10,5 giờ nếu truyền kéo dài từ 3 – 4 giờ. Trong tế bào, nửa đời thải trừ của gemcitabine triphosphat là 0,7 – 12 giờ. Hầu hết thuốc, từ 92 – 98%, được loại bỏ qua nước tiểu (phần lớn là dưới dạng chất chuyển hóa uracil không hoạt động) và một lượng rất nhỏ, dưới 1%, qua phân.
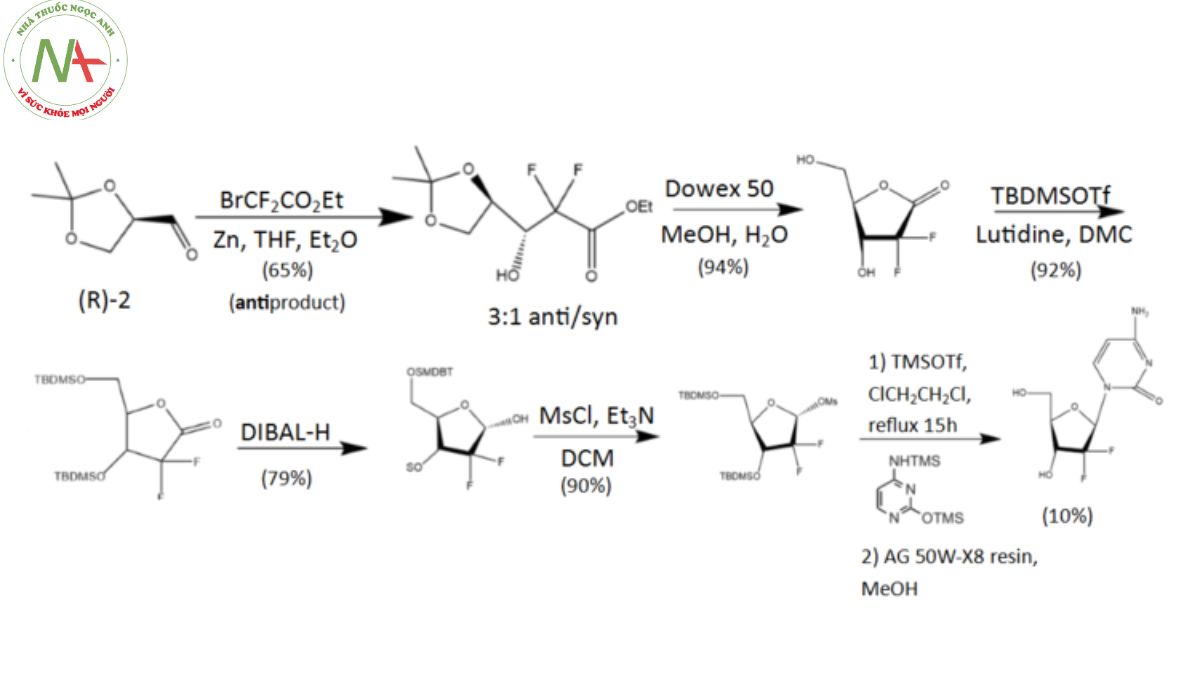
Phương pháp sản xuất
Quá trình tổng hợp gemcitabine ban đầu được tiến hành trong phòng thí nghiệm của Công ty Eli Lilly. Tất cả khởi đầu từ enantiopure D-glyceraldehyde (R)-2, một nguyên liệu có nguồn gốc từ D-mannitol và có thể được tổng hợp qua 2–7 giai đoạn. Flo sau đó được kết hợp thông qua phương pháp “building block”, dựa trên ethyl bromodifluoroacetate. Qua phản ứng Reformatsky dưới điều kiện tiêu chuẩn, một hỗn hợp có tỷ lệ 3:1 giữa các chất không đối xứng và đồng bộ được hình thành, trong đó có một sản phẩm chính. Sự tách rời giữa các chất đồng phân không đối quang được thực hiện bằng HPLC, dẫn đến thu được anti-3 gemcitabine với hiệu suất lên tới 65%.
Đáng chú ý, ít nhất đã có hai phương pháp tổng hợp khác được nghiên cứu và phát triển bởi các nhóm nghiên cứu khác.
Độc tính ở người
Tác dụng không mong muốn (ADR)
Rất thường gặp (ADR > 10/100):
- Tim mạch: Phù ở các bộ phận ngoại vi (20%), phù tổng quát (13%).
- Hệ thần kinh: Đau (10-48%), sốt (30-41%), mất giấc ngủ (5-11%).
- Da: Phát ban (24-30%), mất tóc (15-18%), cảm giác ngứa (13%).
- Hệ tiêu hóa: Nôn mửa (64-71%), táo bón (10-31%), tiêu chảy (19-30%), viêm niêm mạc miệng (10-14%).
- Huyết học: Thiếu máu (65-73%), giảm bạch cầu (62-71%), giảm bạch cầu trung tính (61-63%), giảm tiểu cầu (24-47%), chảy máu (4-17%). Ức chế hoạt động của tủy xương hạn chế việc tăng liều.
- Gan: Tăng men gan (67-78%), tăng phosphatase kiềm (55-77%), tăng bilirubin (13-26%).
- Thận: Có protein trong nước tiểu (10-45%), có máu trong nước tiểu (13-35%), tăng nitơ urê trong máu (8-16%).
- Hệ hô hấp: Khó thở (6-23%).
- Khác: Cảm giác giống triệu chứng cảm cúm (19%), nhiễm trùng (8-16%).
Thường gặp (1/100 < ADR < 10/100):
- Tại chỗ tiêm: Kích ứng (4%).
- Hệ thần kinh: Mất cảm giác (2-10%).
- Thận: Tăng creatinin (2-8%).
- Hô hấp: Bị co thắt phế quản (<2%).
Ít gặp (ADR < 1/100): Bao gồm hội chứng suy hô hấp cấp tính, phản vệ, chán ăn, rối loạn nhịp tim, nổi bọng nước trên da, viêm mô, viêm mạch máu ngoại biên, viêm mũi, nhiễm trùng huyết, và mệt mỏi, cùng với nhiều triệu chứng khác.
Mặc dù hầu hết tác dụng phụ của Gemcitabine có thể được giải quyết và không đòi hỏi phải dừng trị liệu, việc giảm liều hoặc tạm thời ngừng dùng thuốc có thể được xem xét. Nên theo dõi sát sao sức khỏe bệnh nhân, đặc biệt là tình trạng máu, gan, thận và phổi.
Quá liều
Khi sử dụng quá liều gemcitabine, người bệnh có thể gặp phải các triệu chứng như: ức chế hoạt động của tủy xương, rối loạn giác quan, viêm niêm mạc miệng, xuất hiện loét trên da, nổi ban đỏ, cũng như các biểu hiện nặng của tác dụng phụ khác.
Hiện tại, chưa có phương pháp chữa trị đặc hiệu cho trường hợp ngộ độc với gemcitabine. Phương án điều trị chủ yếu là giảm thiểu và hỗ trợ triệu chứng. Trong trường hợp xảy ra sớm, việc sử dụng thuốc chống nôn và chống tiêu chảy có thể giúp làm giảm biểu hiện của triệu chứng.
Đối với những bệnh nhân gặp vấn đề về mất nước, nôn mửa hoặc tiêu chảy nặng, việc theo dõi và điều chỉnh cân bằng nước và điện giải là vô cùng quan trọng.
Trong trường hợp tủy xương bị ức chế, việc sử dụng các yếu tố kích thích sự sản xuất bạch cầu như filgrastim (5 microgam/kg/ngày) có thể được tiêm dưới da hoặc truyền tĩnh mạch trong khoảng 15-30 phút.
Tính an toàn
Thuốc có tiềm năng gây hại cho thai nghén, bao gồm nguy cơ gây dị tật và thai tử vong, dựa trên các nghiên cứu thực nghiệm. Khi quyết định sử dụng thuốc cho phụ nữ mang thai hoặc nếu họ thụ thai trong quá trình điều trị, việc thông báo đầy đủ về các rủi ro liên quan đến thai nghén là bắt buộc.
Hiện tại, chưa rõ liệu thuốc có được bài tiết qua sữa mẹ hay không. Do đó, trước khi sử dụng thuốc cho phụ nữ đang cho con bú, cần cân nhắc cẩn thận giữa lợi ích điều trị và những rủi ro tiềm tàng đối với trẻ sơ sinh.
Tương tác với thuốc khác
Gemcitabine có khả năng tăng cường nồng độ và tác dụng của bleomycin, fluorouracil, natalizumab và vắc xin sống.
Tác dụng của Gemcitabine có thể bị giảm khi kết hợp với vắc xin bất hoạt hoặc thuốc kháng vitamin K.
Trastuzumab có thể củng cố tác dụng của Gemcitabine, trong khi Echinacea có khả năng giảm bớt hiệu quả của nó.
Tương tác giữa Gemcitabine với các liệu pháp xạ trị:
- Khi áp dụng xạ trị đồng thời với Gemcitabine hoặc trong khoảng cách dưới 7 ngày, sự tương tác có thể gây ra nhiều biến chứng phụ thuộc vào liều lượng, tần suất và phạm vi chiếu xạ. Đối với bệnh nhân mắc bệnh ung thư phổi không phải loại tế bào nhỏ, Gemcitabine có thể tăng độ nhạy với tia xạ, dẫn đến các biến chứng nghiêm trọng, bao gồm viêm thực quản và viêm phổi. Tuy nhiên, khi kết hợp liều thấp của Gemcitabine và xạ trị, tác dụng phụ có thể được dự báo.
- Trong trường hợp Gemcitabine và xạ trị không được áp dụng cùng một lúc và có khoảng cách lớn hơn 7 ngày, không có bằng chứng cho thấy sự gia tăng trong độc tính, ngoại trừ việc tái phát phản ứng do xạ trị.
Lưu ý khi sử dụng Gemcitabine
Đối với người cao tuổi: Do khả năng lọc thuốc giảm và thời gian thuốc lưu trong cơ thể dài hơn, việc điều chỉnh liều lượng có thể cần thiết.
Đối với phụ nữ: Họ có xu hướng thanh thải thuốc chậm hơn, nên cần quan sát và điều chỉnh liều nếu cần.
Người có tình trạng gan yếu hoặc tiền sử liên quan đến gan, như viêm gan, di căn gan, xơ gan, hay thậm chí là nghiện rượu, cần phải sử dụng thuốc một cách cẩn trọng, vì tình trạng bệnh sẽ có khả năng trở nên nặng hơn.
Những người mắc chứng suy thận cũng cần phải rất thận trọng khi dùng thuốc.
Trước mỗi lần sử dụng, nên kiểm tra chỉ số máu toàn phần và số lượng tiểu cầu.
Định kỳ kiểm tra chức năng gan và thận trước và sau khi sử dụng thuốc.
Khi kết hợp với cisplatin, quá trình theo dõi cần bao gồm các chỉ số điện giải như kali, magie và calci.
Gemcitabine có thể làm mất tập trung, do đó, bệnh nhân nên tránh lái xe và vận hành máy móc.
Một vài nghiên cứu của Gemcitabine trong Y học
Tác dụng của kháng thể MUC5AC (NPC-1C) được sử dụng cùng với Gemcitabine thế hệ thứ hai và Nab-Paclitaxel đối với sự sống sót của bệnh nhân ung thư biểu mô tuyến ống tụy tiến triển: Một thử nghiệm lâm sàng ngẫu nhiên
Tầm quan trọng: Các lựa chọn điều trị bị hạn chế đối với những bệnh nhân ung thư biểu mô tuyến tụy (PDAC) tiến triển ngoài 5-fluorouracil, leucovorin, irinotecan và oxaliplatin (FOLFIRINOX) đầu tiên, với những người như vậy thường được điều trị bằng gemcitabine và nab-paclitaxel.
Mục tiêu: Để xác định xem NPC-1C, một kháng thể chống lại MUC5AC, có thể làm tăng hiệu quả của gemcitabine và nab-paclitaxel bậc hai ở bệnh nhân mắc PDAC tiến triển hay không.
Thiết kế, bối cảnh và người tham gia: Thử nghiệm lâm sàng giai đoạn II ngẫu nhiên, đa trung tâm này đã tuyển chọn những bệnh nhân mắc PDAC tiến triển trong khoảng thời gian từ tháng 4 năm 2014 đến tháng 3 năm 2017 mà bệnh đã tiến triển khi sử dụng FOLFIRINOX bậc một. Các bệnh nhân đủ điều kiện có khối u được nhuộm ít nhất 20 MUC5AC bằng cách đánh giá hóa mô miễn dịch tập trung. Phân tích thống kê được thực hiện từ tháng 4 đến tháng 5 năm 2022.
Can thiệp: Bệnh nhân được chỉ định ngẫu nhiên để nhận gemcitabine (1000 mg/m2) và nab-paclitaxel (125 mg/m2) tiêm tĩnh mạch vào các ngày 1, 8 và 15 của mỗi chu kỳ 4 tuần, có hoặc không có NPC-1C tiêm tĩnh mạch 1,5 mg/kg mỗi 2 tuần.
Các kết quả và biện pháp chính: Tiêu chí chính là tỷ lệ sống sót chung (OS). Tiêu chí phụ là tỷ lệ sống không bệnh tiến triển (PFS), tỷ lệ đáp ứng khách quan (ORR) và độ an toàn. Các biến số lâm sàng trước điều trị đã được khám phá bằng phân tích mối nguy theo tỷ lệ Cox.
Kết quả: Tổng cộng có 78 bệnh nhân (tuổi trung bình, 62 [36-78] tuổi; 32 [41%] phụ nữ; 9 [12%] Da đen; 66 [85%] da trắng) được điều trị bậc hai bằng gemcitabine cộng với nab-paclitaxel (n = 40) hoặc gemcitabine cộng với nab-paclitaxel và NPC-1C (n = 38).
OS trung bình là 6,6 tháng (KTC 95%, 4,7-8,4 tháng) với gemcitabine cộng với nab-paclitaxel so với 5,0 tháng (KTC 95%, 3,3-6,5 tháng; P = 0,22) với gemcitabine cộng với nab-paclitaxel và NPC-1C.
PFS trung bình là 2,7 tháng (KTC 95%, 1,9-4,1 tháng) với gemcitabine cộng với nab-paclitaxel so với 3,4 tháng (KTC 95%, 1,9-5,3 tháng; P = 0,80) với gemcitabine cộng với nab-paclitaxel và NPC-1C.
ORR là 3,1% (KTC 95%, 0,4% -19,7%) ở nhóm gemcitabine cộng với nab-paclitaxel và NPC-1C và 2,9% (KTC 95%, 0,4% -18,7%) trong nhóm gemcitabine cộng với nab-paclitaxel.
Không có sự khác biệt về độc tính giữa các nhóm, ngoại trừ thiếu máu độ 3 trở lên xảy ra thường xuyên hơn ở những bệnh nhân được điều trị bằng gemcitabine cộng với nab-paclitaxel và NPC-1C so với gemcitabine cộng với nab-paclitaxel (39% [15 trên 38] so với 10% [ 4 trên 40]; P = 0,003).
Tần suất giảm liều hóa trị tương tự nhau ở cả hai nhóm (65% so với 74%; P = 0,47). Tình trạng hoạt động kém hơn, giảm albumin máu, chẩn đoán PDAC nhỏ hơn hoặc bằng 18 tháng trước khi đăng ký thử nghiệm, tỷ lệ tế bào lympho trên bạch cầu đơn nhân dưới 2,8 và CA19-9 lớn hơn 2000 IU/mL có liên quan độc lập với khả năng sống sót kém hơn.
Kết luận và mức độ liên quan: Trong thử nghiệm lâm sàng ngẫu nhiên về PDAC tiên tiến này, NPC-1C không làm tăng hiệu quả của gemcitabine/nab-paclitaxel. Những dữ liệu này cung cấp một chuẩn mực cho các thử nghiệm trong tương lai điều tra phương pháp điều trị PDAC bậc hai.
Tài liệu tham khảo
- Drugbank, Gemcitabine, truy cập ngày 26 tháng 10 năm 2023.
- Huffman, B. M., Basu Mallick, A., Horick, N. K., Wang-Gillam, A., Hosein, P. J., Morse, M. A., Beg, M. S., Murphy, J. E., Mavroukakis, S., Zaki, A., Schlechter, B. L., Sanoff, H., Manz, C., Wolpin, B. M., Arlen, P., Lacy, J., & Cleary, J. M. (2023). Effect of a MUC5AC Antibody (NPC-1C) Administered With Second-Line Gemcitabine and Nab-Paclitaxel on the Survival of Patients With Advanced Pancreatic Ductal Adenocarcinoma: A Randomized Clinical Trial. JAMA network open, 6(1), e2249720. https://doi.org/10.1001/jamanetworkopen.2022.49720
- Pubchem, Gemcitabine, truy cập ngày 26 tháng 10 năm 2023.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội
Hóa trị gây độc tế bào
110.000 đ
Xuất xứ: Ấn Độ
Hóa trị gây độc tế bào
1.450.000 đ
Xuất xứ: Việt Nam