Chưa có sản phẩm trong giỏ hàng.
Adagrasib

Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
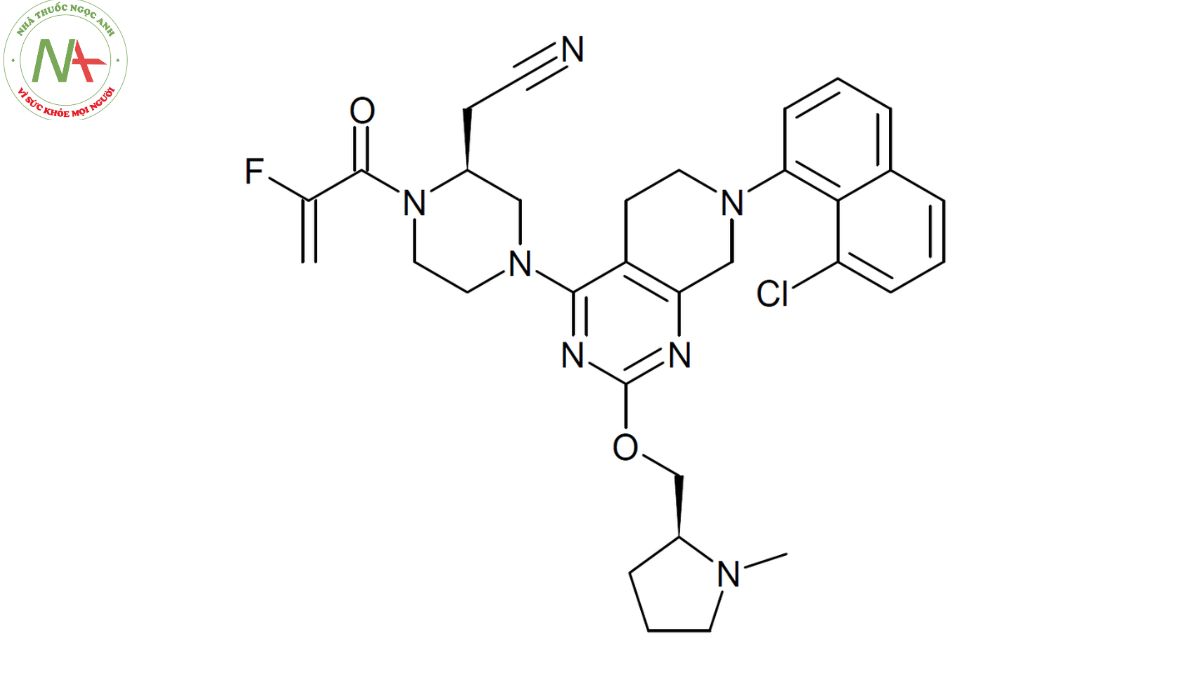
2-[(2S)-4-[7-(8-chloronaphthalen-1-yl)-2-[[(2S)-1-methylpyrrolidin-2-yl]methoxy]-6,8-dihydro-5H-pyrido[3,4-d]pyrimidin-4-yl]-1-(2-fluoroprop-2-enoyl)piperazin-2-yl]acetonitrile
Nhóm thuốc
Adagrasib là thuốc gì? Thuốc chống ung thư
Mã ATC
L – Chất chống ung thư và điều hòa miễn dịch
L01 – Thuốc chống ung thư
L01X – Thuốc chống ung thư khác
L01XX – Thuốc chống ung thư khác
L01XX77 – Adagrasib
Mã UNII
8EOO6HQF8Y
Mã CAS
2326521-71-3
Cấu trúc phân tử
Công thức phân tử
C32H35ClFN7O2
Phân tử lượng
604.1 g/mol
Cấu trúc phân tử
Cấu trúc phân tử của adagrasib có dạng một phân tử hữu cơ phức tạp với nhiều nhóm chức năng khác nhau, bao gồm nitril, amit, este, ete, clorua và fluo. Nó có cấu trúc không gian là một đồng phân quay với hai trung tâm quang học ở vị trí 2 của các nhóm piperazin và pyrrolidin.
Các tính chất phân tử
Số liên kết hydro cho: 0
Số liên kết hydro nhận: 9
Số liên kết có thể xoay: 7
Diện tích bề mặt tôpô: 88.8Ų
Số lượng nguyên tử nặng: 43
Các tính chất đặc trưng
Điểm sôi: 860.2±75.0 °C ở 760 mmHg
Tỷ trọng riêng: 1.3±0.1 g/cm3
Độ tan trong nước: 0.0115 mg/mL
Hằng số phân ly pKa: 8.46
Chu kì bán hủy: 23 giờ
Khả năng liên kết với Protein huyết tương: 98%
Dạng bào chế
Viên nén: 200 mg

Độ ổn định và điều kiện bảo quản
Để bảo quản thuốc Adagrasib, cần tuân thủ các nguyên tắc sau:
- Bảo quản thuốc ở nơi khô ráo, thoáng mát, tránh ánh nắng trực tiếp và nhiệt độ cao.
- Đóng kín hộp thuốc sau khi sử dụng và không để lâu ngoài không khí.
- Không sử dụng thuốc quá hạn sử dụng hoặc có dấu hiệu biến đổi màu sắc, hình dạng hoặc mùi.
- Không chia nhỏ, nghiền nát hoặc nhai thuốc. Uống nguyên viên với một ly nước lớn.
Nguồn gốc
Adagrasib (MRTX849), một phát minh sáng tạo của Mirati Therapeutics, đánh dấu một bước tiến đáng kể trong lĩnh vực y khoa với tính năng ức chế KRAS thông qua dạng uống.
Đột biến KRAS, chiếm đến 85% trong số các đột biến của họ RAS, là một yếu tố chính trong nhiều trường hợp ung thư. Điểm đặc biệt của Adagrasib là khả năng nhắm mục tiêu KRASG12C, một trong những đột biến phổ biến nhất, ảnh hưởng đến dư lượng cysteine tại vị trí 12 và làm giảm tác động của KRAS.
Trong một nghiên cứu lâm sàng giai đoạn I/IB, adagrasib đã chứng minh hiệu quả đáng kể trong việc kiểm soát sự phát triển của các khối u rắn tiến triển. Nghiên cứu giai đoạn II cũng tiết lộ rằng adagrasib hoạt động hiệu quả trong điều trị ung thư phổi không phải tế bào nhỏ (NSCLC) có đột biến KRASG12C, mà không cần các biện pháp an toàn bổ sung.
Vào tháng 2 năm 2022, FDA đã công nhận sự quan trọng của adagrasib bằng cách chấp nhận đơn đăng ký thuốc mới cho việc điều trị NSCLC dương tính với KRASG12C. Đến tháng 12 cùng năm, FDA tiếp tục thể hiện sự ủng hộ bằng cách cấp phép nhanh chóng cho việc sử dụng adagrasib trong điều trị NSCLC tiến triển cục bộ hoặc di căn với đột biến KRASG12C, sau khi đã thử nghiệm ít nhất một liệu pháp toàn thân khác.
Adagrasib, cùng với sotorasib – một loại chất ức chế KRASG12C khác đã được FDA phê duyệt, mở ra một kỷ nguyên mới trong việc điều trị ung thư.
Dược lý và cơ chế hoạt động
Trong hoạt động bình thường của tế bào, KRAS đóng vai trò trung tâm trong việc truyền tín hiệu sinh học, được kích hoạt bởi sự liên kết với guanosine triphosphate (GTP). Điều này khởi động chuỗi sự kiện truyền tín hiệu qua con đường MAP kinase, ảnh hưởng tới các quá trình sinh học bên trong tế bào.
Khi GTP chuyển thành guanosine diphosphate (GDP), KRAS trở lại trạng thái bất hoạt, tạo thành một hệ thống kiểm soát “bật” và “tắt” quan trọng cho sự phát triển của tế bào. Tuy nhiên, đột biến KRASG12C, với việc thay thế Gly12 bằng cysteine, làm giảm khả năng thủy phân GTP, giữ KRAS trong trạng thái hoạt động liên tục. Điều này dẫn đến sự tăng trưởng và phát triển không kiểm soát của tế bào, cũng như sự biến đổi ác tính.
Adagrasib cơ chế hoạt động như một chất ức chế cộng hóa trị cho KRASG12C. Nó khóa chặt KRASG12C trong trạng thái không hoạt động, gắn với GDP, từ đó ngăn chặn sự phát triển của tế bào khối u trong các bệnh ung thư có đột biến KRASG12C, đồng thời giảm tối thiểu tác động ngoài mục tiêu.
Mặc dù tiềm năng của adagrasib là rõ ràng, nhưng mối quan hệ giữa liều lượng và phản ứng, cũng như động học dược lý vẫn còn là một lĩnh vực cần được nghiên cứu kỹ lưỡng.
Cần lưu ý rằng việc sử dụng adagrasib có thể ảnh hưởng đến khoảng QTc trên điện tâm đồ, với sự tăng lên phụ thuộc vào nồng độ trong máu. Ví dụ, ở bệnh nhân dùng liều 600 mg hai lần mỗi ngày, sự thay đổi trung bình của QTcF so với ban đầu là 18 mili giây tại nồng độ cao nhất. Ngoài ra, adagrasib cũng có thể gây ra các tác dụng phụ nghiêm trọng liên quan đến tiêu hóa, gan và phổi.
Ứng dụng trong y học
Adagrasib được quy định như một lựa chọn điều trị tiên tiến cho bệnh nhân trưởng thành mắc ung thư phổi không phải tế bào nhỏ (NSCLC) ở giai đoạn tiến triển cục bộ hoặc di căn với đột biến KRAS G12C. Điều kiện tiên quyết cho việc sử dụng adagrasib là phát hiện đột biến này thông qua các xét nghiệm được FDA chấp thuận, và chỉ áp dụng cho những bệnh nhân đã trải qua ít nhất một phương pháp điều trị toàn thân trước đó.
Sự chấp thuận của adagrasib dựa trên một quy trình phê duyệt tăng tốc, với các chỉ số đánh giá chính là tỷ lệ phản hồi khách quan (ORR) và thời gian duy trì phản hồi (DOR). Điểm mấu chốt là, sự chấp thuận này có thể phụ thuộc vào việc xác nhận và mô tả lợi ích lâm sàng rõ ràng trong các nghiên cứu xác nhận tiếp theo. Điều này nhấn mạnh tới nhu cầu liên tục đánh giá và xác định hiệu quả của adagrasib trong điều trị NSCLC với đột biến KRAS G12C, đảm bảo rằng lợi ích lâm sàng của nó không chỉ là tạm thời mà còn có tính bền vững.
Dược động học
Hấp thu
Adagrasib hiển thị một quá trình hấp thu thuốc ấn tượng, với mức độ hấp thu (AUC) và nồng độ tối đa (Cmax) tăng tỷ lệ cùng với liều lượng, từ 400 mg lên đến 600 mg, phạm vi này bao gồm từ 0,67 đến 1 lần liều lượng được FDA chấp nhận. Ở liều khuyến cáo, thuốc đạt trạng thái ổn định sau khoảng 8 ngày, với mức độ tích lũy tăng gấp 6 lần. Thời gian đạt đến nồng độ tối đa (Tmax) của adagrasib là khoảng 6 giờ. Điều đặc biệt là việc dùng bữa ăn giàu chất béo và calo (900-1000 calo, 50% từ chất béo) không ảnh hưởng đáng kể đến dược động học của adagrasib. Thuốc này cũng được biết đến với khả năng sinh khả dụng qua đường uống cao và khả năng xâm nhập vào hệ thần kinh trung ương.
Phân bố
Adagrasib có thể tích phân bố biểu kiến lên đến 942 L. Khi xét nghiệm in vitro, thuốc này cho thấy tỷ lệ gắn kết cao với protein huyết tương người, lên đến 98%.
Chuyển hóa
Sau khi được dùng lần đầu, adagrasib chủ yếu được chuyển hóa bởi enzyme CYP3A4. Tuy nhiên, với việc dùng liên tục nhiều liều, adagrasib lại bắt đầu ức chế CYP3A4, khiến các enzyme khác như CYP2C8, CYP1A2, CYP2B6, CYP2C9 và CYP2D6 đóng góp vào quá trình chuyển hóa thuốc ở trạng thái ổn định.
Thải trừ
Adagrasib được loại bỏ qua phân và nước tiểu. Trong một nghiên cứu với bệnh nhân dùng một liều duy nhất của adagrasib được đánh dấu phóng xạ, phát hiện ra rằng 75% liều lượng được tìm thấy trong phân (trong đó 14% là dạng không thay đổi), và 4,5% trong nước tiểu (2% ở dạng không thay đổi). Thuốc này cũng có một độ thanh thải qua đường uống (CL/F) ấn tượng, đạt 37 L/giờ, và thời gian bán hủy cuối cùng khoảng 23 giờ.
Độc tính ở người
Adagrasib tác dụng phụ: Hiện tại, thông tin chi tiết về độc tính của adagrasib vẫn chưa được cung cấp đầy đủ. Tuy nhiên, đối với bệnh nhân dùng adagrasib ở liều lượng cao hơn khuyến cáo, có nguy cơ tăng đáng kể các phản ứng phụ nghiêm trọng, bao gồm nhiễm độc gan, các rối loạn tiêu hóa, và sự kéo dài của khoảng QTc trên điện tâm đồ. Trong trường hợp này, việc áp dụng các biện pháp hỗ trợ và triệu chứng là cần thiết và được khuyến nghị.
Tính an toàn
Khả năng gây ung thư của adagrasib vẫn chưa được xác định chính xác.
Trong nghiên cứu gây đột biến ngược vi khuẩn (Ames) thực hiện in vitro, adagrasib không thể hiện khả năng gây đột biến.
Các thử nghiệm khác, bao gồm thử nghiệm sai lệch nhiễm sắc thể in vitro và thử nghiệm vi nhân in vivo trên chuột, cũng chỉ ra rằng adagrasib không gây độc gen.
Đến nay, chưa có nghiên cứu nào được thực hiện để đánh giá ảnh hưởng của adagrasib đối với khả năng sinh sản. Tuy nhiên, việc cho chuột uống adagrasib với liều lượng cao trong khoảng 13 tuần đã cho thấy hiện tượng phospholipidosis ở liều trên 150 mg/kg, gấp khoảng 2 lần mức phơi nhiễm ở người dựa trên AUC. Bệnh phospholipidosis này gây ra sự tăng không bào ở nhiều cơ quan trong cơ thể.
Tương tác với thuốc khác
Việc tương tác giữa các loại thuốc khác nhau có thể ảnh hưởng đáng kể đến hiệu quả và quá trình loại bỏ adagrasib khỏi cơ thể. Một số thuốc như Levoketoconazole, các loại thuốc rifamycin (ví dụ: rifampin, rifapentine), St. John’s wort, và một số loại thuốc điều trị động kinh (như carbamazepine, phenytoin) có thể gây ảnh hưởng đến cách adagrasib hoạt động.
Ngược lại, thuốc chống ung thư adagrasib cũng có thể tác động đến quá trình loại bỏ và hoạt động của một số loại thuốc khác trong cơ thể. Các thuốc bị ảnh hưởng bởi adagrasib bao gồm avanafil; một số loại thuốc thuộc nhóm benzodiazepin như alprazolam, midazolam, triazolam; dronedarone; Finerenone; isavuconazonium; lomitapide; lurasidone; một số loại statin như lovastatin và simvastatin; và ticagrelor. Điều này yêu cầu sự chú ý đặc biệt trong quản lý liều lượng và theo dõi khi kết hợp adagrasib với các loại thuốc này, để đảm bảo an toàn và hiệu quả trong điều trị.
Lưu ý khi sử dụng Adagrasib
Quản lý liều lượng và việc sử dụng Adagrasib cần được thực hiện một cách cẩn thận, với quyết định giữ nguyên, giảm liều dùng Adagrasib, hoặc ngừng sử dụng thuốc hoàn toàn phải căn cứ vào mức độ nghiêm trọng của tình trạng sức khỏe của bệnh nhân. Điều này đòi hỏi sự theo dõi chặt chẽ và đánh giá định kỳ tình trạng gan, một bộ phận có thể chịu ảnh hưởng khi dùng Adagrasib.
Ngoài ra, việc theo dõi các dấu hiệu viêm phổi và can thiệp kịp thời nếu có bất kỳ triệu chứng nào xuất hiện là rất quan trọng. Điều này bao gồm cả việc giám sát sự thay đổi của khoảng QTc trên điện tâm đồ (ECG), để đảm bảo rằng việc điều trị diễn ra an toàn và hiệu quả.
Trước khi sử dụng Adagrasib, người dùng cần phải đọc kỹ hướng dẫn sử dụng để hiểu rõ về cách thức và các điều kiện sử dụng thuốc. Đối với phụ nữ mang thai hoặc đang cho con bú, thông tin về sự an toàn của Adagrasib vẫn chưa được xác định rõ ràng do thiếu nghiên cứu. Do đó, nếu bạn đang mang thai, dự định mang thai, hoặc đang cho con bú, hãy thảo luận với bác sĩ của bạn về việc sử dụng Adagrasib. Để đảm bảo an toàn, nên tránh việc cho con bú trong thời gian dùng Adagrasib và ít nhất một tuần sau khi ngừng sử dụng thuốc.
Một vài nghiên cứu của Adagrasib trong Y học
Adagrasib có hoặc không có Cetuximab trong ung thư đại trực tràng có KRAS G12C đột biến
Bối cảnh: Adagrasib, một chất ức chế phân tử nhỏ bằng đường uống của protein KRAS G12C đột biến, đã cho thấy tác dụng lâm sàng ở những bệnh nhân được điều trị trước với một số loại khối u, bao gồm cả ung thư đại trực tràng. Các nghiên cứu tiền lâm sàng cho thấy rằng việc kết hợp chất ức chế KRAS G12C với kháng thể thụ thể yếu tố tăng trưởng biểu bì có thể là một chiến lược lâm sàng hiệu quả.
Phương pháp: Trong thử nghiệm lâm sàng không ngẫu nhiên, nhãn mở, giai đoạn 1-2 này, chúng tôi đã chỉ định những bệnh nhân bị ung thư đại trực tràng di căn đã được điều trị trước bằng KRAS G12C đột biến nhận đơn trị liệu bằng adagrasib (600 mg uống hai lần mỗi ngày) hoặc adagrasib (với cùng liều lượng) kết hợp với cetuximab tiêm tĩnh mạch mỗi tuần một lần (với liều tải ban đầu là 400 mg mỗi mét vuông diện tích bề mặt cơ thể, sau đó là liều 250 mg mỗi mét vuông) hoặc cứ sau 2 tuần (với liều 500 mg mỗi mét vuông). Điểm cuối chính là phản ứng khách quan (phản hồi hoàn toàn hoặc một phần) và an toàn.
Kết quả: Tính đến ngày 16 tháng 6 năm 2022, tổng cộng 44 bệnh nhân đã nhận được adagrasib và 32 bệnh nhân đã nhận được liệu pháp kết hợp với adagrasib và cetuximab, với thời gian theo dõi trung bình lần lượt là 20,1 tháng và 17,5 tháng.
Trong nhóm đơn trị liệu (43 bệnh nhân được đánh giá), phản ứng được báo cáo ở 19% bệnh nhân (khoảng tin cậy 95% [CI], 8 đến 33). Thời gian đáp ứng trung bình là 4,3 tháng (KTC 95%, 2,3 đến 8,3) và thời gian sống sót không tiến triển trung bình là 5,6 tháng (KTC 95%, 4,1 đến 8,3).
Trong nhóm điều trị kết hợp (28 bệnh nhân được đánh giá), đáp ứng là 46% (KTC 95%, 28 đến 66). Thời gian đáp ứng trung bình là 7,6 tháng (KTC 95%, 5,7 đến không thể ước tính được) và thời gian sống sót không tiến triển trung bình là 6,9 tháng (KTC 95%, 5,4 đến 8,1).
Tỷ lệ tác dụng phụ liên quan đến điều trị độ 3 hoặc 4 là 34% ở nhóm đơn trị liệu và 16% ở nhóm trị liệu phối hợp. Không có sự kiện bất lợi cấp 5 đã được quan sát.
Kết luận: Adagrasib có hoạt tính chống ung thư ở những bệnh nhân ung thư đại trực tràng di căn đã được điều trị trước nhiều với KRAS G12C đột biến, cả dưới dạng đơn trị liệu bằng đường uống và kết hợp với cetuximab. Thời gian đáp ứng trung bình là hơn 6 tháng ở nhóm điều trị phối hợp. Các tác dụng phụ có thể đảo ngược được phổ biến ở cả hai nhóm.
Tài liệu tham khảo
- Drugbank, Adagrasib, truy cập ngày 15 tháng 11 năm 2023.
- Pubchem, Adagrasib, truy cập ngày 15 tháng 11 năm 2023.
- Yaeger R, Weiss J, Pelster MS, Spira AI, Barve M, Ou SI, Leal TA, Bekaii-Saab TS, Paweletz CP, Heavey GA, Christensen JG, Velastegui K, Kheoh T, Der-Torossian H, Klempner SJ. Adagrasib with or without Cetuximab in Colorectal Cancer with Mutated KRAS G12C. N Engl J Med. 2023 Jan 5;388(1):44-54. doi: 10.1056/NEJMoa2212419. Epub 2022 Dec 21. PMID: 36546659; PMCID: PMC9908297.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội.
Liệu pháp nhắm trúng đích
0 đ
Xuất xứ: Mỹ


