Bệnh hô hấp
Thao tác huy động và PEEP cao hơn, còn gọi là Khái niệm phổi mở, ở bệnh nhân mắc ARDS
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Thao tác huy động và PEEP cao hơn, còn gọi là Khái niệm phổi mở, ở bệnh nhân mắc ARDS – tải file PDF Tại đây.
Bản dịch của BS. Đặng Thanh Tuấn – BV Nhi Đồng 1.
Giới thiệu
Hội chứng nguy kịch hô hấp cấp tính (acute respiratory distress syndrome, ARDS) là hội chứng thiếu oxy được điều trị chủ yếu bằng thở máy hỗ trợ. Mặc dù thông khí cơ học có thể cứu sống nhưng nó có thể gây tổn thương phổi do máy thở (ventilator-induced lung injury, VILI). Do đó, mục tiêu của thở máy là đạt được sự trao đổi khí đầy đủ đồng thời giảm thiểu tổn thương phổi. Nhiều chiến lược thông khí cơ học đã được phát triển để hạn chế VILI. Các chiến lược này dựa trên khái niệm sinh lý bệnh học rằng tình trạng căng quá mức của phế nang (alveolar overdistention), ứng suất cắt (shear- stress) và chấn thương xẹp phổi (atelectrauma) (tức là sự đóng mở theo chu kỳ của phế nang không ổn định) là những cơ chế có thể dẫn đến VILI. Các mục tiêu có thể làm nặng thêm hoặc làm giảm VILI, đặc biệt là thể tích khí lưu thông và áp lực dương cuối thì thở ra (PEEP), đã trở thành chủ đề của nghiên cứu sâu rộng.
Thử nghiệm Mạng ARDS (ARDSNet) nhằm mục đích giảm tình trạng căng phổi quá mức, nếu cần thiết với chi phí trao đổi khí dưới mức tối ưu [1]. Thử nghiệm này đã chứng minh rằng chiến lược thông khí với thể tích khí lưu thông thấp và áp lực cao nguyên hạn chế (Pplat <30 cmH2O) làm giảm tỷ lệ tử vong. Lachmann đề xuất giảm xẹp phổi và ứng suất cắt bằng cách sử dụng các thủ thuật huy động và sau đó sử dụng PEEP cao hơn: “khái niệm phổi mở” (“open lung concept”) [2].
Khái niệm phổi mở, kết hợp với thể tích khí lưu thông thấp có vẻ hấp dẫn từ góc độ sinh lý bệnh và rất hứa hẹn trong các mô hình ARDS thử nghiệm [3, 4]. Tuy nhiên, bằng chứng lâm sàng không nhất quán. Một phân tích tổng hợp so sánh PEEP cao hơn (13-15 cmH2O) và chiến lược thông khí PEEP thấp đã báo cáo giảm tỷ lệ tử vong, nhưng chỉ trong phân tích phân nhóm bệnh nhân mắc ARDS từ trung bình đến nặng [5]. Một phân tích tổng hợp khác đã báo cáo tỷ lệ tử vong giảm ở những bệnh nhân mắc ARDS được điều trị theo khái niệm phổi mở [6]. Amato và các đồng nghiệp đã chứng minh trong một phân tích hòa giải đa cấp rằng việc tăng PEEP làm giảm tỷ lệ tử vong ở bệnh nhân mắc ARDS, nhưng chỉ khi điều này dẫn đến giảm áp lực đẩy (driving pressure) [7].
Việc huy động phế nang trong thử nghiệm ARDS (Alveolar Recruitment for ARDS Trial, ART) gần đây đã làm mới những tranh cãi về hiệu quả của các thủ thuật huy động và áp dụng mức PEEP cao hơn [8]. Thử nghiệm này báo cáo rằng thủ thuật huy động kết hợp với PEEP cao hơn đã làm tăng tỷ lệ tử vong ở những bệnh nhân mắc ARDS từ trung bình đến nặng. Người ta đề xuất rằng tình trạng căng quá mức gây ra bởi các thao tác huy động và PEEP cao hơn có thể có hại hơn so với ứng suất cắt và xẹp phổi mà nó ngăn ngừa [9]. Điều này đặt ra câu hỏi sau: chúng ta có nên từ bỏ khái niệm phổi mở ở bệnh nhân mắc ARDS không?
Trong chương này, chúng tôi sẽ thảo luận ngắn gọn về sinh lý bệnh của ARDS và VILI, những hạn chế và chỉ định của khái niệm phổi mở, theo dõi tại giường để hướng dẫn khái niệm phổi mở và thông khí giải phóng áp lực đường thở (APRV) như một giải pháp thay thế.
=> Đọc thêm: Suy hô hấp cấp tính và thở máy ở bệnh nhân mang thai: Tổng quan tài liệu.
Sinh lý bệnh của ARDS và VILI
Sinh lý bệnh của ARDS dựa trên bộ ba tổn thương màng phế nang-mao mạch, phù nề và viêm có tính thấm cao (phế nang) [10]. Về mặt mô học, điều này được đặc trưng bởi tổn thương phế nang lan tỏa [11]. Mô hình “phổi trẻ em” (“baby lung”) mô tả các tác động sinh lý bệnh của ARDS, chủ yếu là phù nề, đối với cơ học của phổi [12]. Dựa trên các quan sát, tình trạng xẹp phổi và phù nề được ưu tiên phân bổ đến các vùng phổi phụ thuộc, trong khi các vùng phổi không phụ thuộc được thông khí tương đối tốt. Mức độ xẹp và hình thành phù nề tương quan với mức độ nghiêm trọng của ARDS. Mặc dù độ đàn hồi nội tại của vùng phổi không phụ thuộc gần như bình thường, chức năng phổi bị hạn chế do vùng phổi phụ thuộc bị xẹp. Vì phổi ARDS nhỏ và không cứng nên thuật ngữ “phổi trẻ em” đã được đề xuất [12].
Bộ ba sinh lý bệnh không thể được đo lường thường xuyên trong thực hành lâm sàng. Do đó, tình trạng thiếu oxy máu động mạch và hình ảnh mờ hai bên trên hình ảnh ngực được sử dụng làm đại diện lâm sàng trong định nghĩa ARDS của Berlin [13]. Bởi vì định nghĩa Berlin không dựa trên các tiêu chí sinh lý bệnh nên nó đặt ra một số hạn chế trong nghiên cứu lâm sàng. Chỉ một nửa số bệnh nhân được chẩn đoán lâm sàng mắc ARDS có tổn thương phế nang lan tỏa khi khám nghiệm tử thi [14]. Ngoài ra, các tổn thương ở phổi và ngoài phổi có thể gây ra ARDS, cả hai đều có đáp ứng khác nhau với PEEP [15]. Kết quả là ARDS là một hội chứng không đồng nhất.
Định nghĩa của Berlin về ARDS chỉ định mức độ nghiêm trọng của bệnh theo tỷ lệ PaO2/FiO2 ở mức PEEP ít nhất là 5 cmH2Ơ. Phân loại này rất quan trọng vì khả năng huy động phụ thuộc vào mức độ nghiêm trọng của bệnh. Tuy nhiên, PEEP có ảnh hưởng lớn đến tỷ lệ PaO2/FiO2 và việc áp dụng PEEP cao có thể che giấu mức độ nghiêm trọng của ARDS. Caironi và đồng nghiệp [16] đã báo cáo rằng 54% bệnh nhân mắc ARDS nhẹ ở PEEP lâm sàng (tức là > 5 cmH2O) được phân loại lại thành ARDS trung bình hoặc nặng ở PEEP 5 cmH2O. Ngoài ra, mối tương quan giữa mức độ nghiêm trọng của ARDS và khả năng huy động phổi được cải thiện đáng kể ở mức 5 cmH2O [16]. Do đó, nên sử dụng mức PEEP cố định để đánh giá mức độ nghiêm trọng của bệnh và khả năng huy động.
Thông khí cơ học gây tổn thương trong các mô hình thí nghiệm dẫn đến tổn thương phế nang lan tỏa, bao gồm phù mô kẽ và phế nang, hình thành màng trong và thâm nhiễm tế bào [17]. Do đó, VILI không thể phân biệt được với ARDS và có khả năng là nguyên nhân quan trọng nhất làm kéo dài hoặc làm trầm trọng thêm ARDS. Vì ARDS được đặc trưng bởi phổi trẻ em, nên sự căng quá mức của phế nang của phổi không phụ thuộc được coi là nguyên nhân chính gây ra VILI. Ban đầu, người ta không rõ liệu thể tích khí lưu thông cao, áp lực đường thở cao hay cả hai đều dẫn đến VILI. Dreyfuss và các đồng nghiệp đã phân biệt thể tích khí lưu thông với áp lực đường thở trong mô hình chuột [18]. Sự hình thành phù phổi được đánh giá sau 20 phút thở máy theo các quy trình sau: (1) áp lực cao (45 cmH2O) và thể tích khí lưu thông cao (40 mL/kg); (2) áp lực cao (45 cmH2Ơ) và thể tích khí lưu thông thấp hơn (19 mL/kg)—thể tích khí lưu thông thấp hơn đạt được bằng dây đai vùng ngực để tránh căng thành ngực; và (3) áp lực hít vào âm (phổi sắt) và thể tích khí lưu thông cao (44 mL/kg). Họ quan sát thấy phù nề tăng đáng kể ở nhóm 1 và 3 so với nhóm 2, cho thấy thể tích lớn và áp lực không cao gây ra tổn thương phổi. Ngoài ra, ở nhóm thứ tư, họ báo cáo rằng 10 cmH2O PEEP làm giảm sự hình thành phù nề.
Protti và các đồng nghiệp đã chứng minh tác dụng có lợi của PEEP kết hợp với việc giảm thể tích khí lưu thông [3]. Trong mô hình lợn, họ chia thể tích phổi cuối thì hít vào (tức là strain) thành thành phần được tạo ra bởi PEEP (strain tĩnh = thể tích PEEP/dung tích cặn chức năng) và thành phần được tạo ra bởi thể tích khí lưu thông (strain động = thể tích khí lưu thông/ dung tích cặn chức năng). Bốn nhóm được thở máy với strain tổng là 2,5 (gần bằng tổng dung tích phổi): (1) Vpeep 0% và thể tích khí lưu thông 100%; (2) Vpeep 25% và thể tích khí lưu thông 75%; (3) Vpeep 50% và thể tích khí lưu thông 50%; và (4) Vpeep 75% và thể tích khí lưu thông 25%. Sau 54 giờ, tất cả lợn trong nhóm thể tích khí lưu thông 100% đều chết do phù phổi nặng, trong khi không có con lợn nào trong nhóm Vpeep 75% và thể tích khí lưu thông 25% chết hoặc bị phù phổi. Khi kết thúc thí nghiệm, việc loại bỏ PEEP đột ngột ở nhóm cuối cùng không dẫn đến hình thành phù phổi, cho thấy tính toàn vẹn của hàng rào mao mạch phế nang được bảo tồn và PEEP không chỉ chống lại sự thoát mạch của huyết tương. PEEP có tác dụng bảo vệ, nhưng nên giảm thể tích khí lưu thông khi áp dụng mức PEEP cao.
Việc sử dụng mức PEEP cao hơn đi kèm với sự gia tăng Pplat > 30 cmH2Ơ. Do thử nghiệm ARDSNet báo cáo rằng sự kết hợp giữa thể tích khí lưu thông thấp và Pplat < 30 cmH2Ơ làm giảm tỷ lệ tử vong nên các bác sĩ thận trọng với việc sử dụng áp lực đường thở cao. Tuy nhiên, Pplat tác động lên toàn bộ hệ hô hấp, bao gồm cả phổi và thành ngực. Độ đàn hồi của thành ngực rất khác nhau ở bệnh nhân mắc ARDS và đóng góp từ 20 đến 50% vào tổng độ đàn hồi của hệ hô hấp (Ers) [19]. Một Pplat 30 cmH2Ơ tác động lên thành ngực cứng (50% Ers) dẫn đến áp lực xuyên phổi là 15 cmH2Ơ, trong khi một Pplat tương tự tác động lên thành ngực bình thường (20% Ers) dẫn đến áp lực xuyên phổi là 24 cmH2O. Do đó, Pplat cung cấp rất ít thông tin về áp lực xuyên phổi (transpulmonary pressure), tức là lực căng lên phổi.
Tóm lại, có đủ bằng chứng thực nghiệm cho thấy thể tích khí lưu thông cao và áp lực đường thở không cao là quan trọng trong sự phát triển VILI. Ngoài ra, mức PEEP cao hơn sẽ có lợi nếu thể tích khí lưu thông giảm để hạn chế strain tổng (sự căng quá mức). Do đó, nên áp dụng sự kết hợp giữa PEEP cao hơn và thể tích khí lưu thông thấp để giảm sự phát triển của VILI.
Khái niệm phổi mở
Năm 1970, Mead và các đồng nghiệp đã phát triển một mô hình toán học để ước tính áp lực trong phổi ở phổi được thông khí không đồng nhất [20]. Họ tuyên bố rằng tại các mặt phân giới của phổi mở và xẹp, áp lực xuyên phổi 30 cmH2O có thể dẫn đến áp lực cục bộ là 140 cmH2O. Dựa trên những ước tính này, Lachmann đưa ra giả thuyết rằng ứng suất cắt có thể là nguyên nhân chính gây hư hỏng cấu trúc và VILI [2]. Để giảm thiểu ứng suất cắt và xẹp phổi trong phổi được thông khí không đồng nhất, ông đề xuất “mở phổi và giữ cho phổi luôn mở”.
Theo truyền thống, khái niệm phổi mở bao gồm thủ thuật huy động để mở phổi bị xẹp và PEEP cao để duy trì sự ổn định của phế nang. Theo định luật LaPlace (P = 2y/r, trong đó P là áp lực trong phế nang, Y là sức căng bề mặt của thành phế nang và r là bán kính của phế nang), cần nhiều áp lực hơn để mở một phế nang bị xẹp hoặc phế nang không bơm phồng so với phế nang mở. Suy giảm chất hoạt động bề mặt trong ARDS nghiêm trọng làm tăng thêm áp lực mở do sức căng bề mặt tăng lên. Ngoài ra, áp lực mở của phế nang bị xẹp phải thắng được lực co rút phế nang và lực nén lên phế nang bởi mô phổi xung quanh. Tổng các áp lực này được ước tính là 45-60 cmH2O ở bệnh nhân mắc ARDS [9].
Một ví dụ điển hình về việc mở phổi phụ thuộc, mặc dù không sử dụng áp lực đường thở cao, là áp dụng tư thế nằm sấp. Ở tư thế nằm ngửa, sức nặng của bụng phổi, tim và các tạng trong ổ bụng làm tăng áp lực màng phổi ở vùng lưng phổi. Việc giảm áp lực xuyên phổi (áp lực đường thở trừ áp lực màng phổi) dẫn đến giảm lực căng lên phổi phụ thuộc. Ngoài ra, phù phổi trong ARDS làm tăng dần khối lượng phổi. Cuối cùng, phổi phụ thuộc sẽ xẹp xuống dưới sức nặng của chính nó và thông khí được phân bổ lại cho phổi của em bé. Việc áp dụng tư thế nằm sấp làm thay đổi lực hấp dẫn; phổi lưng trở thành vùng phổi không phụ thuộc và được thông khí trở lại. Do sự phù hợp về hình dạng (xu hướng giải phẫu làm căng quá mức các vùng bụng của phổi bất chấp lực hấp dẫn) và khối lượng phổi lớn hơn ở phía sau, nên thông khí ở tư thế nằm sấp được phân bổ đồng nhất hơn [21]. Sự tưới máu cũng được phân bố đồng đều hơn ở tư thế nằm sấp. Kết quả là sự kết hợp thông khí-tưới máu và oxygen hóa được cải thiện [22]. Các thử nghiệm ngẫu nhiên có đối chứng quy mô lớn ban đầu đã không xác nhận những lợi ích về mặt lý thuyết của tư thế nằm sấp. Tuy nhiên, một phân tích tổng hợp cho thấy giảm tỷ lệ tử vong ở những bệnh nhân mắc ARDS nặng [23]. Tác dụng có lợi của tư thế nằm sấp đã được xác nhận bởi thử nghiệm PROSEVA [24]. Bệnh nhân mắc ARDS nặng (tỷ lệ PaO2/FiO2 <150 mmHg) được chỉ định vào nhóm nằm sấp có tỷ lệ tử vong trong 28 ngày (16,0%) thấp hơn đáng kể so với nhóm nằm ngửa (32,8%). Do đó, nên mở phổi bằng tư thế nằm sấp trong ARDS nặng.
Khái niệm phổi mở trong ARDS nhẹ đến trung bình
Hướng dẫn Thực hành Lâm sàng của Hiệp hội Lồng ngực Hoa Kỳ về thở máy ở bệnh nhân trưởng thành mắc ARDS khuyến nghị giới hạn Pplat ở mức 30 cmH2O, phù hợp với thử nghiệm ARDSNet [25]. Điều này đặt ra câu hỏi sau: liệu phổi có thể mở hoàn toàn ở Pplat <30 cmH2O không? Cressoni và các đồng nghiệp đã điều tra xem liệu thở máy với Pplat 30 cmH2O có thực sự huy động được phổi hay không [26]. Họ bao gồm 33 bệnh nhân mắc ARDS từ nhẹ đến nặng. Bốn lần chụp cắt lớp vi tính (CT) đã được thực hiện: một lần ở PEEP 5 cmH2O và ba lần ở Pplat là 19 ± 0, 28 ± 0 và 40 ± 2 cmH2O trong thời gian nín thở < 5 giây. Việc huy động phổi được định nghĩa là lượng mô phổi (gram) được bơm phồng trở lại do áp lực đường thở được áp dụng (Hình 1). Họ phát hiện ra rằng lượng huy động phổi đạt được khi Pplat tăng từ 30 lên 45 cmH2O là không đáng kể ở những bệnh nhân mắc ARDS nhẹ đến trung bình. Ngược lại, sự gia tăng Pplat tương tự ở những bệnh nhân mắc ARDS nặng dẫn đến việc huy động phổi một lượng đáng kể. Những kết quả này xác nhận rằng số lượng mô có thể huy động được tăng theo mức độ nghiêm trọng của ARDS.
![Thao tác huy động và PEEP cao hơn, còn gọi là Khái niệm phổi mở, ở bệnh nhân mắc ARDS 8 Hình 1 Huy động phổi như một hàm của áp lực đường thở. Con số này biểu thị lượng mô phổi (gram) được huy động như là một hàm của áp lực đường thở được áp dụng. Các ước tính được dựa trên hình ảnh chụp cắt lớp vi tính (CT) của bệnh nhân mắc Hội chứng nguy kịch hô hấp cấp tính (ARDS). Màu xanh lá cây: ARDS nhẹ, màu xanh lam: ARDS trung bình, màu đỏ: ARDS nặng, màu đỏ sẫm: ARDS nặng với quá trình oxygen hóa màng ngoài cơ thể tĩnh mạch-tĩnh mạch (VV- ECMO). Từ [26] với sự cho phép](https://nhathuocngocanh.com/wp-content/uploads/2023/11/Thao-tac-huy-dong-va-PEEP-cao-hon-con-goi-la-Khai-niem-phoi-mo-o-benh-nhan-mac-ARDS-1.jpg)
Ngoài ra, một thử nghiệm so sánh thông khí dao động tần số cao (HFOV) với giao thức ARDSNet ở bệnh nhân ARDS từ trung bình đến nặng đã bị chấm dứt sớm, do xu hướng tăng tỷ lệ tử vong đã được quan sát thấy ở nhóm HFOV [27]. Trong thử nghiệm này, HFOV được áp dụng theo chiến lược khái niệm phổi mở: đầu tiên, thao tác huy động được thực hiện bằng cách tăng áp lực căng lên 40 cmH2O. Sau đó, áp lực đường thở trung bình được đặt ở mức 30 cmH2O và giảm dựa trên mục tiêu oxygen hóa kết hợp với thể tích khí lưu thông rất thấp (1-2 mL/kg) và tần số hô hấp cao. Tuy nhiên, giống như trong thử nghiệm ART, phân tích dưới nhóm đã chứng minh rằng tỷ lệ tử vong không tăng nếu áp dụng HFOV ở những bệnh nhân mắc ARDS nặng. Một phân tích tổng hợp dữ liệu bệnh nhân riêng lẻ của bốn thử nghiệm HFOV (1552 bệnh nhân mắc ARDS) cho thấy HFOV thậm chí có thể làm giảm tỷ lệ tử vong ở những bệnh nhân mắc ARDS nặng, trong khi tỷ lệ tử vong tăng lên ở những bệnh nhân mắc ARDS nhẹ [28]. Điều này cho thấy rằng chiến lược áp lực đường thở trung bình cao hơn dẫn đến tỷ lệ tử vong tăng lên ở những bệnh nhân mắc ARDS trung bình do PEEP hoặc áp lực căng, trong khi ở những bệnh nhân mắc ARDS nặng, áp lực đường thở trung bình cao hơn có thể có lợi.
Khái niệm phổi mở trong ARDS nặng
Ở những bệnh nhân bị thiếu oxy nặng kháng trị theo phác đồ ARDSNet, có ba chiến lược điều trị khả thi: (1) duy trì phác đồ ARDSNet và chấp nhận tình trạng thiếu oxy; (2) chuyển sang oxygen hóa qua màng ngoài cơ thể tĩnh mạch-tĩnh mạch (VV- ECMO); hoặc (3) bắt đầu thở máy theo khái niệm phổi mở, do đó chấp nhận áp lực đường thở > 30 cmH2O (Hình 2). Thử nghiệm EOLIA đã so sánh việc áp dụng sớm VV-ECMO với giao thức ARDSNet ở những bệnh nhân mắc ARDS rất nặng [29]. Các tác giả báo cáo rằng VV-ECMO không làm giảm tỷ lệ tử vong trong 60 ngày. Ngoài ra, VV-ECMO có liên quan đến tỷ lệ biến chứng cao (lên tới 40%), bao gồm xuất huyết nội sọ dẫn đến tử vong [30].
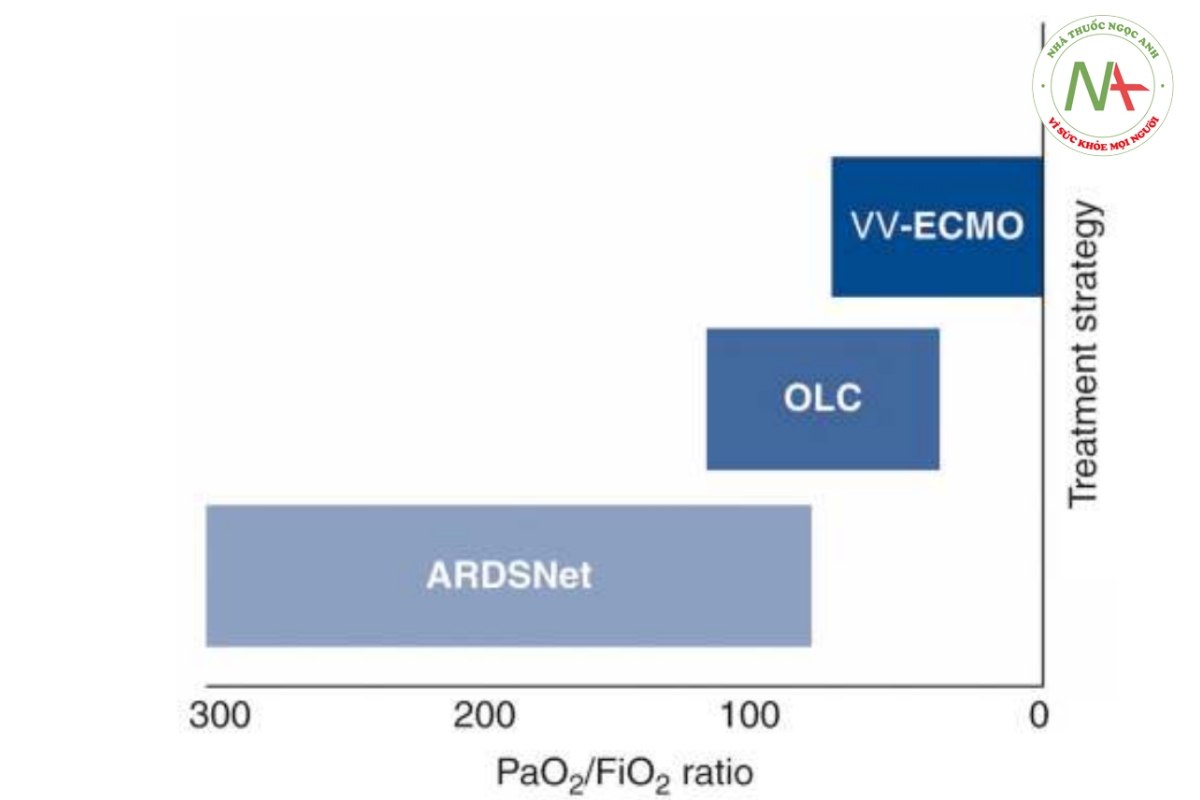
Trong một phân tích hồi cứu các bệnh nhân được điều trị theo khái niệm phổi mở đáp ứng tiêu chí đưa vào EOLIA, chúng tôi quan sát thấy tỷ lệ tử vong trong 30 ngày là 25% so với 35-46% trong thử nghiệm EOLIA [29]. Điều này ủng hộ giả thuyết của chúng tôi rằng có dấu hiệu cho khái niệm phổi mở ở những bệnh nhân mắc ARDS nặng. Tuy nhiên, điều cần thiết là các hoạt động huy động và Pplat cao phải được hướng dẫn bởi sự giám sát chặt chẽ.
Áp lực hít vào bị giới hạn bởi áp lực xuyên phổi thay vì Pplat. Áp lực xuyên phổi được ước tính bằng ống thông bóng thực quản. Áp lực xuyên phổi hít vào < 25 cmH2O được coi là thông khí bảo vệ phổi bất kể Pplat [19]. Grasso và các đồng nghiệp đã đo áp lực xuyên phổi ở 14 bệnh nhân mắc ARDS nặng được chuyển đến ICU vì VV-ECMO [19]. Ở một nửa số bệnh nhân, áp lực xuyên phổi > 25 cmH2O và ở những bệnh nhân này, VV-ECMO đã được bắt đầu. Ở những bệnh nhân khác, áp lực xuyên phổi < 25 cmH2O và do đó PEEP tăng từ 17 lên 22 cmH2O cho đến khi áp lực xuyên phổi bằng 25 cmH2O. Các tác giả chấp nhận áp lực đường thở lên tới 38 cmH2O. Ở những bệnh nhân này bệnh nhân, quá trình oxygen hóa được cải thiện và họ không cần VV-ECMO.
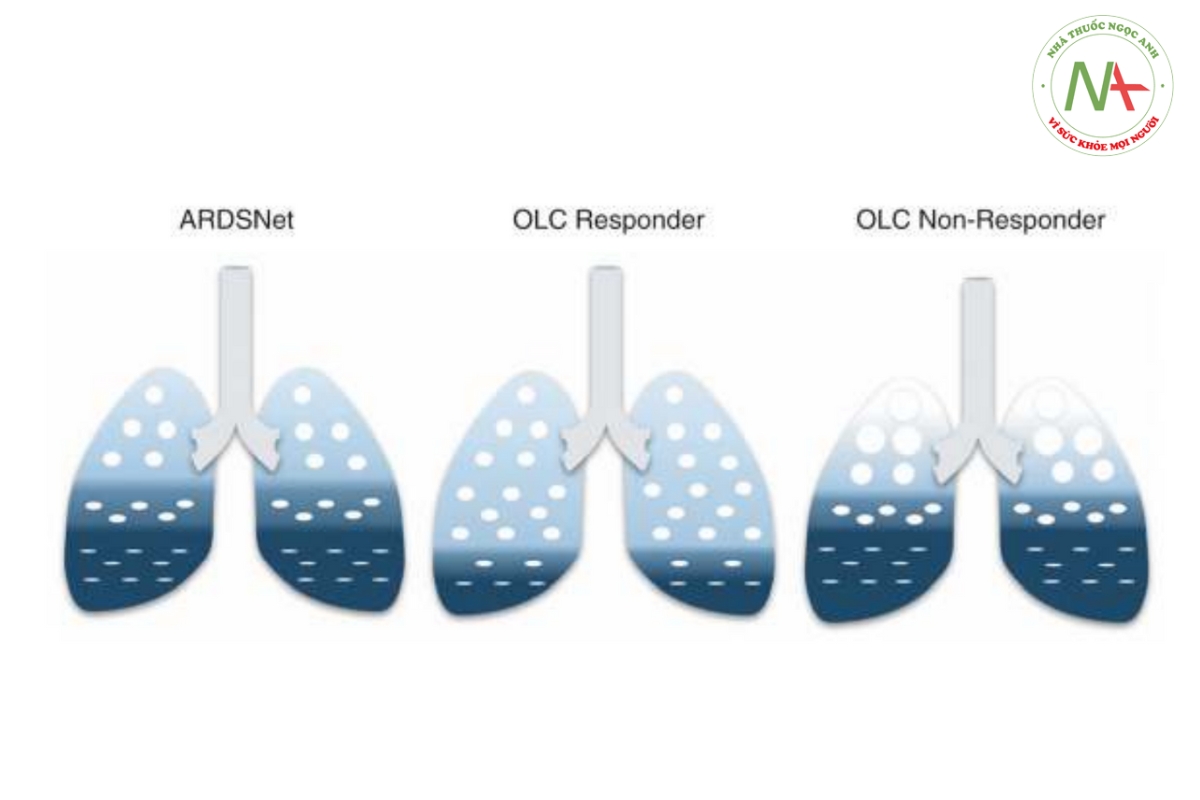
Để ngăn chặn tình trạng căng quá mức, điều quan trọng là phải phân biệt những người đáp ứng với thủ thuật huy động với những người không đáp ứng. Những người đáp ứng có thể được xác định bằng sự gia tăng oxygen hóa, độ giãn nở và/hoặc giảm đáng kể áp lực đẩy. Việc giảm áp lực đẩy là kết quả trực tiếp của việc mở phổi, do đó làm tăng dung tích cặn chức năng. Theo kinh nghiệm của chúng tôi, áp lực đẩy sẽ giảm nhanh chóng sau khi huy động ở những người đáp ứng. Hiện chưa rõ mức độ mà áp lực đẩy phải giảm để có thể gọi là đáp ứng. Phân tích hòa giải đa cấp của Amato và các đồng nghiệp cho thấy rằng áp lực đẩy 15 cmH2O làm giảm tỷ lệ tử vong ở bệnh nhân mắc ARDS [7]. Tuy nhiên, trong thử nghiệm ART, áp lực đẩy đã giảm từ 13,5 xuống 11,5 cmH2O sau thủ thuật huy động và vẫn dẫn đến tỷ lệ tử vong tăng lên. Mặc dù ban đầu áp lực đẩy giảm nhưng sau đó lại tăng lên, trong khi áp lực đẩy ở nhóm đối chứng vẫn ổn định. Điều này cho thấy rằng việc duy trì áp lực đẩy ổn định ở mức thấp có thể quan trọng hơn giá trị tuyệt đối của áp lực đẩy. Ở những người không đáp ứng, dung tích cặn chức năng không tăng sau thủ thuật huy động. Do đó, không nên tăng PEEP vì điều này dẫn đến tình trạng phổi trẻ em bị căng quá mức (Hình 3).
Huy động chậm với thông khí giải phóng áp lực đường thở
Thời gian là một biến số quan trọng trong cả việc huy động và ổn định phế nang, nhưng thường bị bỏ qua. Việc áp dụng 30 cmH2O vào phổi được bơm căng ở mức 5 cmH2O trong 2 giây sẽ mở ra khoảng 75% phế nang [31]. Tiếp tục bơm phồng 3 0 cmH2O trong 40 giây làm tăng dần tỷ lệ phế nang mở lên 85%. Trong giai đoạn thở ra, có độ trễ khoảng 0,17 giây trước khi xẹp phế nang bắt đầu và ở 0,25 giây, phế nang xẹp xuống [32]. Thời gian hít vào trong giao thức ARDSNet quá ngắn để huy động phần lớn phế nang và quá dài để ngăn phế nang xẹp.
APRV có thể giải quyết cả hai vấn đề. APRV bao gồm áp lực đường thở dương liên tục (Phigh) với giai đoạn giải phóng ngắt quãng ngắn (Plow) để thở ra và loại bỏ CO2. Bệnh nhân được phép thở tự nhiên không phụ thuộc với chu kỳ máy thở. Phigh từ từ huy động phổi và Plow ngắn ngăn cản sự xẹp phế nang. Cuối cùng, phổi mở và ổn định. Tuy nhiên, trong các mô hình thử nghiệm, tính không đồng nhất sẽ tăng lên nếu P ở mức thấp quá lâu, khiến phế nang có đủ thời gian để xẹp xuống [33]. Chu và các đồng nghiệp đã so sánh APRV 50% với giao thức ARDSNet ở bệnh nhân ARDS từ trung bình đến nặng [34]. Họ báo cáo xu hướng giảm tỷ lệ tử vong tại ICU ở nhóm APRV: 19,7% so với 34,3%. Số ngày không sử dụng máy thở, khả năng cung cấp oxy và độ giãn nở của hệ hô hấp nghiêng về nhóm APRV. Trong nghiên cứu này, các nhà điều tra nhắm đến thông khí phút tự phát ít nhất 30% tổng thông khí phút. Sự co thắt của cơ hoành trong quá trình thở tự nhiên rõ rệt hơn ở vùng lưng phổi và hỗ trợ mở ra ngay cả những vùng phổi phụ thuộc nhất. Tóm lại, APRV dẫn đến phổi mở bằng cách huy động chậm, ổn định phế nang và co thắt cơ hoành.
=> Đọc thêm: Thủ thuật huy động trong hội chứng nguy kịch hô hấp cấp: Cách an toàn là cách tốt nhất.
Kết luận
Mục tiêu của khái niệm phổi mở là đạt được một phổi thông thoáng và đồng nhất. Từ góc độ sinh lý bệnh, khái niệm phổi mở có vẻ có lợi vì ứng suất cắt và chấn thương do xẹp phổi giảm. Có thể đạt được phổi thông thoáng và đồng nhất hơn bằng cách áp dụng tư thế nằm sấp hoặc áp lực đường thở cao. Ở những bệnh nhân mắc ARDS nặng, tư thế nằm sấp đã được chứng minh là làm giảm tỷ lệ tử vong.
Nhiều nghiên cứu sử dụng thủ thuật huy động với áp lực đường thở lên tới 50-60 cmH2O cho thấy quá trình oxygen hóa được cải thiện và không làm giảm tỷ lệ tử vong. Thử nghiệm ART cho thấy tỷ lệ tử vong tăng lên khi thủ thuật huy động được kết hợp với việc chuẩn độ PEEP giảm dần dựa trên độ giãn nở tốt nhất ở những bệnh nhân mắc ARDS từ trung bình đến nặng [8]. Việc áp dụng HFOV và áp lực đường thở trung bình cao ở bệnh nhân mắc ARDS cũng làm tăng tỷ lệ tử vong. Tuy nhiên, phân tích dưới nhóm của cả hai thử nghiệm cho thấy tỷ lệ tử vong tăng ở những bệnh nhân mắc ARDS trung bình, nhưng tương tự hoặc thậm chí giảm ở những bệnh nhân mắc ARDS nặng. Rõ ràng, việc áp dụng PEEP hoặc áp lực căng cao hơn làm tăng tỷ lệ tử vong ở những bệnh nhân mắc ARDS trung bình do căng quá mức, mặc dù đã chuẩn độ PEEP tốt nhất. Quan sát này chỉ ra rằng không nên sử dụng áp lực đường thở cao ở những bệnh nhân mắc ARDS trung bình.
Chúng tôi đề xuất rằng nên áp dụng khái niệm phổi mở ở những bệnh nhân mắc ARDS nặng bị thiếu oxy kháng trị theo phác đồ ARDSNet, nhưng chỉ khi bệnh nhân là người đáp ứng với huy động. Ở những bệnh nhân không đáp ứng với huy động, nên giảm PEEP và có thể xem xét VV- ECMO. Vì cả khái niệm phổi mở và VV-ECMO đều yêu cầu chuyên môn lâm sàng, chúng tôi khuyên bạn nên áp dụng chiến lược này ở các trung tâm chuyển viện cấp ba. Định nghĩa chính xác về người đáp ứng vẫn chưa được làm rõ. Sau thủ thuật huy động, áp lực đẩy, oxygen hóa và độ giãn nở sẽ được cải thiện, nhưng vẫn chưa rõ ở mức độ nào.