Kỹ thuật y khoa
Sáu bước logic kết nối phương trình Nernst và ứng dụng lâm sàng
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Han G. Ngo, Chaitu Dandu, Brianna L. Gibney and Serena Y. Kuang
Department of Foundational Medical Studies, William Beaumont School of Medicine, Oakland University, Rochester, Michigan and Department of General Surgery, Wayne State University School of Medicine, Detroit, Michigan
Dịch bởi: BS. Thành Minh Khánh
nhathuocngocanh. Sáu bước logic kết nối phương trình Nernst và ứng dụng lâm sàng
Để tải file PDF, hãy click TẠI ĐÂY.
Tóm tắt
Phương trình Nernst là chìa khóa để hiểu được điện sinh lý của màng tế bào và sinh lý bệnh của các tình trạng mất cân bằng K+ (tăng kali máu và hạ kali máu). Tuy nhiên, theo kinh nghiệm giảng dạy sinh viên y khoa của chúng tôi trong nhiều năm qua, nhiều sinh viên gặp khó khăn trong việc tạo ra mối liên hệ giữa việc giới thiệu sơ lược về phương trình Nernst và ứng dụng lâm sàng của phương trình này đối với các tình trạng mất cân bằng K+. Bài viết này nhằm mục đích kết nối việc giới thiệu phương trình này với việc ứng dụng lâm sàng để hiểu về tình trạng mất cân bằng K+ bằng cách sử dụng 06 bước logic kèm theo các hình ảnh minh họa chi tiết giúp sự kết nối này rõ ràng và có tính gắn kết. Ngoài ra, chúng tôi nêu bật một vài khía cạnh thường gặp liên quan đến sáu bước này thường bị cả giảng viên và sinh viên bỏ qua. Những sinh viên có thể giải thích rõ ràng sự hiểu tất cả sáu bước đã được nêu trong bài viết này sẽ đạt được sự thành thạo của chủ đề này.
TÍNH MỚI VÀ ĐÁNG CHÚ Ý: Bài báo này lấp đầy những khoảng trống trong việc giảng dạy về phương trình Nernst, một phương trình quan trọng trong sinh lý học y khoa. Sáu bước logic được trình bày trong bày này kết nối việc giới thiệu phương trình Nernst với các ứng dụng lâm sàng của nó đối với tình trạng tăng kali máu và hạ kali máu, hai tình trạng có thể đe dọa tính mạng nếu không được điều trị. Chỉ khi mà sinh viên biết vận dụng phương trình này thì việc học của họ có thể chuyển từ “nông” thành thông thạo.
chemical gradient; equilibrium potential; hyperkalemia; hypokalemia; Nernst equation
GIỚI THIỆU
Phương trình Nernst, Eion = (61/z)log10([ion]ECF/[ion]ICF), trong đó z là hóa trị của một ion; [ion] là nồng độ ion, ECF là dịch ngoại bào và ICF là dịch nội bào, thường xuyên được giảng dạy ở môn sinh lý trong 2 năm đầu của trường y. Việc hiểu được điện sinh lý của màng tế bào và hiểu rõ về tình trạng tăng kali máu và hạ kali máu là rất quan trọng và cần thiết, hai tình trạng mất cân bằng K+ này có thể gây hậu quả nguy hiểm đến tính mạng nếu không được điều trị. Mặc cho tầm quan trọng của phương trình này, chúng tôi nhận thấy rằng nhiều sinh viên y khoa thường bỏ qua nó trong quá tình học tập của họ. Một lý do tiềm ẩn cho điều này là sách giáo khoa sinh lý hiện hành [ngoại trừ Costanzo’s Physiology (1)] thường chỉ giới thiệu ngắn gọn về phương trình này (2–6). Mối liên hệ với ứng dụng lâm sàng của nó thường thiếu hoặc không rõ ràng hoặc bị phân mảnh, điều dẫn đến việc học phương trình này chỉ đơn thuần ở mức “nông”. Kinh nghiệm cho chúng tôi biết rằng chỉ khi sinh viên biết làm thế nào để áp dụng phương trình này thì họ mới có thể đạt được sự thành thạo về chủ đề này. Do đó, trong bài viết này chúng tôi kết nối việc giới thiệu của phương trình Nernst với ứng dụng lâm sàng của nó, bằng việc sử dụng sáu bước logic cùng với các hình ảnh minh họa trực quan chi tiết làm cho sự kết nối trở nên rõ ràng và gắn kết, từ đó tạo điều kiện thuận lợi cho cả việc giảng dạy và các quá trình học tập. Chúng tôi cũng nêu bật một số khía cạnh thường gặp liên quan đến sáu bước mà giáo viên và sinh viên có thể bỏ qua khi dạy và học chủ đề này.
SÁU BƯỚC LOGIC KÈM MINH HỌA
Khi được áp dụng đối với K+, phương trình Nernst (EK = 61log10[K+]ECF/[K+]ICF) cho thấy sự quan hệ giữa điện thế cân bằng của K+ (EK) và gradient hóa học (như [K+]ECF/[K+]ICF), với tỉ số [K+]ECF/[K+]ICF là biến số độc lập. Bước logic đầu tiên làm nổi bật lên sự quan trọng của biến số độc lập trong phương trình này.
Bước 1
Hiểu được gradient hóa học K+ ([K+]ECF/[K+]ICF) qua màng tế bào bằng cách minh họa một cách trực quan bằng hình vẽ (Hình. 1A). Mặc dù khái niệm này có vẻ đơn giản, nguyên nhân mà chúng tôi yêu cầu các sinh viên phải minh họa theo nhiều cách khác nhau là để đảm bảo rằng họ không bỏ qua bước này trong giai đoạn học ban đầu này.
Bước 2
Minh họa cách thức mà [K+]ECF (do tăng kali máu hoặc hạ kali máu) làm thay đổi độ lớn của gradient hóa học của K+ (Hình. 1B). Chú ý rằng tăng kali máu và hạ kali máu không làm thay đổi hướng mà làm thay đổi độ lớn của gradient hóa học của K+.
![Sáu bước logic kết nối phương trình Nernst và ứng dụng lâm sàng 10 Hình 1. Minh họa hình ảnh các bước từ 1–4. A: gradient hóa học K+ bình thường. ECF, dịch ngoại bào; ICF, dịch nội bào; [K+ ], nồng độ K+. B: quan hệ giữa thay đổi [K+]ECF (tăng/hạ kali máu) và kích thước (không phải hướng) của gradient hóa học K. C: tính toán điện thế cân bằng của K+ (EK) sử dụng các giá trị [K+ ]ICF và [K+ ]ECF từ A và B. D: Các giá trị EK được đưa lên trục tọa độ để minh họa cách thức mà tăng/hạ kali máu có thể được thấy trực quan. Lưu ý, ngưỡng (threshold) là mức tối thiểu mà điện thế màng tế bào (Vm) phải đạt được để tạo ra điện thế hoạt động. Image modified from Ref. 9, with permission from FASEB Journal.](https://nhathuocngocanh.com/wp-content/uploads/2022/10/Hinh-1.-Minh-hoa-hinh-anh-cac-buoc-tu-1–4.-A_-gradient-hoa-hoc-K-binh-thuong.-ECF-dich-ngoai-bao-ICF-dich-noi-bao-K-nong-do-K.-B_-quan-he-giua-thay-doi-KECF-tang_ha-kali-mau-va-kich-thuoc-khong-1.jpg)
- Nếu ion là K+ thì tỉ số [K+]ECF/[K+]ICF < 1, có nghĩa làhướng của gradient hóa học đi từ ICF đến ECF và kết quả là EK âm.
- Nếu ion là Na+ thì tỉ số [Na+]ECF/[Na+]ICF > 1, có nghĩa là hướng của gradient hóa học của Na+ đi từ ECF đến ICF và kết quả là ENa dương.
Do đó, việc nói rằng “Cường độ và hướng của điện thế cân bằng của một anion (Eion) được quyết định bởi kích thước và hướng của gradient hóa học của ion đó” sẽ phản ánh sự hiểu sâu sắc hơn về phương trình Nernst thay vì chỉ đơn giản nói rằng Eion được xác định bởi gradient hóa học của ion đó. Theo kinh nghiệm của chúng tôi, sự thiếu sót hoặc không đủ chi tiết trong bước này là điểm đầu tiên khiến sinh viên cảm thấy phương trình Nernt thiếu khả năng ứng dụng trong lâm sàng. Ở bước tiếp theo, chúng tôi sử dụng một phép tính để giải thích sự thay đổi trong gradient hóa học của K+ ([K+]ECF/[K+]ICF) ảnh hưởng đến EK như thế nào.
Bước 3
Tính toán lần lượt các giá trị EK ở tình trạng bình thường, tăng kali máu và hạ kali máu bằng cách sử dụng phương trình Nernst (Hình. 1C). Bước này cung cấp sự hiểu biết mang tính lý thuyết hay toán học về mối quan hệ giữa các biến độc lập và phụ thuộc của phương trình Nernst. Ở bước 4, một hình minh họa tương ứng được cung cấp để cho phép sinh viên hình dung trực quan các mức độ khác nhau của EK ở một trục tọa độ được dựa trên các phép tính này.
Bước 4
Biểu diễn các giá trị EK đã tính được ở bước 3 lên trục tọa độ. Điều này minh họa cách thức mà tăng kali máu và hạ kali máu làm thay đổi các mức EK tương ứng (Hình 1D). Bây giờ phương trình Nernst trừu tượng đã có một dạng trực quan để giúp hiểu rõ hơn về phương trình này. Bước logic tiếp theo mở ra mối quan hệ giữa sự thay đổi EK và sự thay đổi tương ứng ở điện thế nghỉ màng tế bào (RMP).
Bước 5
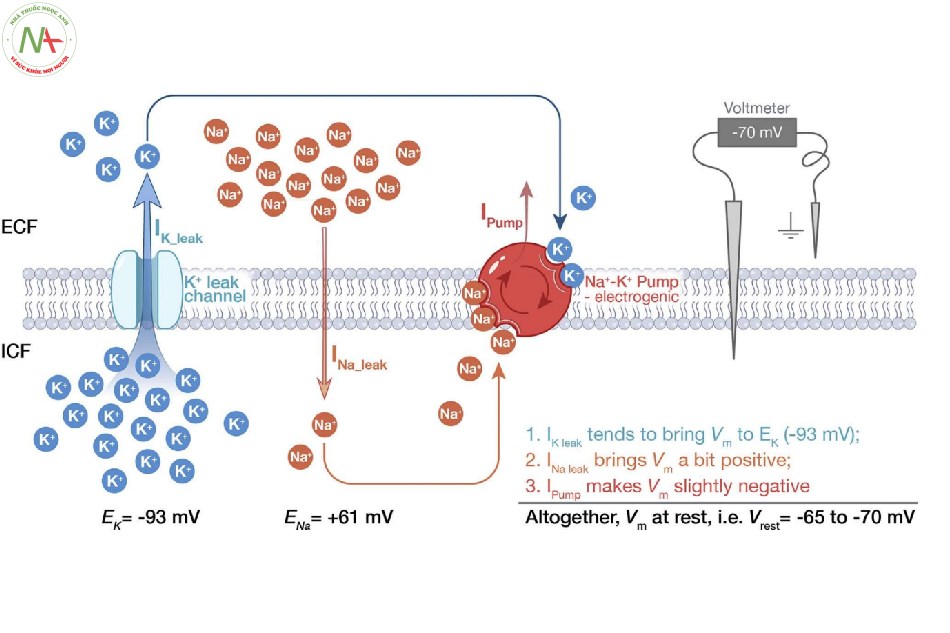
Giải thích cách thức mà thay đổi EK làm ảnh hưởng đến RMP. Trước khi hiểu cách thức mà những thay đổi EK làm ảnh hưởng đến RMP, trước tiên chúng ta hãy thảo luận về cách RMP hình thành trong điều kiện sinh lý bình thường. Hình 2 minh họa 1) cách thức mà 3 dòng ion cơ bản [dòng K+ rò rỉ (IK- leak)], dòng Na+ rò rỉ (INa-leak) và dòng được tạo ra bởi bơm Na+/K+/ATPase (Ipump) góp phần vào sự hình thành RMP, 2) tại sao thay đổi của RMP luôn luôn cùng hướng với sự thay đổi [K+]ECF. Điều quan trọng là sinh viên phải hiểu bước này trước khi chuyển sang bước cuối cùng, bước đề cập đến mối quan hệ giữa mức RMP và khả năng kích thích của một tế bào.
Bước 6
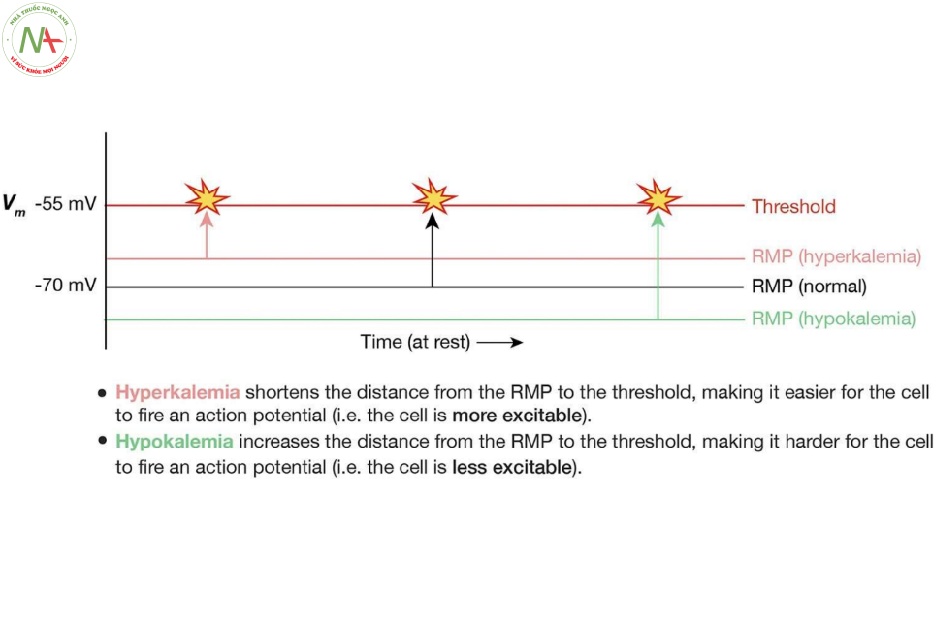
Minh họa cách thức mà thay đổi RMP ảnh hưởng đến tính kích của một tế bào (một neuron). Khi bình thường, RMP của một neuron xấp xỉ -70 mV, điều này có nghĩa là phần bên trong tế bào nhỏ hơn 70 mV so với phần bên ngoài tế bào. Khi có các thay đổi khác bình thường (như tăng hoặc hạ kali máu), RMP sẽ chuyển dịch hoặc là gần hơn hoặc là xa hơn so với điện thế ngưỡng như ở Hình 3. Tăng kali máu có thể khiến cho các tế bào phát nhịp trở nên dễ bị kích thích hơn, điều này có thể dẫn đến các sóng T cao nhọn và loạn nhịp tim nguy hiểm như rung thất và nhịp nhanh thất (7). Mặt khác, hạ kali máu có thể khiến các tế bào phát nhịp trở nên ít bị kích thích hơn, điều này có thể dẫn đến sóng T dẹt, QT kéo dài và thậm chí là vô tâm thu (8).
Tóm lại, trình tự ngắn gọn sau đây kết nối sáu bước đã được minh họa ở trên theo thứ tự logic: 1) gradient hóa học của K+ → 2) sự thay đổi [K+]ECF → 3) sự thay đổi EK được biểu diễn ở dạng toán học → 4) sự thay đổi RMP → 6) sự thay đổi về tính dễ bị kích thích của tế bào.
Các khía cạnh phổ biến thường bị bỏ qua bởi các giảng viên và sinh viên
- Như đã đề cập ở trên, bước 2 (Hình 1B) thường là điểm kết nối giữa việc giới thiệu phương trình Nernst và ứng dụng lâm sàng của phương trình này đối với các tình trạng mất cân bằng K+. Do đó, điều quan trọng là phải nhấn mạnh bước này.
- Sinh viên thường không nhận ra rằng độ lớn của EK giảm khi được tính bằng toán học khi đáp ứng với tăng [K+]ECF và kết quả là RMP ít âm hơn trên trục tọa độ và ngược lại (bước 4 hoặc Hình 1D). Nguyên nhân của điều này là độ lớn của EK là giá trị tuyệt đối của EK (ví dụ: nếu EK = –93 mV thì|EK |= 93 mV). Do đó, nếu |EK | bị giảm xuống mức 86 mV (tức là ở mức –86 mV ở trục tọa độ), đường biểu diễn sự thay đổi này sẽ dịch chuyển lên trên (gần với điện thế ngưỡng hơn) và ngược lại.
- Khái niệm có vẻ đơn giản về gradient hóa học của một ion qua màng tế bào trông có vẻ đơn giản này thường không được nhấn mạnh. Để làm rõ hơn khái niệm này, chúng tôi đã biểu diễn gradient hóa học K+ trực quan bằng hình (Hình 1, A và B) và về mặt toán học [K+]ECF/[K+]ICF hoặc log10([K+]ECF/[K+]ICF). Bằng cách sử dụng phương trình Nernst để trả lời câu hỏi sau, sinh viên sẽ đào sâu hiểu biết của họ về gradient hóa học của K+ và Na+ và ý nghĩa của chúng đối với tính kích thích của một tế bào:
Các giá trị bình thường của [K+]ECF = 4.2 mM, [K+]ICF = 140 mM, [Na+]ECF = 142 mM và [Na+]ICF = 14 mM. Nếu những giá trị này tăng hoặc giảm với cùng một lượng (ví dụ: ± 2,5 mM), mỗi một thay đổi sẽ ảnh hưởng như thế nào đến khả năng kích thích của một tế bào?
Nếu sinh viên gặp khó khăn, Hình 2 có thể giúp họ hình thành một hiểu biết trực quan về khái niệm này và các tính toán sau có thể giúp họ hình thành sự hiểu biết trên phương diện lý thuyết:
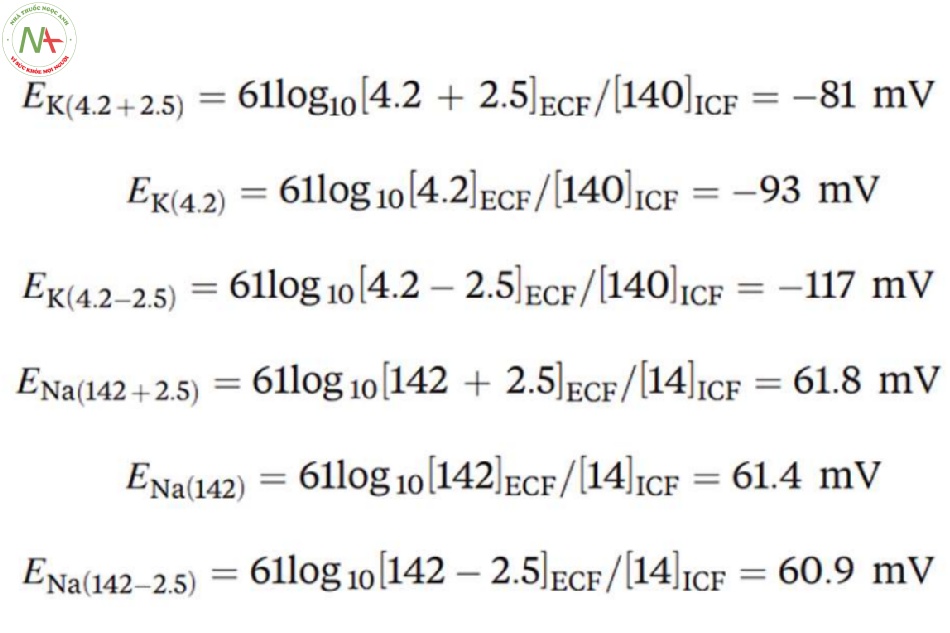
Bằng cách thực hiện các tính toán trên, các sinh viên sẽ hiểu rằng sự thay đổi ở [K+]ECF sẽ có ảnh hưởng đáng kể lên EK và tiếp theo đó là RMP và tính kích thích của tế bào. Mặt khác, cùng một lượng thay đổi ở [Na+]ECF có ảnh hưởng không đáng kể đến RMP và khả năng kích thích của tế bào bởi vì INa_leak ở điện thế nghỉ của màng tế bào là quá nhỏ và [Na+]ECF (142 mM) lớn hơn nhiều so với [K+]ECF (4.2 mM).
KẾT LUẬN
- Sáu bước được trình bày trong bài viết này kết nối việc giới thiệu phương trình Nernst với ứng dụng lâm sàng của nó một cách gắn kết và rõ ràng, điều này tạo điều kiện cho dạy và học hiệu quả.
- Các minh họa trực quan của sáu bước đóng vai trò cần thiết và mạnh mẽ trong việc tạo điều kiện thuận lợi cho quá trình nhận thức của sinh viên để lập luận và nắm vững nội dung.
- Một số khía cạnh phổ biến liên quan đến sáu bước logic thường bị bỏ qua bởi các giáo viên và sinh viên đã được làm rõ, điều này sẽ giúp củng cố thêm việc học tập của sinh viên về phương trình
NHÌN NHẬN
Các tác giả bày tỏ sự đánh giá cao đối với họa sĩ minh họa y khoa của chúng tôi, Audrey Bell, vì đã vẽ tất cả các hình trong bài viết này.
CÔNG KHAI
No conflicts of interest, financial or otherwise, are declared by the authors.
CÁC ĐÓNG GÓP
S.Y.K. conceived and designed research; S.Y.K. prepared fig- ures; H.G.N. and S.Y.K. drafted manuscript; H.G.N., C.D., B.L.G., and S.Y.K. edited and revised manuscript; H.G.N., C.D., B.L.G., and S.Y.K. approved final version of manuscript.
TÀI LIỆU THAM KHẢO
- Costanzo Physiology (6th ed.). Philadelphia, PA: Elsevier, 2018, p. 16–23.
- Barrett KE, Barman SM, Brooks HL, Yuan General principles & energy production in medical physiology. In: Ganong’s Review of Medical Physiology (26th ed.). New York: McGraw Hill Education, 2019, ebook version 1.0, p. 36–38.
- Koeppen BM, Stanton BA (Editors). Berne & Levy Physiology (7th ed.). Philadelphia, PA: Elsevier, 2018, 11–12.
- Moczydlowski EG. Electrophysiology of the cell membrane. In: Medical Physiology (3rd ed.), edited by Boron WF, Boulpaep EL. Philadelphia, PA: Elsevier, 2017, 141–153.
- Hall JE, Hall ME. Membrane potentials and action potentials. In: Guyton and Hall Textbook of Medical Physiology (14th ed.). Philadelphia, PA: Elsevier, 2021, 63–76.
- Lemieux JE, Edelman ER, Strichartz GR, Lilly LS. Normal cardiac structure and function. In: Pathophysiology of Heart Disease: a Collaborative Project of Medical Students and Faculty (6th ed.)., edited by Lilly LS. Philadelphia, PA: Lippincott Williams & Wilkins, 2003, p. 15–16.
- Mattu A, Brady WJ, Robinson Electrocardiographic manifesta- tions of hyperkalemia. Am J Emerg Med 18: 721–729, 2000. doi:10.1053/ajem.2000.7344.
- Levis JT. ECG diagnosis: hypokalemia. Perm J 16: 57, 2012. doi:7812/tpp/12-015.
- Ngo H, Dandu C, Gibney B, Kuang Nernst equation and its clinical correlation.FASEBJ 35: 2021. doi:10.1096/fasebj.2021.35.S1.04127.

