Thẩm mỹ - Làm đẹp
Quy định và ý nghĩa pháp lý trong quy trình thẩm mỹ ngoại trú.
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nhà thuốc Ngọc Anh – Chương 32: Quy định và ý nghĩa pháp lý trong quy trình thẩm mỹ ngoại trú.
Tác giả: Dr. Mario Goisis, Sara Izzo, AndreaSbarbati, Giamaica Conti và Giovanni Francesco Nicoletti
Nguồn sách: Sách: Quy trình PRP và Tiêm cấy mỡ nâng cao -Tác giả: Dr: Mario Goisis
Mô mỡ và tế bào gốc: Các khía cạnh pháp lý
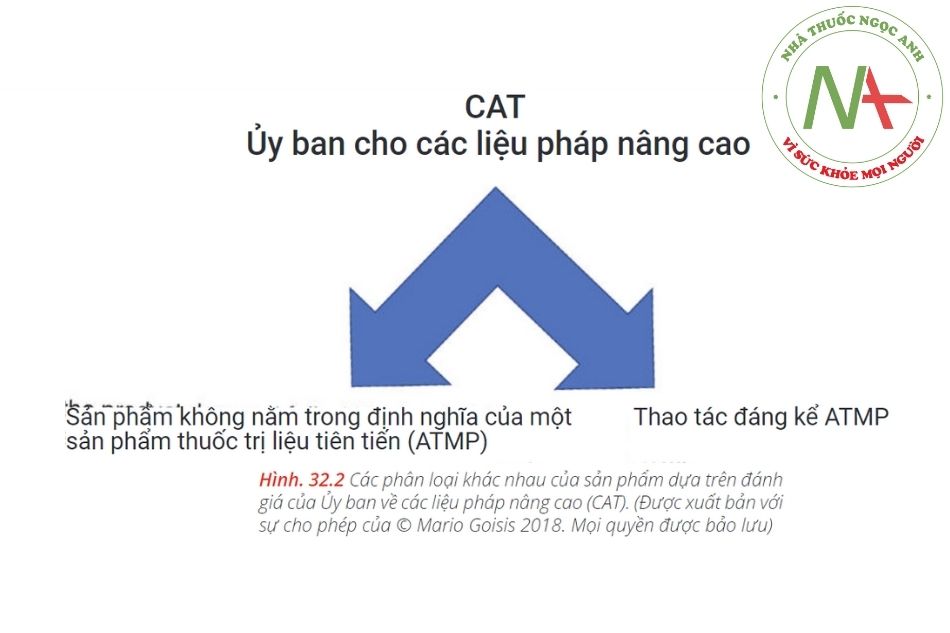
Theo quan điểm luật học, khi chúng ta nói về “mô chất béo”, chúng ta phải xem xét ba loại sản phẩm khác nhau (Hình. 32.1):
A. Mô mỡ: mô thu được với một thao tác tối thiểu. Đặc biệt, ở Liên minh Châu Âu (EU), định nghĩa được báo cáo trong Reg. EU. 1394/2007 (Reg. Eu. 1394/2007, Phụ lục I: cắt, nghiền, tạo hình, ly tâm, ngâm trong dung dịch kháng sinh hoặc kháng khuẩn, khử trùng, chiếu xạ, tách tế bào, cô đặc hoặc tinh chế, lọc, đông khô, đông lạnh, bảo quản cryo, thủy tinh hóa).
B. Phần mô đệm (SVF), một phần của mô mỡ. Nó có thể thu được bằng cách phân hủy bằng enzym (col- lagenase). Ở EU không có sự khác biệt giữa phân tách hóa học và cơ học, nhưng đối với EMA / CAT (Ủy ban về các liệu pháp nâng cao), việc sử dụng cắt dán được coi là thao tác đáng kể: “Quá trình tiêu hóa mô bằng enzym để giải phóng tế bào cũng được coi là thao tác đáng kể, khi mục đích là phân tách các điểm tiếp xúc giữa tế bào với tế bào ”(Ủy ban về các liệu pháp nâng cao, Bài phản ánh về phân loại các sản phẩm thuốc trị liệu tiên tiến, ngày 21 tháng 5 năm 2015 EMA / CAT / 600280/2010 Rev.1).
C. Tế bào gốc, thu được bằng thao tác tế bào (thao tác cơ bản) bắt đầu từ SVF.
Hiện tại, nó đã hợp nhất việc sử dụng mô mỡ tự thân để làm đầy mỡ trong các quy trình phẫu thuật một bước, bởi vì theo quan điểm pháp lý, ghép mô không phải là một sản phẩm thuốc trị liệu tiên tiến (ATMP).
Ở châu Âu, điều rất quan trọng là phải xem xét lời khuyên của CAT, Ủy ban về các liệu pháp nâng cao, bởi vì nếu sản phẩm sinh học trở thành ATMT, nó được coi là một loại thuốc và rất khó để bác sĩ phẫu thuật sử dụng.
Dưới đây, bạn có thể tìm thấy những lời khuyên quan trọng nhất và gần đây nhất của CAT về các sản phẩm sinh học dựa trên mô mỡ (Hình. 32.2).
1. Lời khuyên 2012, ngày 24 tháng 7 (EMA / 500730/2012): Mô tả: “Sản phẩm bao gồm collagen tự thân (AC) có nguồn gốc từ mô mỡ của con người (Chất làm đầy da thẩm mỹ).
”Vị trí CAT: “Sản phẩm bao gồm collagen tự thân và không chứa tế bào. Sản phẩm không chứa hoặc chứa axit nucleic tái tổ hợp được sử dụng hoặc sử dụng cho con người nhằm điều chỉnh, sửa chữa, thêm hoặc xóa một trình tự di truyền. Dựa trên những cân nhắc ở trên, sản phẩm được coi là không nằm trong định nghĩa của một sản phẩm thuốc trị liệu tiên tiến như được quy định tại Điều 2 (1) (a) của Quy định (EC) số 1394/2007.
2. Lời khuyên 2012, ngày 24 tháng 7 (EMA / 500724/2012): Mô tả: “Mỡ hút ra tự thân, không thao tác có chứa tế bào mỡ và phần mô đệm. Không có yêu cầu y tế hoặc điều trị được theo đuổi. Sản phẩm được thiết kế để hoạt động như một chất làm đầy mỡ tự nhiên, tự thân.
”Vị trí CAT: “Sản phẩm bao gồm mỡ hút ra tự thân, chứa các tế bào mỡ và phần mạch mô đệm. Các ô không bị thao túng đáng kể. Sản phẩm hoạt động như một chất làm đầy tự nhiên, tự thân. Vì vậy, các tế bào không thể được coi là “thiết kế” bằng cách sử dụng không tương đồng, vì chế phẩm này được thiết kế để sử dụng cho cùng một chức năng thiết yếu (phục hồi mô mỡ dưới da) ở vị trí nhận cũng như ở vị trí cho. Dựa trên những cân nhắc ở trên, sản phẩm được coi là không nằm trong định nghĩa của một sản phẩm thuốc trị liệu tiên tiến, như được quy định tại Điều 2 (1) (a) của Quy định (EC) số 1394/2007.”
3. Lời khuyên 2013, ngày 11 tháng 2 (EMA / 90882/2013): Mô tả: “Tế bào gốc trung mô mỡ tự thân được cô lập ở người, được nuôi cấy mở rộng đến đoạn 4 hoặc 5 khi sự biệt hóa tạo xương và cấu trúc 3 chiều được tạo ra bởi chất nền xương khử khoáng (DBM). Sản phẩm chứa các tế bào sống.
Vị trí CAT: “Tế bào gốc trung mô tự thân có nguồn gốc từ mô mỡ được sử dụng làm một trong hai nguyên liệu ban đầu có nguồn gốc từ con người. Các tế bào được xử lý theo nhiều phương pháp khác nhau, bao gồm cả bước nuôi cấy tế bào, trong quá trình sản xuất. Có thể kết luận rằng những tế bào này đã phải chịu sự thao túng đáng kể và những tế bào này được coi là tế bào đã được thiết kế. Sản phẩm được trình bày là có đặc tính điều trị khiếm khuyết xương khi được sử dụng cho con người nhằm tái tạo, sửa chữa hoặc thay thế mô này. Sự kết hợp của các tế bào tạo xương và DBM thúc đẩy hình thành mạch và tạo xương trong một khuyết tật xương đặc trưng bởi sự thiếu hình thành xương tự phát.
Dựa trên những cân nhắc ở trên, sản phẩm được coi là sản phẩm nằm trong định nghĩa về sản phẩm sử dụng mô theo quy định tại Điều 2 (1) (a) của Quy định (EC) số 1394/2007.”
4. Lời khuyên 2013, 4 tháng 4 (EMA/129099/2013): Mô tả: “Đình chỉ các tế bào tái sinh khả thi, trưởng thành, tự thân, chưa giãn nở và chưa được nuôi cấy của phần mạch đệm trong Ma trận làm giàu tế bào tự thân của mô mỡ dưới da.”
Vị trí CAT: “Sản phẩm chứa các tế bào sống động chưa bị thao tác nghiêm trọng. Phương thức hoạt động của sản phẩm (góp phần và tăng cường sự đổi mới mô và sự luân chuyển của mô dưới da) được coi là tương đồng với mô mỡ của người hiến tặng. Dựa trên những cân nhắc ở trên, sản phẩm được coi là không nằm trong định nghĩa của một sản phẩm thuốc trị liệu tiên tiến.”
5. Lời khuyên 2013, ngày 2 tháng 8 (EMA / 478311/2013): Mô tả: “Tế bào tự thân của Phân đoạn mạch máu mô đệm (SVF) của mô mỡ.”
Vị trí CAT: “SVF chứa tế bào gốc mô mỡ (ASC) được coi là một chất được sử dụng cho con người với mục đích phục hồi các chức năng sinh lý bằng cách thực hiện một hành động dược lý và / hoặc chuyển hóa. CAL chứa các tế bào khả thi nhưng các tế bào này không bị thao túng đáng kể.
Chức năng thiết yếu của CAL (hình thành tế bào mỡ và tế bào mạch máu và duy trì tế bào gốc trong mô ghép chất béo được sử dụng) được coi là giống như trong mô mỡ của người hiến tặng. Dựa trên những cân nhắc ở trên, sản phẩm được coi là không nằm trong định nghĩa của một sản phẩm thuốc trị liệu tiên tiến.”
6. Lời khuyên 2013, ngày 2 tháng 8 (EMA / 478311/2013): Mô tả: “Tế bào gốc trung mô có nguồn gốc từ mô mỡ đã mở rộng ex vivo kết hợp với vật liệu sinh học betatrical- cium phosphate.”
CAT Vị trí: “Sản phẩm bao gồm các tế bào gốc trung mô có nguồn gốc từ mô mỡ được mở rộng ex vivo kết hợp với vật liệu sinh học β-TCP. Các ô được mở rộng và do đó được coi là được thao tác đáng kể. Sản phẩm được giới thiệu như một sản phẩm thuốc có đặc tính tái tạo tạo xương và tái tạo phân tử, tức là sửa chữa mô người. Dựa trên những cân nhắc ở trên, sản phẩm được coi là sản phẩm nằm trong định nghĩa của một sản phẩm thuốc trị liệu tiên tiến, và cụ thể hơn là một sản phẩm được thiết kế mô theo định nghĩa trong
Điều 2 (1) (b) của Quy định (EC) Số 1394/2007. β-TCP được chấp thuận để sử dụng trong lâm sàng theo các yêu cầu đặt ra trong chỉ thị 93/42 / EEC liên quan đến thiết bị y tế. β-TCP là một phần nội bộ của ATMP được quản lý cho bệnh nhân. Dựa trên sự xem xét ở trên, có thể coi sản phẩm nằm trong định nghĩa của một ATMP kết hợp như được định nghĩa trong điều 2 (1) (d) của Quy định 1394/2007 / EC.” sản phẩm (sản phẩm trị liệu tế bào soma) để chỉ định điều trị đau liên quan đến viêm xương khớp, theo quy định tại Điều 2 (1) a của Quy định (EC) số 1394/2007.”
7. Lời khuyên 2014, ngày 24 tháng 11 (EMA / 557278/2015): Mô tả: “Đình chỉ các tế bào mỡ biệt hóa tự thân không được điều khiển cơ bản trong dung dịch để tiêm (Điều trị lỗ rò quanh hậu môn nguyên phát).
”Vị trí CAT: “Sản phẩm bao gồm các tế bào mỡ phân tách tự thân trong dung dịch để tiêm.
Không có thiết bị hoặc thành phần cấu trúc nào được tích hợp vào sản phẩm. Các tế bào mỡ tự thân đã biệt hóa được coi là “được thiết kế” vì chúng không nhằm mục đích sử dụng cho cùng một chức năng hoặc chức năng cần thiết ở người nhận như ở người cho. Sản phẩm dùng để điều trị bệnh rò quanh hậu môn. Cơ chế hoạt động được tuyên bố là dựa trên các kích thích sinh lý, các tế bào từ mô mỡ có thể sửa chữa, tái tạo hoặc thay thế các mô bị thương và thúc đẩy đóng lỗ rò quanh hậu môn..
EMA / CAT cho rằng Sản phẩm nằm trong định nghĩa của một sản phẩm thuốc trị liệu tiên tiến, một sản phẩm được thiết kế mô như được quy định trong Điều 2 (1) (b) của Quy định (EC) số 1394/2007.”
8. Lời khuyên 2016, ngày 21 tháng 3 (EMA / 213726/2016): Mô tả: “Hỗn dịch vô trùng tế bào tự thân của phần mô mỡ mô đệm của mô mỡ trong Lactated Ringers (Điều trị Đau do thoái hóa khớp).”Vị trí CAT: “Ủy ban đã thông qua vào ngày 25 tháng 11 năm 2015 khuyến nghị khoa học sau:
Trên cơ sở đó:
• Sản phẩm bao gồm các tế bào được điều khiển có nguồn gốc từ phần mạch mô đệm và;
• Sản phẩm được sử dụng để điều trị các cơn đau liên quan đến viêm xương khớp thông qua hoạt động miễn dịch học.
EMA / CAT cho rằng Sản phẩm nằm trong định nghĩa của một loại thuốc trị liệu tiên tiến
9. Lời khuyên 2016, ngày 1 tháng 4 (EMA / 240965/2016): Mô tả: “Tế bào tái tạo có nguồn gốc từ mô mỡ khả thi được chiết xuất từ mỡ dưới da bụng của con người (điều trị sụn khớp và các khuyết tật xương, bao gồm cả tổn thương xương hoặc tổn thương xương).
”Vị trí CAT: “Ủy ban đã thông qua vào ngày 25 tháng 11 năm 2015 khuyến nghị khoa học sau
Trên cơ sở đó:
• Sản phẩm bao gồm các tế bào được thiết kế đã qua thao tác đáng kể để đạt được các đặc điểm sinh học, chức năng sinh lý hoặc cấu trúc liên quan đến mục đích tái tạo, sửa chữa hoặc thay thế, và không nhằm mục đích sử dụng cho cùng chức năng thiết yếu hoặc các chức năng ở người nhận cũng như ở người cho,
• Sản phẩm được sử dụng cho con người nhằm tái tạo, sửa chữa hoặc thay thế mô người,
• Sản phẩm kết hợp, như một phần không thể thiếu của sản phẩm, một thiết bị y tế, axit hyaluronic, EMA / CAT coi rằng Sản phẩm nằm trong định nghĩa của một sản phẩm được chế tạo từ mô kết hợp.”