COVID-19
Phân bố khí và máu ở bệnh nhân Covid-19 nguy kịch thông qua định lượng DECT
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
nhathuocngocanh.com – Bài viết Phân bố khí và máu ở bệnh nhân Covid-19 nguy kịch thông qua định lượng DECT được biên dịch bởi bác sĩ Đặng Thanh Tuấn bệnh viện Nhi Đồng 1. Để tải file PDF của bài viết, xin vui lòng click vào link ở đây.
Tóm tắt
Bối cảnh
Bệnh nhân COVID-19 bị bệnh nặng có các đặc điểm sinh lý bệnh của phổi đặc trưng bởi các bất thường về tưới máu. Tuy nhiên, cho đến nay chưa có nghiên cứu nào đánh giá liệu những thay đổi trong phân phối khí phổi và thể tích máu có liên quan đến mức độ nghiêm trọng của suy giảm trao đổi khí và kiểu hỗ trợ hô hấp (không xâm nhập so với xâm nhập) ở bệnh nhân COVID-19 nặng hay không. viêm phổi.
Phương pháp
Đây là một nghiên cứu thuần tập hồi cứu, đơn trung tâm được thực hiện tại một bệnh viện chăm sóc cấp ba ở Bắc Ý trong đợt đại dịch đầu tiên. Sự phân bố khí và máu phổi được đánh giá bằng kỹ thuật phân tích định lượng chụp cắt lớp vi tính năng lượng kép. Mất thông khí ở phổi (phản ánh theo tỷ lệ phần trăm mô phổi được thông khí bình thường) và mức độ của không phù hợp khí:thể tích máu (tỷ lệ phần trăm mô phổi không được sục khí, tưới máu — shunt; khoảng chết có sục khí, không được tưới máu; và vùng không được sục khí/không được tưới máu) được đánh giá ở những bệnh nhân COVID-19 bị bệnh nặng với các mức độ lâm sàng khác nhau được phản ánh bởi nhu cầu hỗ trợ hô hấp không xâm nhập hoặc không xâm nhập.
Kết quả
Ba mươi lăm bệnh nhân được nhận vào phòng chăm sóc đặc biệt từ ngày 29 tháng 2 đến ngày 30 tháng 5 năm 2020 đã được đưa vào nghiên cứu. Bệnh nhân cần thở máy xâm nhập và không xâm nhập đều có tỷ lệ mô phổi được sục khí bình thường thấp hơn (trung vị [khoảng giữa các phần] 33% [24–49%] so với 63% [44–68%], p<0,001); và không phù hợp lượng khí:lượng máu lớn hơn (43% [30–49%] so với 25% [14–28%], p
= 0,001), do shunt cao hơn (23% [15–32%] so với 5% [2–16%], p = 0,001) và vùng không được sục khí/không được tưới máu (5% [3–10%] so với 1% [0–2%], p = 0,001). Tỷ lệ PaO2/FiO2 tương quan thuận với mô được thông khí bình thường (ρ = 0,730, p <0,001) và nghịch với mức độ không phù hợp thể tích khí: máu (ρ = – 0,633, p <0,001).
Kết luận
Ở những bệnh nhân nặng bị viêm phổi COVID-19 nặng, nhu cầu thở máy xâm nhập và suy giảm oxy có liên quan đến mất thông khí và mức độ không phù hợp khí:thể tích máu.
Giới thiệu
Vào tháng 12 năm 2019, một căn bệnh (COVID-19) do một loại coronavirus mới (SARS- CoV-2) gây ra đã xuất hiện ở Trung Quốc; nó đã lan rộng ra toàn cầu, gây ra đại dịch. Bệnh nhân COVID-19 có nhiều biểu hiện lâm sàng, bao gồm suy hô hấp giảm oxy máu nặng cần thở máy [1- 4]. Mặc dù những bệnh nhân này thường đáp ứng các tiêu chí cho hội chứng suy hô hấp cấp (ARDS), các đặc điểm sinh lý bệnh đặc biệt đã được xác định [5], đòi hỏi các chiến lược điều trị cụ thể [6, 7]. Bệnh nhân COVID-19 thường có biểu hiện giảm oxy máu nghiêm trọng do phân suất shunt cao trên phạm vi rộng của phổi, và kết quả chụp cắt lớp vi tính lồng ngực (CT) không phải lúc nào cũng giải thích đầy đủ mức độ suy giảm trao đổi khí [8, 9]. Đã có những báo cáo tương phản liên quan đến sự khác biệt giữa sinh lý bệnh của ARDS liên quan đến COVID-19 và ARDS do các nguyên nhân khác [10, 11], có liên quan đến điều kiện thở máy [12].
Dấu hiệu nhận biết X quang của COVID-19 là hình kính mờ, thường chồng lên các vùng đông đặc nhất [13]. Người ta đã đưa ra giả thuyết rằng các vùng hình kính mờ thể hiện sự tưới máu cao, dẫn đến tăng shunting [6, 8, 14]. Các vùng thông khí lớn, không được tưới máu cũng đã được báo cáo [15], ngay cả khi không có thuyên tắc phổi [16]. Điều này cho thấy rằng shunt, những vùng có cả tỷ lệ thông khí-tưới máu tăng và giảm, và vi thuyên tắc phổi có thể cùng tồn tại [17]. Chụp cắt lớp vi tính năng lượng kép, tăng cường chất cản quang (DECT, contrast-enhanced, dual-energy computed tomography) là một kỹ thuật hình ảnh có khả năng tạo bản đồ mật độ iốt định lượng và mô tả sự phân bố máu trong vùng phổi, và đã được đề xuất như một công cụ để đo cả thông khí và tưới máu phổi trong các bệnh phổi [18] bao gồm COVID-19 [16].
Mối liên quan của những thay đổi về thông khí và tưới máu phổi với suy giảm trao đổi khí và mức độ nghiêm trọng của bệnh trong COVID-19 cần được điều tra. Trong bối cảnh này, chúng tôi đã tiến hành một nghiên cứu thuần tập hồi cứu với mục đích định lượng những thay đổi về thông khí và tưới máu phổi ở những bệnh nhân nặng bị viêm phổi COVID-19 nặng. Chúng tôi đưa ra giả thuyết rằng mức độ nghiêm trọng của viêm phổi COVID-19, được phản ánh bởi hỗ trợ hô hấp được yêu cầu (hỗ trợ hô hấp không xâm nhập và xâm nhập) và mức độ suy giảm trao đổi khí, có liên quan đến mức độ không phù hợp khí:thể tích máu .
Phương pháp
Nghiên cứu thuần tập hồi cứu này được thực hiện tại một bệnh viện trực thuộc trường đại học ở Genoa, miền bắc nước Ý trong giai đoạn cao điểm của đợt đại dịch COVID-19 đầu tiên. Đề cương nghiên cứu đã được phê duyệt bởi hội đồng đánh giá đạo đức (Comitato Etico Regione Liguria, giao thức số 163/2020) và sự cần thiết phải có sự đồng ý bằng văn bản đã được thông báo cho dữ liệu hồi cứu. Nghiên cứu được báo cáo theo các khuyến nghị Tăng cường báo cáo các nghiên cứu sản phụ khoa trong Dịch tễ học (STROBE) và Báo cáo lại các nghiên cứu được thực hiện bằng cách sử dụng các khuyến nghị Quan sát về sức khỏe được thu thập định kỳ (RECORD) [19].
Quy trình bao gồm bệnh nhân và thu thập dữ liệu
Nghiên cứu này bao gồm các bệnh nhân COVID-19 bị bệnh nặng liên tiếp, được xác nhận bởi phản ứng chuỗi polymerase của SARS-CoV-2 trên các mẫu tăm bông mũi họng, được nhận vào từ ngày 29 tháng 2 đến ngày 30 tháng 5 năm 2020, những người đã trải qua quét DECT trong thời gian ở ICU của họ. Các chỉ định cho DECT là cần thiết để hướng dẫn chiến lược thở máy và chống đông máu khi tình trạng trao đổi khí xấu đi hoặc nghi ngờ thuyên tắc phổi. Tiêu chí loại trừ là thu nhận DECT sau ngày 30 tháng 5 năm 2020 và sự hiện diện của hình xảo ảnh (artefacts) xương do chụp DECT với cánh tay để xuống. Dữ liệu nhân khẩu học, dịch tễ học và lâm sàng được thu thập từ hồ sơ bệnh án điện tử, cả vào thời điểm ICU nhập viện và vào ngày DECT. Dữ liệu về các liệu pháp điều trị mãn tính và các bệnh đi kèm đã được truy xuất từ các hồ sơ lâm sàng. Bệnh nhân được phân nhóm theo mức độ nghiêm trọng được phản ánh bởi mức độ hỗ trợ hô hấp nhận được vào ngày chụp DECT (hỗ trợ hô hấp không xâm nhập so với thở máy xâm nhập) và sự sống còn của họ được theo dõi cho đến khi xuất viện ICU. Việc lựa chọn thở máy xâm nhập dựa trên đánh giá các thông số lâm sàng bao gồm mức độ nghiêm trọng của giảm oxy máu và khó thở, thất bại của hỗ trợ hô hấp không xâm nhập và không có chống chỉ định nhập viện ICU. Thời gian nghiên cứu được đặc trưng bởi việc sử dụng các nguồn lực chăm sóc sức khỏe rất cao và thông khí không xâm nhập cũng được sử dụng như một cầu nối để đặt nội khí quản và nhập viện ICU ở những bệnh nhân nặng trong trường hợp thiếu giường ICU. Hơn nữa, liệu pháp oxy lưu lượng cao vẫn chưa được triển khai rộng rãi. Trong bối cảnh này, DECT đã được giới thiệu ở bệnh nhân COVID-19 tại cơ sở của chúng tôi như một phác đồ lâm sàng chuẩn hóa để tối ưu hóa việc quản lý điều trị. Tệp bổ sung 1 báo cáo chi tiết thêm về bối cảnh lâm sàng, chỉ định và cơ sở lý luận cho việc sử dụng DECT chi tiết từng phút. Chúng tôi tính toán tỷ lệ thông khí (ventilatory ratio) là thông khí phút (ml/phút) × PaCO2/(trọng lượng cơ thể dự đoán × 100 × 37,5 mmHg) [20].
Giao thức phân tích DECT
Các phân đoạn nhu mô phổi và mạch máu được thu nhận bằng cách sử dụng mạng lưới thần kinh đa phân giải không bao gồm các mạch máu lớn hơn 1 mm [21], sau đó là sàng lọc thủ công khi cần thiết. Vì phương pháp phân đoạn của chúng tôi đã loại trừ các mạch máu, nên các giá trị tuyệt đối của thể tích và trọng lượng phổi có thể không so sánh trực tiếp với các giá trị thu được trong các nghiên cứu CT thông thường, trong đó các mạch máu thường bị phân loại nhầm là mô không có thông khí [22, 23]. Sự phân bố không gian của khí và máu trong mặt nạ phổi được đánh giá bằng hình ảnh ảo không cản quang (VNC, virtual non-contrast) và thể tích máu phổi (PBV, pulmonary blood volume) [24], được tính toán thông qua một thuật toán phân hủy ba vật liệu [25], như được trình bày chi tiết trong phần bổ sung trực tuyến. Tóm lại, DECT thu nhận đồng thời hai lần quét với các năng lượng bức xạ khác nhau tương tác khác nhau với môi trường tương phản có chứa i-ốt và hai lần quét được phân tích để tái tạo lại sự phân bố không gian của i-ốt trong phổi. Ba vùng quan tâm (ROI) có trọng lượng mô phổi bằng nhau [22, 26] được phân chia bởi hai đường cắt phẳng dọc theo trục bụng- lưng hoặc trục sọ. Các phân tích về thể tích phổi, thể tích khí phổi (Vgas) và thông khí được tính toán dựa trên hình ảnh VNC, chia các ngăn phổi thành tăng, bình thường, kém và không thông khí, theo các ngưỡng suy giảm thường được sử dụng trong các nghiên cứu ARDS [22]. Sự hiện diện của thuyên tắc phổi đại thể đã được đánh giá bởi hai bác sĩ X quang (GM và SS).
Phân tích sự phù hợp khí: thể tích máu phổi
Chúng tôi sử dụng bản đồ VNC và PBV để chia phổi thành các ngăn có đặc điểm đồng nhất về phân phối khí và máu. Chúng tôi định nghĩa là mô không được tưới máu (non-perfused tissue), phần trăm khối lượng phổi được cấu tạo bởi các voxels trong đó PBV nằm dưới giới hạn phát hiện của kỹ thuật DECT (PBV <1 HU), do đó xác định các vùng phổi không được môi trường cản quang tiếp cận. Sự không phù hợp về khí:thể tích máu phổi (lung gas blood volume mismatch) được định nghĩa là tổng của ba ngăn sau [15], được biểu thị bằng phần trăm của tổng khối lượng phổi: shunt (vùng phổi không sục khí nhưng được tưới máu, với VNC ≥ – 100 HU và PBV ≥ 1 HU), khoảng chết (vùng được sục khí, nhưng không được tưới máu với VNC <- 100 và PBV <1), và vùng không được sục khí/không được tưới máu (VNC ≥ – 100 HU và PBV <1). Chúng tôi cũng tính toán tỷ lệ khí: máu là tỷ lệ của Vgas so với PBV, được chuẩn hóa sao cho 1 tương ứng với lượng khí và máu được phân phối theo tỷ lệ (chi tiết được cung cấp trong tệp Bổ sung 1).
Phân tích thống kê
Dữ liệu được báo cáo dưới dạng trung vị (phạm vi liên phần tư), trừ khi được chỉ định khác. Đối với mục đích vẽ đồ thị và để cải thiện khả năng đọc của các biểu đồ, biểu đồ được báo cáo là phương tiện có sai số tiêu chuẩn (SEM). Chúng tôi đã so sánh dữ liệu giữa các nhóm với bài kiểm tra chính xác Mann – Whitney U, χ2 hoặc Fisher’s, nếu thích hợp. Với những hoàn cảnh đặc biệt mà nghiên cứu được thực hiện, kế hoạch phân tích đã được phát triển trong quá trình tiến hành nghiên cứu. Các tiêu chí đồng chính của chúng tôi là lượng thông khí ở phổi (phần trăm mô phổi được thông khí bình thường) và mức độ không phù hợp khí:thể tích máu. Việc tính toán kích thước mẫu trước là không khả thi do thiếu dữ liệu về cả COVID-19 và phân tích DECT định lượng, tuy nhiên, kích thước mẫu đạt được cao hơn hoặc có thể so sánh với các nghiên cứu hình ảnh tương tự trong COVID- 19 [10, 15]. Chúng tôi đã điều tra mối tương quan giữa các biến DECT chính và các thông số lâm sàng bằng Spearman’s rho. Trong phân tích độ nhạy, chúng tôi sử dụng hồi quy tuyến tính để mô hình hóa tỷ lệ PaO2/FiO2 như một hàm của mức độ của các ngăn thông khí-tưới máu. Tất cả các phân tích thống kê được thực hiện trong SPSS Statistics dành cho Windows, Phiên bản 25.0 (IBM Corp., Armonk, NY, USA). Ý nghĩa được giả định ở giá trị p hai phía <0,05.
Kết quả
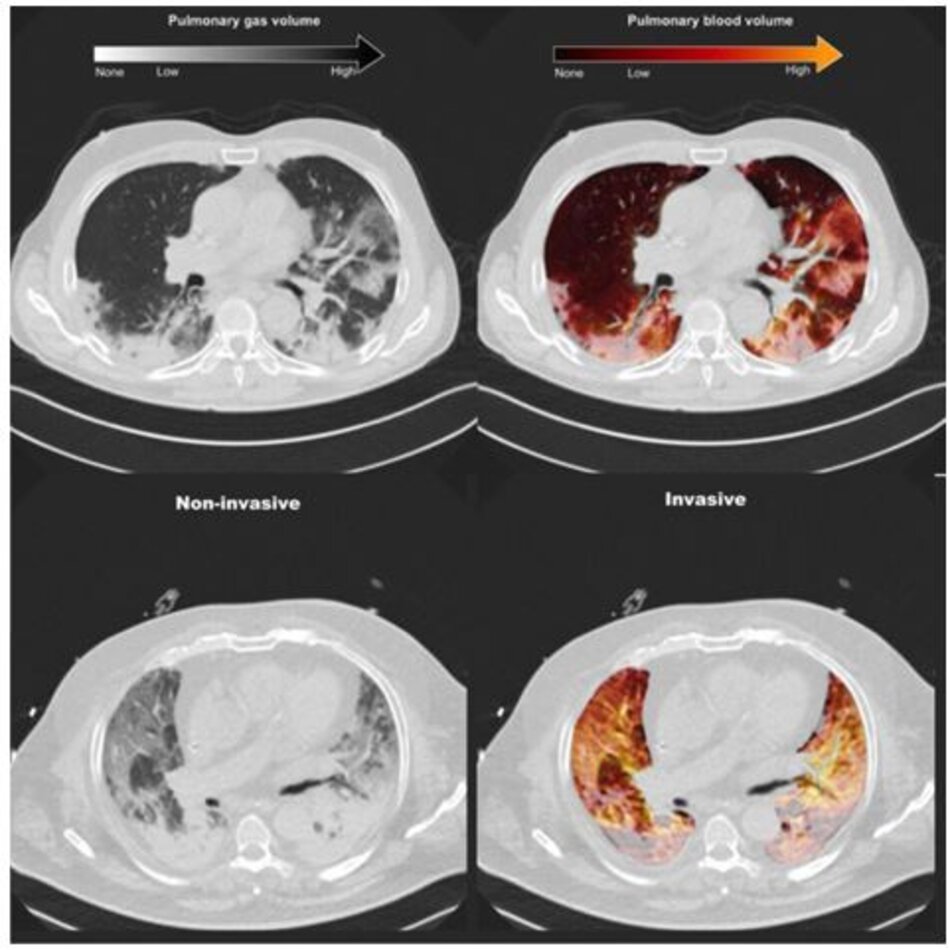
Nhìn chung, 121 bệnh nhân COVID-19 bị bệnh nặng đã được nhận vào ICU trong suốt thời gian nghiên cứu. Ba mươi lăm bệnh nhân đã được dưa vào trong nghiên cứu này (luồng bao gồm được báo cáo trong Hình 1). Hình 2 cho thấy phân bố thể tích khí và máu ở hai bệnh nhân đại diện.
Mô tả dân số
Đặc điểm cơ bản của bệnh nhân và các thông số lâm sàng vào ngày chụp DECT được báo cáo trong Bảng 1. Mười bốn bệnh nhân (40%) tử vong tại ICU, trong khi 21 (60%) được đưa về khoa còn sống. So với những bệnh nhân được hỗ trợ hô hấp không xâm nhập, những bệnh nhân được thở máy xâm nhập có thời gian trôi qua lâu hơn kể từ khi bắt đầu có triệu chứng, nồng độ D- dimer và các dấu hiệu viêm cao hơn, suy giảm trao đổi khí nặng hơn (Bảng 1). Kết quả phân tích DECT định lượng được báo cáo trong Bảng 2 và được minh họa trong Hình. 3 và 4.

Phân tích DECT phổi — phân bố thể tích khí
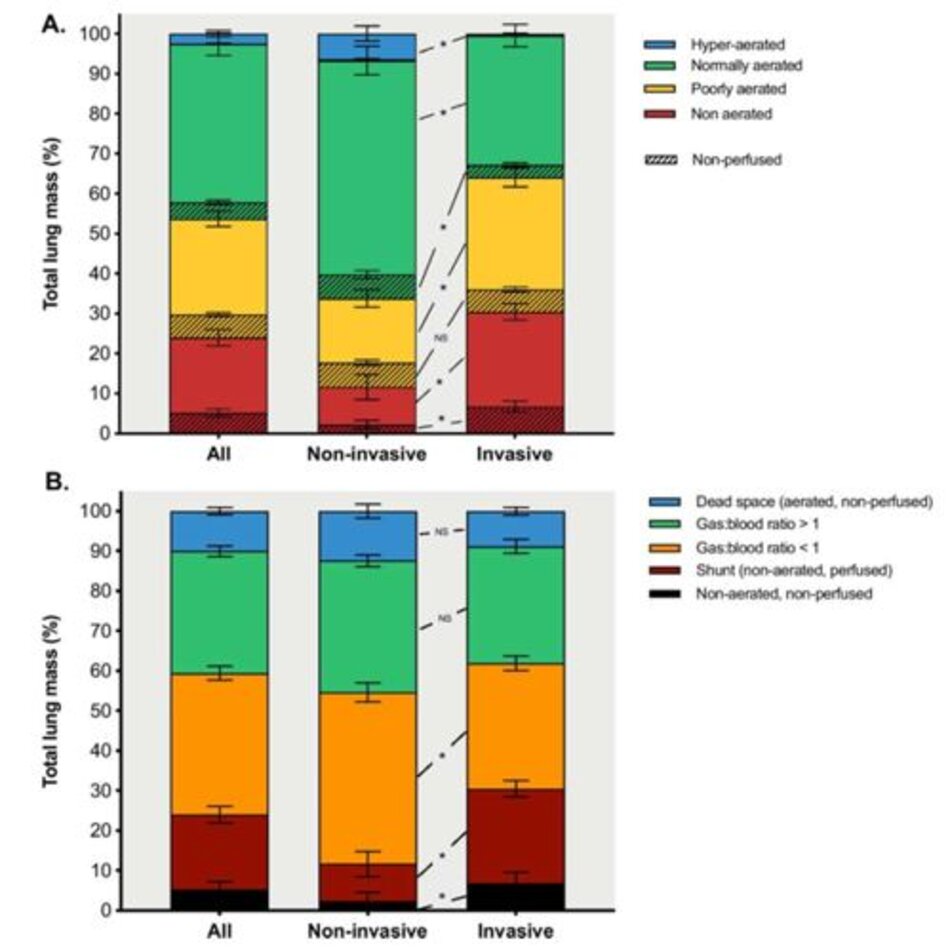
Tỷ lệ mô được sục khí bình thường thấp hơn ở những bệnh nhân được thở máy xâm nhập so với những người được hỗ trợ hô hấp không xâm nhập (33% [24–49%] so với 63% [44– 68%], p <0,001, Hình 3a). Bệnh nhân được thở máy xâm nhập so với thở máy không xâm nhập có vùng kém sục khí và không được sục khí lớn hơn (Hình 3a), và những vùng này tăng lên dọc theo bụng-lưng (Hình. S1A) và đỉnh-đuôi (Hình. 1: Hình S2A) trục. Những bệnh nhân được thở máy xâm nhập có tổng thể tích phổi thấp hơn và trọng lượng phổi cao hơn (Bảng 2).
Phân tích DECT phổi — phân bố thể tích máu
Các vùng không được tưới máu được phân bố ở các vùng bình thường, kém và không được sục khí, như được minh họa trong Hình 3a. Các khu vực không được tưới máu chủ yếu nằm ở các khu vực không được sục khí ở những bệnh nhân được thông khí xâm nhập, trong khi những bệnh nhân được hỗ trợ hô hấp không xâm nhập có lượng nhu mô không được tưới máu lớn hơn ở các khu vực được sục khí bình thường. Tỷ lệ thuyên tắc phổi đại thể cao hơn về số lượng ở bệnh nhân thở máy xâm nhập và không xâm nhập, nhưng sự khác biệt này không có ý nghĩa thống kê (21,7% so với 8,0%, p = 0,640, Bảng 2). Số lượng mô không được tưới máu ở những bệnh nhân có (N = 6) và không có (N = 29) bằng chứng X quang về thuyên tắc phổi đại thể lần lượt là 18% [12–23%] và 14% [8–18%] (p =0,272).
Bảng 1 Đặc điểm của bệnh nhân và các thông số vào ngày chụp cắt lớp vi tính năng lượng kép
| All (N = 35) | Non-invasive (N = 12) | Invasive (N = 23) | p | |
| Age | 59 [55–64] | 58 [55–62] | 60 [53–67] | 0.694 |
| Sex (male), n (%) | 30 | 10 | 20 | |
| Weight (kg) | 80 [75–96] | 90 [85–96] | 80 [73–95] | 0.173 |
| Body mass index (kg/m2) | 28 [25–31] | 28 [28–31] | 28 [24–32] | 0.521 |
| Days since onset of symptoms | 19 [16–31] | 18 [16–19] | 25 [15–35] | 0.045* |
| Days since first confirmed swab | 16 [9–22] | 12 [9–14] | 20 [11–32] | 0.026* |
| Days since hospital admission | 13 [7–21] | 12 [8–13] | 19 [7–31] | 0.115 |
| Days since ICU admission | 12 [3–21] | 12 [8–13] | 15 [2–31] | 0.161 |
| Comorbidities | ||||
| Charlson Comorbidity Index | 1 [1, 2] | 2 [1, 2] | 1 [1, 2] | 0.878 |
| Hypertension, n (%) | 14 (40.0) | 6 (50.0) | 8 (34.8) | 0.477 |
| Diabetes, n (%) | 6 (17.1) | 2 (16.7) | 4 (17.4) | > 0.999 |
| History of pulmonary embolism, n (%) | 1 (2.9) | 0 (0.0) | 1 (4.3) | > 0.999 |
| Chronic obstructive lung disease, n (%) | 3 (8.6) | 2 (16.7) | 1 (4.3) | 0.266 |
| Chronic therapy | ||||
| Calcium channel blockers, n (%) | 2 (5.7) | 1 (8.3) | 1 (4.3) | > 0.999 |
| Angiotensin II receptor blockers, n (%) | 4 (11.4) | 3 (25.0) | 1 (4.3) | > 0.999 |
| Angiotensin-converting enzyme inhibitors, n (%) | 3 (8.6) | 2 (16.7) | 1 (4.3) | 0.239 |
| Oral anticoagulants, n (%) | 2 (5.7) | 2 (16.7) | 0 (0.0) | 0.098 |
| Antiplatelet therapy, n (%) | 5 (14.3) | 5 (41.7) | 0 (0.0) | 0.150 |
| Steroids in the previous month, n (%) | 3 (8.6) | 2 (16.7) | 1 (4.3) | 0.239 |
| Drugs received during ICU stay | ||||
| Darunavir/ritonavir, n (%) | 5 (14.3) | 0 (0.0) | 5 (21.7) | 0.150 |
| Hydroxychloroquine, n (%) | 24 (68.6) | 10 (83.3) | 14 (60.9) | 0.432 |
| Remdesivir, n (%) | 1 (2.9) | 0 (0.0) | 1 (4.3) | > 0.999 |
| Tocilizumab, n (%) | 12 (34.3) | 5 (41.7) | 7 (30.4) | 0.709 |
| Methylprednisolone, n (%) | 15 (42.9) | 6 (50.0) | 9 (39.1) | 0.721 |
| Anticoagulation regimen | ||||
| None, n (%) | 1 (2.9) | 0 (0.0) | 1 (4.3) | 0.098 |
| Enoxaparin, prophylactic dose, n (%) | 9 (25.7) | 6 (50.0) | 3 (13.0) | |
| Enoxaparin, therapeutic dose, n (%) | 18 (51.4) | 5 (41.7) | 13 (56.5) | |
| Sodium heparin (continuous infusion), n (%) | 7 (20.0) | 1 (8.3) | 6 (26.1) | |
| Blood analyses | ||||
| Interleukin-6 (ng/L) | 45 [8–153] | 18 [8–45] | 85 [10–739] | 0.115 |
| D-dimer (mcg/L) | 1497 [990–4126] | 1024 [519–2792] | 1581 [1174–5358] | 0.023* |
| Ferritin (mcg/L) | 921 [603–1888] | 733 [477–904] | 1399 [888–1929] | 0.016* |
| C-reactive protein (mg/L) | 17 [9–89] | 10 [5–16] | 40 [13–107] | 0.017* |
| Gas exchange | ||||
| pHa | 7.43 [7.40–7.45] | 7.44 [7.42–7.47] | 7.43 [7.34–7.45] | 0.184 |
| PaCO2 (mmHg) | 43 [39–53] | 39 [37–42] | 47 [42–55] | 0.001* |
| PaO2 (mmHg) | 94 [77–125] | 108 [93–144] | 82 [71–97] | 0.023* |
| PaO2/FiO2 (mmHg) | 179 [117–195] | 194 [186–250] | 139 [108–188] | 0.002* |
| Bicarbonate (mEq/L) | 28 [25–31] | 27 [25–28] | 29 [25–33] | 0.071 |
| Respiratory parameters | ||||
| PEEP (cmH2O) | 10 [8–10] | 10 [8–10] | 10 [8–12] | 0.959 |
| FiO2 (%) | 60 [50–70] | 60 [45–63] | 60 [50–70] | 0.172 |
| Respiratory rate (min−1) | 19 [16–24] | 16 [14–20] | 20 [16–25] | 0.011* |
| Tidal volume per predicted body weight (mL/kg) | 7.3 [5.5–7.8] | n.a | 7.3 [5.5–7.8] | n.a |
| Driving pressure (cmH2O) | 16 [12–18] | n.a | 16 [12–18] | n.a |
| Plateau pressure (cmH2O) | 25 [21–28] | n.a | 25 [21–28] | n.a |
| Compliance (mL/cmH2O) | 34 [22–43] | n.a | 34 [22–43] | n.a |
| Ventilatory ratio | 1.8 [1.4–2.4] | n.a | 1.8 [1.4–2.4] | n.a |
Bảng 2 Các thông số chụp cắt lớp vi tính năng lượng kép định lượng phổi
| Parameter | All (N = 35) | Non-invasive (N = 12) | Invasive (N = 23) | p |
| Lung volume (mL) | 2794 [2150 – 3690] | 3680 [3180 – 4245] | 2359 [1934 – 3207] | 0.001 |
| Mean attenuation (HU) | – 615 [− 687 to
– 454] |
– 771 [− 807 to
– 649] |
– 506 [− 639 to
– 406] |
< 0.001* |
| Lung weight§ (g) | 1039 [878 – 1268] | 966 [759 – 1061] | 1086 [884 – 1283] | 0.045* |
| Pulmonary gas volume (mL) (Vgas) | 1621 [1019 – 2498] | 2929 [1873 – 3350] | 1140 [726 – 1765] | < 0.001* |
| Evidence of macroscopic pulmonary embolism, n (%) | 6 (17.1) | 1 (8.0) | 5 (21.7) | 0.640 |
| Non-perfused tissue (g) | 138 [90 – 219] | 118 [87 – 201] | 180 [102 – 262] | 0.327 |
| Dead-space tissue (g) | 87 [57 – 162] | 87 [71 – 142] | 86 [51 – 171] | 0.503 |
| Non-aerated/non-perfused lung tissue (g) | 33 [12 – 84] | 11 [3 – 21] | 65 [29 – 105] | 0.001* |
| Shunt tissue (g) | 193 [70 – 299] | 39 [20 – 128] | 253 [180 – 357] | < 0.001* |
| Tissue with gas:blood volume ratio < 1 (g) | 360 [292 – 435] | 429 [325 – 464] | 355 [291 – 423] | 0.195 |
| Tissue with gas:blood volume ratio > 1 (g) | 293 [249 – 355] | 295 [273 – 328] | 293 [248 – 365] | 0.932 |
Phân tích DECT phổi — sự phù hợp khí:thể tích máu
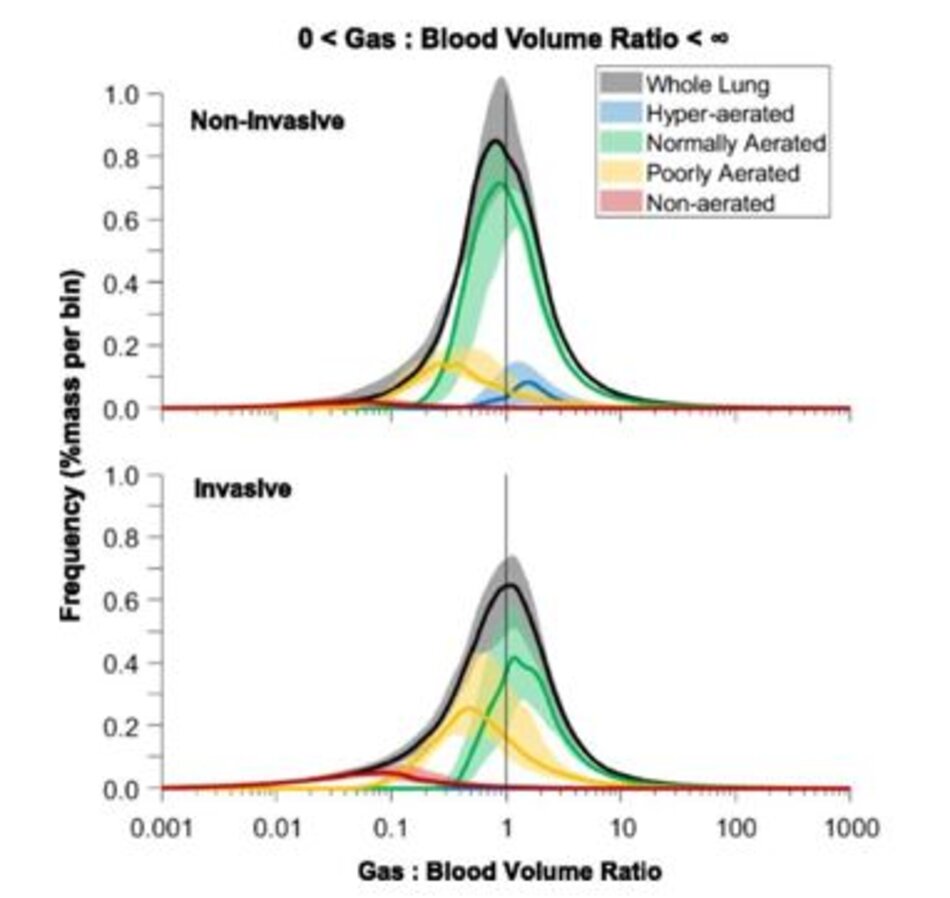
Mức độ sự không phù hợp về khí:thể tích máu cao hơn ở những bệnh nhân được thở máy xâm nhập so với những bệnh nhân được hỗ trợ không xâm nhập (43% [30–49%] so với 25% [14– 28%], p = 0,001). Thể tích máu ở phổi được phân phối dọc theo đường thành bụng và độ dốc đỉnh – đuôi và sự phân bố của nó là tương tự ở những bệnh nhân được hỗ trợ hô hấp không xâm nhập và xâm nhập (Tập tin bổ sung 1: Hình S3). Shunt, ngăn không sục khí/không tưới máu, và các khu vực có tỷ lệ thể tích khí: máu <1 ở những bệnh nhân được thở máy xâm nhập cao hơn so với những bệnh nhân được hỗ trợ không xâm nhập (Hình 3b). Shunt, không được sục khí/không được tưới máu, và các vùng có tỷ lệ khí:thể tích máu <1 tăng lên dọc theo trục bụng-lưng (Hình ảnh bổ sung 1: Hình S1B) và đỉnh-đuôi (Hình ảnh bổ sung 1: Hình S2B). Ngăn sục khí kém (29% [22–34%]) có tỷ lệ khí:thể tích máu ở cả dưới (21% [16–32%]) và trên 1 (5% [4–7%]). Ngăn không được sục khí (26% [11–36%]) hoạt động như shunt (20% [9–25%]) hoặc không được tưới máu (4% [1–8%]). Mô khoảng chết là 9% [6– 14%], phân bố cả trong ngăn bình thường- (4% [2–6%]) và kém sục khí (5% [4–7%]), với một lượng không đáng kể trong các ngăn sục khí quá mức vùng. Hình 4 minh họa sự phân bố tỷ lệ khí:thể tích máu ở những bệnh nhân được thở máy xâm nhập và ở những bệnh nhân được hỗ trợ không xâm nhập.
Mối tương quan giữa các thông số lâm sàng và DECT
Bảng 3 minh họa các mối tương quan giữa lâm sàng (D-dimer, protein phản ứng C, độ giãn nở của hệ thống hô hấp và phân tích khí máu) và các thông số DECT. Mức độ D-dimer có tương quan với sự mất sục khí, sự không phù hợp về khí:thể tích máu và mức độ của các vùng không được tưới máu.
Bảng 3 Mối tương quan giữa các thông số chụp cắt lớp vi tính năng lượng kép và lâm sàng
| Dual-energy computed tomography parameters | D-dimer
C-reactive protein |
Respiratory
system compliance§ |
PaO2/FiO2 | PaCO2 | Ventilatory Ratio§ | |||||||
| ρ | p | ρ | p | ρ | p | ρ | p | ρ | p | ρ | p | |
| Normally
aerated lung tissue (%) |
– 0.403 | 0.016* | – 0.488 | 0.003* | 0.284 | 0.189 | 0.730 | < 0.001* | 0.483 | 0.003* | – 0.351 | 0.101 |
| Poorly aerated lung tissue (%) | 0.343 | 0.044* | 0.236 | 0.172 | – 0.144 | 0.511 | – 0.342 | 0.044* | – 0.221 | 0.201 | 0.407 | 0.054 |
| Non-aerated lung tissue (%) | 0.379 | 0.025* | 0.575 | < 0.001* | – 0.280 | 0.196 | – 0.637 | < 0.001* | – 0.383 | 0.023* | 0.108 | 0.625 |
| Non-perfused lung tissue (%) | 0.418 | 0.012* | 0.061 | 0.730 | – 0.071 | 0.747 | – 0.12 | 0.491 | 0.385 | 0.023* | 0.432 | 0.040* |
| Shunt lung tissue (%) | 0.186 | 0.285 | 0.486 | 0.003* | – 0.105 | 0.634 | – 0.579 | < 0.001* | 0.261 | 0.130 | – 0.149 | 0.497 |
| Lung tissue with gas:blood
volume ratio < 1 (%) |
– 0.418 | 0.012* | – 0.557 | 0.001* | 0.422 | 0.045* | 0.481 | 0.003* | – 0.441 | 0.008* | 0.067 | 0.761 |
| Lung tissue with gas:blood volume ratio > 1
(%) |
– 0.285 | 0.097 | – 0.169 | 0.333 | – 0.166 | 0.449 | 0.471 | 0.004* | – 0.227 | 0.190 | – 0.116 | 0.599 |
| Dead-space lung tissue (%) | 0.101 | 0.565 | – 0.351 | 0.039* | 0.165 | 0.451 | 0.289 | 0.092 | 0.070 | 0.690 | 0.205 | 0.349 |
| Non-aerated, non-perfused lung tissue (%) | 0.513 | 0.002* | 0.531 | 0.001* | – 0.212 | 0.332 | – 0.439 | 0.008* | 0.497 | 0.002* | 0.368 | 0.084 |
| Lung tissue with gas:blood volume mismatch (%) | 0.440 | 0.008* | 0.481 | 0.003* | – 0.138 | 0.529 | – 0.633 | < 0.001* | 0.440 | 0.008* | 0.163 | 0.457 |
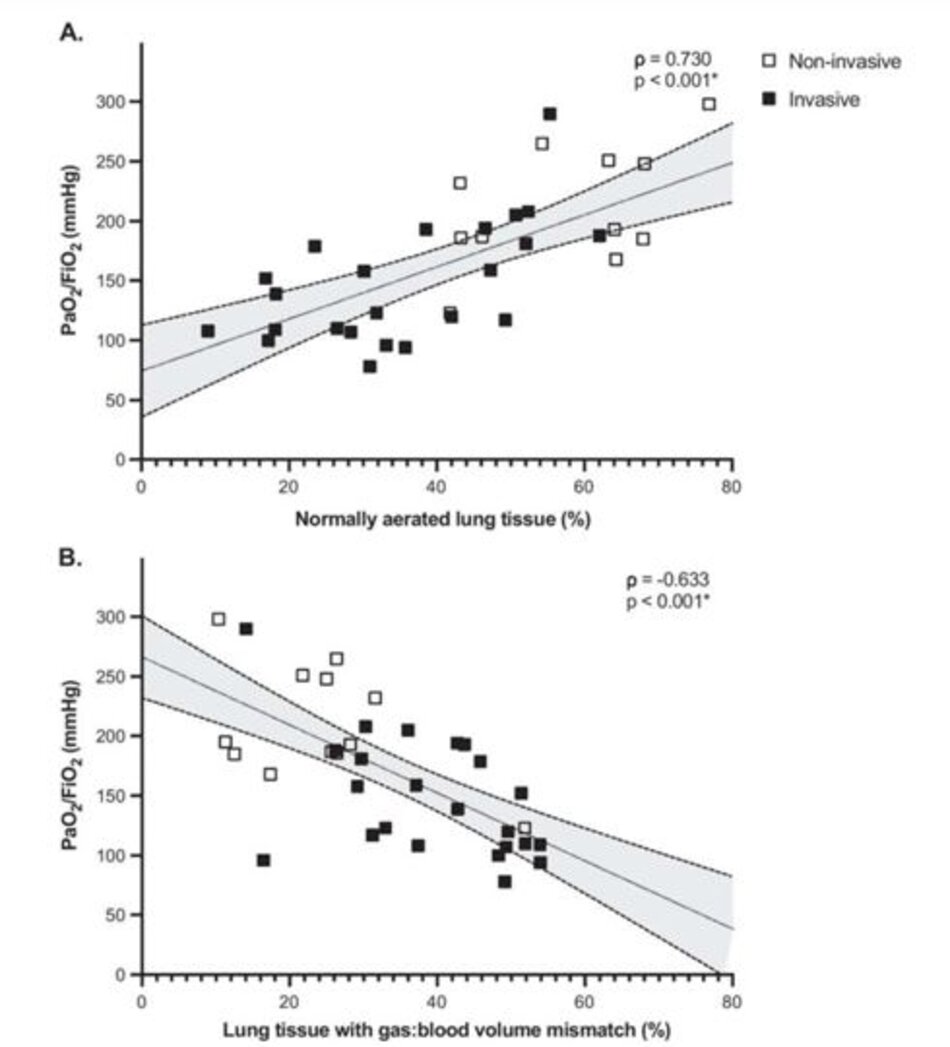
Mức protein phản ứng C tương quan với mất sục khí và không phù hợp khí:thể tích máu. PaO2/FiO2 tương quan thuận với mức độ của mô được sục khí bình thường, và tỷ lệ nghịch với mức độ của không phù hợp khí:thể tích máu, ngăn được sục khí kém và không được sục khí (Hình 5). PaCO2 tương quan với mất sục khí và không phù hợp khí:thể tích máu, trong khi tỷ lệ thông khí với tổng lượng nhu mô phổi không được tưới máu (Bảng 3). Lượng PBV được phát hiện trong các khu vực không được sục khí, được biểu thị bằng phần trăm của tổng PBV trong phổi, không tương quan với mức PEEP (ρ = – 0,107, p = 0,539) cũng như với áp suất đẩy (ρ = 0,048, p = 0,829). Trong phân tích độ nhạy dựa trên mô hình hồi quy tuyến tính sử dụng kiểu hỗ trợ hô hấp và ngăn thông khí-tưới máu làm hiệp biến, shunt là biến số duy nhất có liên quan độc lập với tỷ lệ PaO2/FiO2 (Tập tin bổ sung 1: Bảng S1).
Thảo luận
Trong nghiên cứu này, chúng tôi đã tiến hành một cuộc điều tra định lượng về sự phân bố khí phổi và thể tích máu ở phổi ở những bệnh nhân nặng bị viêm phổi COVID-19 nặng. Chúng tôi nhận thấy rằng: (1) tỷ lệ phần trăm mô được sục khí bình thường thấp hơn, trong khi mức độ không phù hợp khí:thể tích máu ở bệnh nhân được thông khí xâm nhập cao hơn so với bệnh nhân được thông khí không xâm nhập; (2) mô kém sục khí được đặc trưng bởi tỷ lệ thể tích máu: cao hoặc thấp; (3) thể tích mô phổi không được sục khí chủ yếu được tưới máu, chỉ một phần nhỏ không được tưới máu; và (4) tỷ lệ PaO2/FiO2 tương quan với mô phổi được sục khí bình thường và với mức độ không phù hợp của khí:thể tích máu.
Đây là nghiên cứu đầu tiên đánh giá định lượng các phát hiện DECT trong viêm phổi COVID-19 nặng, với các mức độ lâm sàng khác nhau, thể hiện qua loại hình hỗ trợ hô hấp (hỗ trợ hô hấp không xâm nhập và xâm nhập). Tại trung tâm của chúng tôi, DECT đã được thực hiện thường quy ở một tỷ lệ cao bệnh nhân viêm phổi COVID-19 vì mục đích lâm sàng. Các phát hiện phóng xạ được phân tích theo mức độ hỗ trợ hô hấp được yêu cầu, cũng như tương quan với các thông số sinh lý, sinh học và lâm sàng chính. Tất cả các bệnh nhân trong nghiên cứu này đều bị giảm oxy máu nghiêm trọng và được nhập viện ICU, nơi họ được hỗ trợ hô hấp không xâm nhập hoặc xâm nhập. Trong các bệnh phổi khác, DECT tăng cường cản quang đã được sử dụng để định lượng thể tích máu, tỷ lệ phần trăm thiếu tưới máu, và các thành phần khác nhau của thông khí phổi và khối lượng mô [18, 24, 25].
Bệnh nhân COVID-19 được thở máy xâm nhập dựa trên chỉ định lâm sàng, so với những bệnh nhân được hỗ trợ hô hấp không xâm nhập, cho thấy giảm thể tích phổi và thể tích khí và tăng diện tích mô phổi kém sục khí và không sục khí. Hơn nữa, những bệnh nhân được thở máy xâm nhập có mức độ lớn hơn của mô phổi shunt và vùng phổi không được sục khí/không được tưới máu lớn hơn nhưng ít mô hơn với tỷ lệ khí:thể tích máu thấp hơn so với những người được hỗ trợ hô hấp không xâm nhập. Các khu vực không được sục khí chủ yếu được tưới máu, với một tỷ lệ nhỏ không được tưới máu. Điều này tương thích với sự suy giảm co mạch do thiếu oxy [8]. Mặt khác, các khu vực được sục khí kém, tương ứng với các độ mờ của kính, có thể hoạt động như khoảng chết, tương thích với sự co mạch và/hoặc vi huyết khối do thiếu oxy, hoặc như các khu vực có tỷ lệ khí:thể tích máu thấp, do đó cho thấy mất một phần sục khí với tăng tưới máu tương đối do co mạch không đủ hoặc thiếu oxy. Một hiện tượng tương tự gần đây đã được giả thuyết trong một mô hình tính toán [14]. Sự đóng góp của các khu vực kém sục khí trong việc xác định suy giảm trao đổi khí có thể giải thích tại sao tình trạng thiếu oxy trong COVID-19 có thể không liên quan đến những thay đổi về độ giãn nở hô hấp, như xảy ra trong ARDS thông thường [10].
Viêm phổi COVID-19 được đặc trưng bởi sự xấu đi dần dần của hình thái phổi, ảnh hưởng đến cả ngăn được sục khí và ngăn kém/không được sục khí. Tăng trọng lượng phổi có khả năng được giải thích là do tăng phù nề, thâm nhiễm tế bào, đông đặc phế nang, hoặc sự kết hợp của chúng. Theo một nghiên cứu gần đây [27], phù nề có thể có vai trò ít quan trọng hơn trong việc xác định tăng trọng lượng phổi so với thâm nhiễm phế nang và viêm niêm mạc, ly giải mạch máu phổi và xơ hóa. Điều này phù hợp với những phát hiện của một nghiên cứu trước đây cho thấy rằng mức PEEP cao hơn ở bệnh nhân COVID-19 không dẫn đến sự huy động phế nang [12], như dự kiến trong trường hợp tăng phù và hình thành xẹp phổi [28]. Do đó, việc huy động hạn chế và các ảnh hưởng phức tạp đối với sự kết hợp giữa thông khí và tưới máu nên được tính đến khi chuẩn độ PEEP ở bệnh nhân COVID-19.
Sự phù hợp về thông khí và thể tích máu bị ảnh hưởng nghiêm trọng, và các khu vực của shunt, khoảng chết, và không thông khí/không tưới máu cùng tồn tại. PaO2/FiO2 tương quan thuận với mức độ mô được thông khí bình thường và tỷ lệ nghịch với mức độ không phù hợp khí:thể tích máu, và có liên quan độc lập với shunt. Chúng tôi đưa ra giả thuyết rằng tình trạng giảm oxy máu trong viêm phổi COVID-19 có thể được giải thích bằng shunt do thể tích máu ở mô phổi không được thông khí cao hơn và thể tích máu phân bố cao hơn ở mô bình thường và kém thông khí, gây ra giảm tổng thể tỷ lệ khí:thể tích máu. Mặt khác, tỷ lệ giảm tưới máu cao hơn ở những vùng không có sục khí (tương thích với tình trạng co mạch do thiếu oxy, chèn ép các mao mạch và/hoặc vi huyết khối ở các mạch ngoại vi [29,30,31]) có thể hạn chế mức độ nghiêm trọng của tình trạng thiếu oxy. Tuy nhiên, khi số lượng các khu vực không được sử dụng vượt quá một ngưỡng nhất định, điều này có thể dẫn đến chuyển hướng dòng máu đến các khu vực phổi bị thương, góp phần làm trầm trọng thêm quá trình oxygen hóa. Sự phân bố thông khí ở những bệnh nhân COVID-19 nặng tương tự như được quan sát thấy trong ARDS, trong khi sự phân bố thể tích máu tuân theo một mô hình hấp dẫn ngược – cụ thể là lượng máu cao hơn ở các vùng phổi được thông khí. Do đó, sự phân bố thể tích máu này khác với sự phân bố ở những người khỏe mạnh và những người không mắc ARDS [32, 33]. Điều này có thể được giải thích là do sự hiện diện của các vùng lớn không được tưới máu ảnh hưởng chủ yếu đến vùng phổi giữa và phổi. Vì ROI được xác định dựa trên trọng lượng phổi, nên số lượng tương đối của PBV trong mỗi ROI ở bụng-lưng phản ánh lượng máu trên một đơn vị trọng lượng mô phổi. Hơn nữa, các mạch máu đã được loại trừ khỏi phân đoạn, do đó các phép đo PBV phản ánh lượng máu trong nhu mô phổi, loại trừ lượng máu trong các mạch máu không tham gia trao đổi khí. Các cơ chế sinh lý bệnh của việc giảm PBV ở lưng có thể bao gồm co mạch do thiếu oxy, chèn ép cơ học các mao mạch và huyết khối (vi mô). Mất sục khí và không phù hợp khí:thể tích máu có liên quan đến mức độ cao hơn của dấu hiệu viêm và tăng D-dimer, trong khi các vùng không được tưới máu tương quan với tăng D-dimer và tăng PaCO2. Những bệnh nhân mắc bệnh ít nghiêm trọng hơn có lượng mô phổi lớn hơn với tỷ lệ khí:thể tích máu thấp nhưng ít shunt hơn, có thể xác nhận giả thuyết về các kiểu hình khác nhau của COVID-19 được đề xuất trong giai đoạn đầu của đại dịch [7,8,9].
Một số hạn chế trong nghiên cứu của chúng tôi cần được giải quyết. Chỉ những bệnh nhân ổn định có chỉ định lâm sàng cho DECT mới được đưa vào nghiên cứu này, điều này có thể dẫn đến sai lệch lựa chọn và dẫn đến kích thước mẫu nhỏ. DECT không trực tiếp phát hiện sự tưới máu, mà là lượng tương đối của nồng độ iốt và do đó, thể tích máu trong khu vực. Tuy nhiên, nó đã được xác nhận là chất thay thế được chấp nhận cho lưu lượng máu vùng trong ARDS [18, 24]. Các phân tích chính tập trung vào các ngăn được xác định dựa trên sự hiện diện hay không có của máu phổi: những vùng có thể tích máu không được DECT phát hiện tương ứng với những vùng mà sự tưới máu không đáng kể hoặc không có. Việc nằm sấp được thực hiện ở 7 trong số 23 bệnh nhân được đặt nội khí quản và có lẽ không ảnh hưởng đến kết quả cuối cùng, vì DECT luôn được thực hiện ở tư thế nằm ngửa và không bao giờ nằm ngay sau khi nằm sấp.
Kết luận
Ở những bệnh nhân nặng bị viêm phổi COVID-19 nặng, mất thông khí và không phù hợp khí:thể tích máu cao hơn ở những bệnh nhân cần thở máy xâm nhập so với những bệnh nhân được hỗ trợ hô hấp không xâm nhập. Mức độ nghiêm trọng của tình trạng giảm oxy máu được giải thích bởi mức độ mất sục khí và không phù hợp khí:thể tích máu.
Xem thêm: