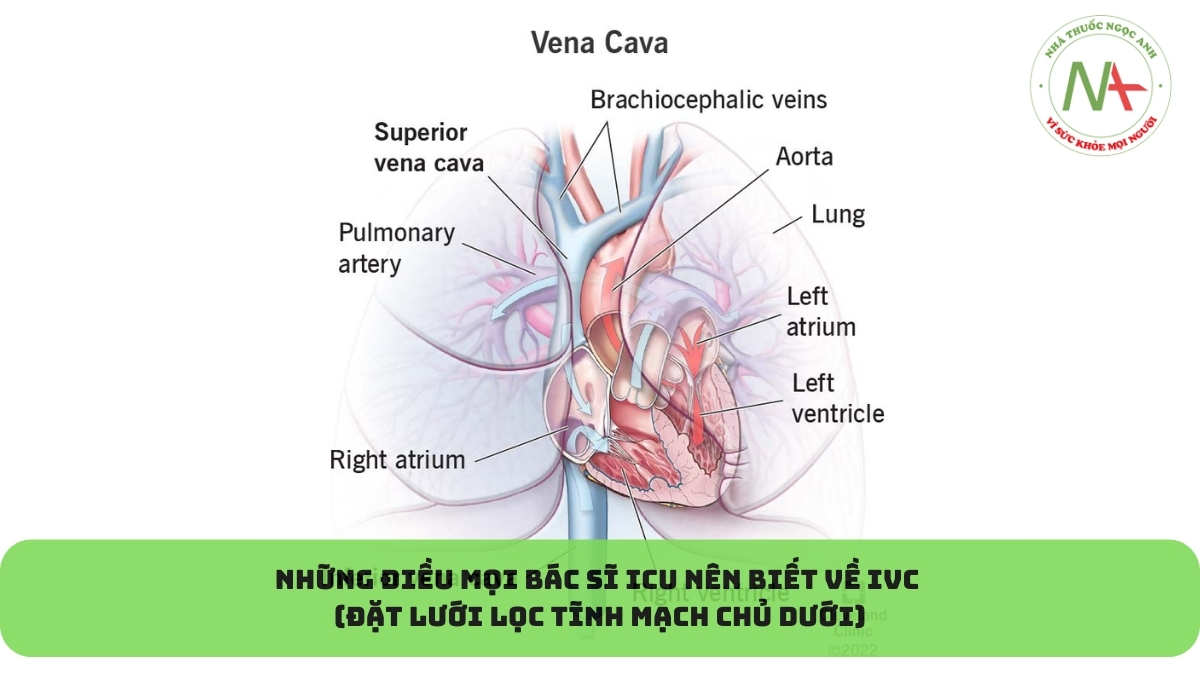
Kỹ thuật y khoa
Những điều mọi bác sĩ ICU nên biết về IVC (Đặt lưới lọc tĩnh mạch chủ dưới)
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Những điều mọi bác sĩ ICU nên biết về IVC (Đặt lưới lọc tĩnh mạch chủ dưới) – tải pdf tại đây.
Bản dịch của Thạc sĩ. Bác sĩ Hồ Hoàng Kim.
Tóm tắt
Đánh giá IVC bằng siêu âm tại chỗ trong bối cảnh hồi sức là một chủ đề gây tranh cãi trong những thập kỷ qua. Hầu hết trọng tâm đều tập trung vào việc sử dụng nó như một dấu hiệu thay thế cho khả năng đáp ứng với dịch truyền, với kết quả không rõ ràng. Chúng tôi xem xét các khía cạnh giải phẫu quan trọng của nó cũng như cơ sở sinh lý cơ bản đằng sau việc đánh giá siêu âm và đề xuất một cách mới để làm điều đó, cũng như giải thích vai trò trung tâm của nó trong khái niệm dung nạp dịch truyền.
Giới thiệu
Với việc áp dụng dần dần Siêu âm điểm chăm sóc (POCUS) trong hai thập kỷ qua, tĩnh mạch chủ dưới đã duy trì vị trí của mình như một công cụ gây tranh cãi để đánh giá tình trạng thể tích ở bệnh nhân nguy kịch. Ban đầu được thúc đẩy bởi các nghiên cứu đầy hứa hẹn cho thấy vai trò trong việc đánh giá khả năng đáp ứng thể tích bằng cách sử dụng tĩnh mạch chủ trên, một loạt nghiên cứu sử dụng sự biến đổi hô hấp đã được thực hiện, với kết quả không rõ ràng và ít bác sĩ lâm sàng nhiệt tình sử dụng nó hơn [1,2]. Gần đây hơn, trọng tâm đã bắt đầu chuyển sang đánh giá sự sung huyết tĩnh mạch và khái niệm quan trọng về dung nạp dịch, thúc đẩy sự quan tâm trở lại đối với IVC.
Điều quan trọng là phải hiểu rằng đặc tính của IVC, theo vị trí giải phẫu của nó là đường vận chuyển cuối cùng của tĩnh mạch (phần dưới cơ thể) trở về tâm nhĩ phải, phản ánh sự tương tác giữa áp lực nén bên ngoài của vùng bụng xung quanh sẽ có xu hướng làm xẹp IVC, và áp suất căng bên trong IVC giữ cho nó luôn mở. Trong khi lực nén bên ngoài tương đối tĩnh thì áp lực bên trong của IVC rất động và là kết quả của sự kết hợp của các yếu tố thúc đẩy hồi lưu tĩnh mạch trở về tim, chức năng tim phải và áp lực trong lồng ngực so với áp lực trong ổ bụng. Tĩnh mạch hồi lưu trở về tim được điều khiển bởi áp lực đổ đầy hệ thống trung bình (Pmsf), được tạo ra bởi sự co giãn đàn hồi của mạch máu tĩnh mạch và bị cản trở bởi áp lực tĩnh mạch trung tâm (CVP), tăng lên khi tâm thất phải trở nên quá tải. Điều quan trọng cần lưu ý là sự phản ánh này cũng bao gồm sự tương tác theo thời gian, vì cấu trúc tĩnh mạch thích ứng với những thay đổi mãn tính về dòng chảy, áp suất hoặc cả hai.
=> Đọc thêm: KỸ THUẬT VÀ VỊ TRÍ TIÊM BOTULINUM TOXIN.
IVC và “tình trạng thể tích máu”
Những yếu tố này khiến mục tiêu sử dụng IVC làm thước đo nhiên liệu đơn giản để đo mức đổ đầy của hệ thống có giá trị rất đáng ngờ. Ví dụ, một bệnh nhân có thể tích nội mạch bình thường bị giãn mạch có thể có IVC rất nhỏ, vì giãn tĩnh mạch sẽ giảm Pmsf, giảm hồi lưu tĩnh mạch và giãn mạch động mạch sẽ giảm hậu tải và có thể dẫn đến giảm CVP. Cả hai thay đổi (Pmsf và CVP giảm) sẽ làm giảm kích thước của IVC – không có thay đổi về lượng máu. Ngược lại, một bệnh nhân mắc bệnh lý tắc nghẽn tăng CVP sẽ tăng kích thước IVC mà không làm thay đổi tổng lượng máu.
IVC và đáp ứng dịch truyền
Tăng cung lượng tim là thông số ban đầu thu hút IVC POCUS và phản ánh trọng tâm chủ yếu trong những thập kỷ qua về dòng chảy xuôi của các bác sĩ hồi sức, những người chủ yếu sử dụng chiến lược đáp ứng dịch, bao gồm tìm cách xác định những bệnh nhân có cung lượng tim sẽ tăng khi dịch truyền, và quản lý nó cho đến khi huyết động được điều chỉnh hoặc ngừng đáp ứng. Không có gì đáng ngạc nhiên, IVC không tốt hơn CVP trong việc dự đoán khả năng đáp ứng bù dịch, và một khi điều này trở nên rõ ràng, sau một số nghiên cứu, kết luận về IVC như một công cụ hồi sức không đáng tin cậy [2]. Thật không may, điều này hơi giống với việc ném em bé ra ngoài bằng nước tắm, đặc biệt vì nó đã được xác định rõ ràng vào những năm 80 và 90 rằng tối đa hóa cung lượng tim như một cách để cung cấp lượng oxy toàn thân bất thường nói chung là một chiến lược có hại [3]. Thật vậy, sinh lý học được tìm thấy trên phần phẳng của đường cong Frank-Starling hoàn toàn là một sinh lý bệnh lý.
IVC và dung nạp dịch truyền
Gần đây, một tuyên bố quan điểm đã được đưa ra về khái niệm dung nạp dịch, nhằm cố gắng thu hút sự chú ý đến những gì có thể là một cách tiếp cận sinh lý và cá nhân hóa hơn để hồi sức và xuống thang hồi sức [6]. Dung nạp dịch đề cập đến khả năng bệnh nhân có thể nhận được lượng dịch mà không phải chịu các tác dụng phụ của nó. Đây là một khái niệm khác biệt và thường trùng lặp với khả năng đáp ứng dịch thay vì không dung nạp chỉ bắt đầu khi khả năng đáp ứng kết thúc. (Hình 1).
![Những điều mọi bác sĩ ICU nên biết về IVC (Đặt lưới lọc tĩnh mạch chủ dưới) 10 Hình 1. Mối quan hệ giữa dung nạp dịch và khả năng đáp ứng dịch trong quá trình hồi sức. Được sao chép với sự cho phép từ [6].](https://nhathuocngocanh.com/wp-content/uploads/2023/12/Nhung-dieu-moi-bac-si-ICU-nen-biet-ve-IVC.jpg)
IVC trong các tình huống lâm sàng cụ thể
Điều quan trọng cần nhấn mạnh là trong một số trường hợp nhất định, sinh lý bệnh sẽ gây ra IVC sunh huyết, và trên thực tế, nếu không có IVC đó, về cơ bản có thể loại trừ những nguyên nhân này là cơ chế chính gây mất ổn định huyết động. Hai trong ba tình huống này về cơ bản giống nhau, gây sốc tắc nghẽn: chèn ép tim và tràn khí màng phổi có áp lực. Trong cả hai trường hợp này, sốc xảy ra khi áp lực trong màng ngoài tim và trong lồng ngực lần lượt vượt quá áp lực nhĩ phải và hạn chế sự hồi lưu của tĩnh mạch. Đây là những trường hợp lâm sàng duy nhất – ít nhất là tạm thời cho đến khi đạt được sự giảm áp hoàn toàn – dịch truyền được chỉ định khi có IVC đầy đủ. Người ta nên phân biệt chèn ép tim thông thường do tràn dịch theo chu vi với chèn ép tim cục bộ vì có thể xảy ra sau phẫu thuật tim và có thể không dẫn đến chèn ép tâm nhĩ phải và do đó có thể không gây ra IVC căng sung huyết (ví dụ như cục máu đông chèn ép tâm nhĩ trái).
Tình huống thứ ba là thuyên tắc phổi diện rộng – massive là nguyên nhân duy nhất gây sốc. Mặc dù việc không có IVC căng sung huyết không loại trừ được chẩn đoán đó, nhưng sự vắng mặt của nó chỉ ra một cơ chế khác cũng góp phần gây sốc như nhiễm trùng huyết hoặc giảm thể tích.
Do đó, việc phát hiện IVC căng sung sẽ nhắc nhở bác sĩ lâm sàng loại trừ sớm các tình trạng đe dọa tính mạng này trong đánh giá lâm sàng, đặc biệt vì chúng có các liệu pháp cụ thể và hiệu quả.
Giải phẫu IVC & Sinh lý học của sự biến đổi IVC
Khi giải thích IVC, bác sĩ lâm sàng hiểu biết sẽ phải tính đến một số yếu tố giải phẫu, sinh lý và thậm chí cả toán học.
A. Biến đổi hô hấp: Một thông số đo lường quan trọng đáng xem xét. Với nhịp thở tự nhiên, thì hít vào làm giảm áp lực trong lồng ngực và CVP, do đó làm tăng chênh lệch áp suất giữa hạ lưu tâm nhĩ phải và áp lực ngược dòng trong ổ bụng và Pmsf. Điều này sẽ làm tăng lưu lượng tĩnh mạch từ IVC vào tim và IVC sẽ xẹp xuống khi áp lực bên trong của IVC giảm so với áp lực bên ngoài ổ bụng. Quá trình này được đảo ngược khi thở ra tự nhiên và IVC sau đó giãn ra. Ở những bệnh nhân thở máy (không có nỗ lực hô hấp tự phát), việc cung cấp hơi thở làm tăng áp lực trong lồng ngực và giảm độ chênh áp lực giữa ngực, bụng và Pmfs, do đó làm căng IVC khi máu tĩnh mạch trở về giảm và áp lực bên trong IVC tăng so với áp lực bên ngoài. Việc giải phóng hơi thở được cung cấp sẽ khôi phục lại sự chênh lệch cơ bản về áp lực ổ bụng và lồng ngực, lưu lượng máu đến tim tăng lên và IVC xẹp xuống. Tất nhiên, bệnh nhân cũng có thể tăng hoặc giảm áp lực trong ổ bụng bằng nhiều cách khác nhau và điều này cũng sẽ ảnh hưởng đến sự xẹp hoặc giãn của IVC. Cuối cùng, phải hiểu rằng mức độ nỗ lực hô hấp hoặc áp lực do máy thở cung cấp cũng như sự tương tác giữa bệnh nhân và máy thở sẽ ảnh hưởng đến khả năng hồi lưu tĩnh mạch và khả năng xẹp của IVC. Do đó, các chỉ số “Điểm cắt” mang tính giáo điều về tình trạng xejp theo hô hấp của IVC để dự đoán đáp ứng đối với thách thức về thể tích là không rõ ràng. Về cơ bản, sức mạnh tổng hợp của nhiều yếu tố, bị ảnh hưởng bởi tác động tương đối của chúng đối với sự hồi lưu của tĩnh mạch, xuất phát từ “hồ chứa” IVC phải được xem xét cùng với việc giải thích IVC.
B. Trục ngắn so với trục dài: người ta phải nhận ra rằng, trong hầu hết các trường hợp, IVC không hoạt động như một hình trụ trong hầu hết phạm vi CVP của nó. Thay vào đó, nếu nhìn vào trục ngắn của nó, trên thực tế nó có hình elip, ngoại trừ ở mức CVP cao, nơi nó trở nên tròn hơn với tỷ lệ đường kính ngắn và đường kính dài tiến gần đến 1, như minh họa trong Hình 2 [4]. Do đó, việc đánh giá nó chỉ theo trục dài sẽ bộc lộ một số hạn chế, không có bất kỳ lợi thế nào ngoại trừ khả năng tái đánh giá và tính thực tế, vốn không phải là yếu tố chăm sóc bệnh nhân. Điều quan trọng cần lưu ý là, ở các IVC hình elip hơn, sự biến đổi hô hấp thường xảy ra ở đường kính ngắn. Như sẽ được giải thích dưới đây, điều này có thể dẫn đến một nguồn hiểu sai đáng kể.
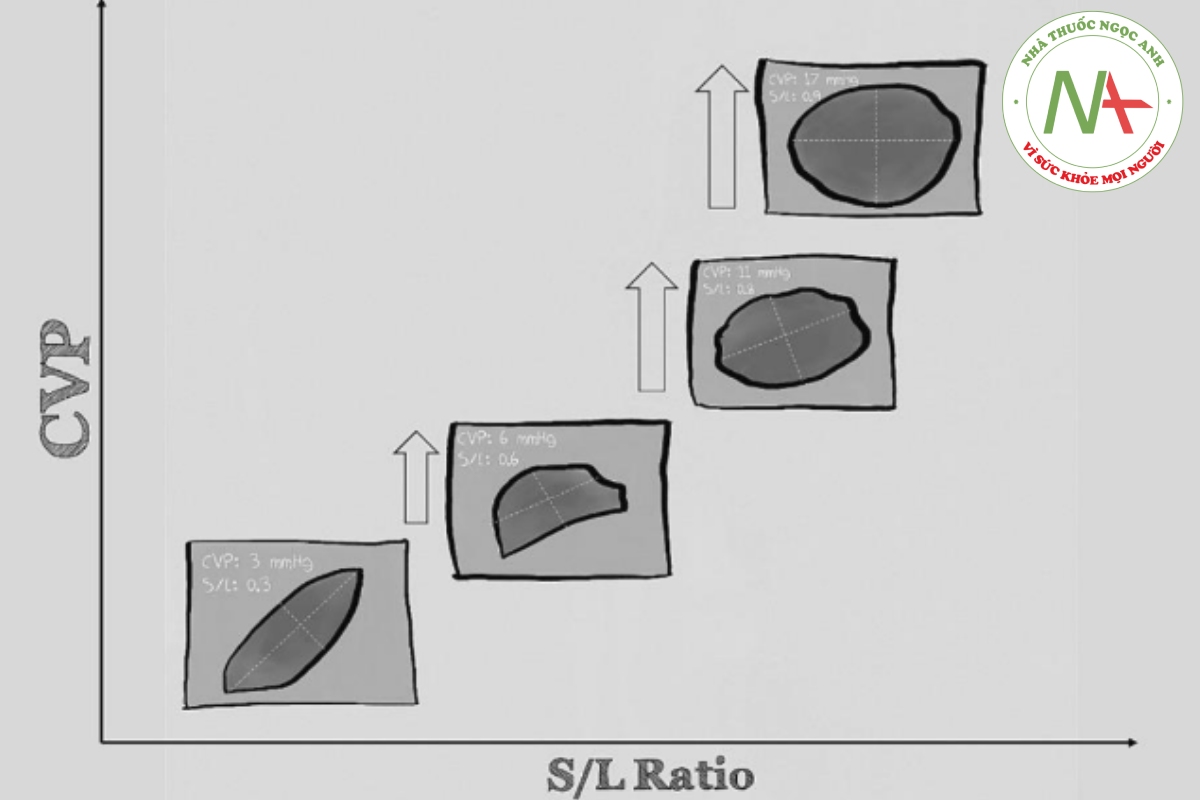
C. Độ nghiêng hình elip: Ngoài ra, nếu chúng ta nhìn IVC trong mặt phẳng ngang, góc hoặc “độ nghiêng” của hình elip, đáng chú ý ở CVP bình thường/thấp, thay đổi rất nhiều, nhưng nhìn chung là xiên. Do đó, việc sử dụng phép đo đường kính trước- sau như được thực hiện theo truyền thống, thường thể hiện một đường cắt chéo có góc thay đổi trên hình elip mà không đo đường kính dài hay đường kính ngắn. Có lẽ, khi phương pháp đo đường kính trục dài bắt đầu, người ta hy vọng rằng IVC trên thực tế là hình trụ, làm cho việc đo bất kỳ đường kính nào trở thành một đại diện thay thế đáng tin cậy cho thể tích. Độ nghiêng này, nếu đường kính dài của hình elip gần trục trước-sau, có thể gây nhầm lẫn cho bác sĩ lâm sàng khi chỉ sử dụng chế độ xem trục dài dưới xương ức, tạo ra IVC “căng phồng” với rất ít biến đổi, trong khi trên thực tế nó có thể khá khác biệt “nhỏ” hoặc đại diện cho CVP thấp hơn.
D. Đường trục dài: phần đầu của IVC, gần cơ hoành nhất, vẫn “mở” trong một số trường hợp trong khi IVC ở xa trở nên khá nhỏ, tạo ra hình nêm trên trục dài. Do đó, phương pháp truyền thống đo khoảng 2 cm dưới cơ hoành có thể gây hiểu nhầm vì nó có thể hiển thị đường kính “lớn” với ít thay đổi, tương đương với IVC căng đều trong khi hai IVC đó không thực sự tương đương về áp lực tĩnh mạch/tắc nghẽn. (Hình 3)
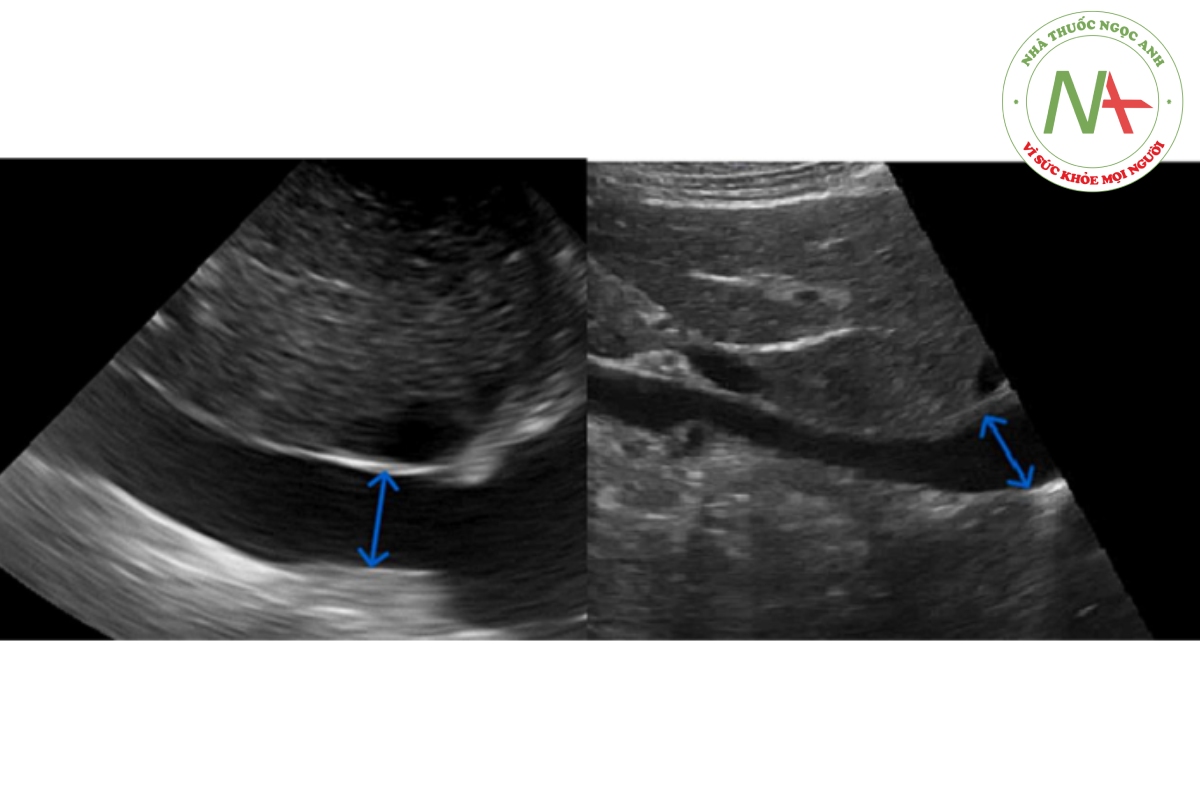
Việc hiểu tất cả những điều trên ngay lập tức đặt ra câu hỏi về giá trị toán học của việc sử dụng đường kính một điểm của cấu trúc không hình trụ – trên hết là không bao gồm độ lớn của thay đổi ITP – để đánh giá biến thiên thể tích. Có vẻ như phép đo IVC phù hợp nhất về mặt toán học và sinh lý sẽ là quét trục ngắn trên toàn bộ phân đoạn trong gan, hơi giống với việc “eyeballing” tâm thất trái để xác định phân suất tống máu, đồng thời cũng tính đến sự dao động của áp suất màng phổi (được gọi là chỉ số biến đổi nỗ lực – Hình 4) và đánh giá áp lực trong ổ bụng [5].
![Những điều mọi bác sĩ ICU nên biết về IVC (Đặt lưới lọc tĩnh mạch chủ dưới) 13 Hình 4. Cấu trúc lý thuyết để hiểu mối quan hệ giữa sự biến đổi IVC và nỗ lực hô hấp. Trên bất kỳ trục hoành nào, sự thay đổi là giống hệt nhau và có thể xảy ra với các trạng thái đổ đầy khác nhau, với sự dao động đủ lớn của áp lực khoang màng phổi [7].](https://nhathuocngocanh.com/wp-content/uploads/2023/12/Nhung-dieu-moi-bac-si-ICU-nen-biet-ve-IVC-3.jpg)
IVC ở bệnh nhân rối loạn chức năng RV mạn tính
Khi phải đối mặt với áp lực nhĩ phải tăng cao mãn tính, IVC sẽ giãn ra theo thời gian, do đó kích thước “thông thường” hoặc đường cơ sở sẽ tăng lên đáng kể. Chúng tôi đã ghi nhận một số IVC có đường kính trên 30 mm. Đương nhiên, trong những trường hợp này, IVC đo 25 mm trên một trục trên thực tế có thể biểu thị RAP thấp hơn mức cơ bản của bệnh nhân, nhưng nếu IVC được kiểm tra bằng SAX, nó có thể sẽ không thực sự sung huyết và ‘từ ngắn đến dài’ tỷ lệ đường kính có thể sẽ không ở mức gần 1. Điều này có thể khiến điểm VExUS – nếu được đo – tăng sai lệch, bởi vì theo tiêu chí LAX, nó sẽ là VExUS 1, trong khi về mặt sinh lý sẽ giống với VExUS 0 hơn. Điều này đang được thực hiện được xác nhận trong các nghiên cứu đang diễn ra, nhưng gợi ý rằng các bác sĩ lâm sàng nên đánh giá chỉ số sung huyết, đặc biệt ở các trạng thái tăng RAP mạn tính – như đã giải thích ở trên – thay vì chỉ một đường kính. Do đó, IVC nên được hiểu song song với “môi trường xung quanh” của nó, đặc biệt là RA/RV.
IVC ở vận động viên
Một sự thích ứng tương tự được thấy ở các vận động viên trình độ cao, nơi hệ thống tĩnh mạch thích nghi với lưu lượng tăng cao mãn tính cũng như có khả năng tăng RAP [10,11]. Chúng tôi cũng đã thấy điều này trong thực hành lâm sàng. Mặc dù điều này có thể rõ ràng ở một bệnh nhân trẻ tuổi, nhưng có thể cần phải thêm điều này vào bệnh sử lâm sàng vì các kết quả về huyết động có thể tồn tại rất lâu sau khi cá nhân đó ngừng tích cực luyện tập môn thể thao của mình với cường độ và đều đặn.
Kết luận
Có vẻ như đáng để cứu em bé và chỉ loại bỏ các lỗi giống như nước tắm liên quan đến đánh giá IVC chẳng hạn như (a) cố gắng đổ đầy nước đến miệng (chiến lược đáp ứng với dịch), (b) đo nó bằng một lần duy nhất với đường kính trục dài của điểm và (c) đánh giá sự thay đổi hô hấp của nó mà không tính đến sự thay đổi áp lực trong ổ bụng và áp lực trong lồng ngực.
Tại thời điểm này, dữ liệu hiện có và các nguyên tắc sinh lý hướng chúng ta đến việc sử dụng IVC làm thước đo sung huyết tĩnh mạch và làm điểm dừng dịch, cũng như nhắc nhở thực hiện đánh giá Doppler sâu hơn để phân loại mức độ nghiêm trọng của sung huyết. Mặc dù nó có thể ở mức độ cực đoan nào đó – tương tự như CVP – nhưng có lẽ không nên sử dụng nó như một công cụ đánh giá đáp ứng dịch.
Khi đánh giá những bệnh nhân nguy kịch, các bác sĩ lâm sàng nên cố gắng ghép các câu đố lại với nhau thay vì tìm cách tìm và sử dụng một thước đo duy nhất để đánh giá các vấn đề về dịch. Do đó, việc đánh giá các đặc điểm thượng nguồn, hạ nguồn và xung quanh nên được thực hiện thay vì xem xét IVC một cách riêng biệt.
Hy vọng rằng các nghiên cứu trong tương lai sẽ bao gồm đánh giá IVC thích hợp và cung cấp nhiều dữ liệu hơn để điều chỉnh quá trình hồi sức của chúng tôi hơn nữa. Hiện tại, một số nghiên cứu đang được tiến hành như ANDROMEDA-2, trong đó có một đoàn hệ quan sát tình trạng sung huyết tĩnh mạch và sẽ làm sáng tỏ hơn về tình trạng sung huyết trong hồi sức nhiễm trùng huyết [9]. IVC không bao giờ nói dối và sẽ luôn đại diện cho sự tương tác của tất cả nhiều yếu tố và do đó đại diện cho nền tảng của quản lý dịch truyền. Theo lời của Tiến sĩ Glenn Hernandez, mục tiêu của bác sĩ hồi sức có tư duy sinh lý là duy trì sự gắn kết huyết động, tức là tối ưu hóa tưới máu mà không bị sung huyết. Bác sĩ lâm sàng vẫn phải điều hướng các điểm dữ liệu có sẵn để đạt được điều này và, được đánh giá phù hợp trong bối cảnh, IVC sẽ cung cấp một trong số chúng.
=> Tham khảo: Kỹ thuật lấy máu xét nghiệm bằng phương pháp chân không và qua bơm tiêm.
References
- Vieillard-Baron A, Chergui K, Rabiller A, Peyrouset O, Page B, Beauchet A, et al. Superior vena caval collapsibility as a gauge of volume status in ventilated septic patients. Intensive Care Med 2004 Sep;30(9):1734-9. https://doi.org/10.1007/s00134-004-2361-y. Epub 2004 Jun 26. PMID:15375649.
- Orso D, Paoli I, Piani T, Cilenti FL, Cristiani L, Guglielmo N. Accuracy of ultrasonographic measurements of inferior vena cava to determine fluid responsiveness: a systematic review and meta-analysis. J Intensive Care Med 2020 Apr;35(4):354-63. https://doi.org/10.1177/0885066617752308. Epub 2018 Jan 17. PMID: 29343170.
- Ronco JJ, Fenwick JC, Tweeddale MG. Does increasing oxygen delivery improve outcome in the critically ill? No Crit Care Clin 1996 Jul;12(3):645-59. https://doi. org/10.1016/s0749-0704(05)70268-2. PMID: 8839596.
- Seo Y, Iida N, Yamamoto M, Machino-Ohtsuka T, Ishizu T, Aonuma K. Estimation of central venous pressure using the ratio of short to long diameter from crosssectional images of the inferior vena cava. J Am Soc Echocardiogr 2017 May;30(5): 461-7. https://doi.org/10.1016/j.echo.2016.12.002. Epub 2017 Jan 5. PMID: 28065586.
- Beaubien-Souligny W, Rola P, Haycock K, Bouchard J, Lamarche Y, Spiegel R, et al. Quantifying systemic congestion with Point-Of-Care ultrasound: development of the venous excess ultrasound grading system. Ultrasound J 2020 Apr 9;12(1):16. https://doi.org/10.1186/s13089- 020-00163-w. PMID: 32270297; PMCID: PMC7142196.
- Kattan E, Castro R, Miralles-Aguiar F, Hernandez ‘ G, Rola P. The emerging concept of fluid tolerance: a position paper. J Crit Care 2022 Oct;71: 154070. https://doi.org/10.1016/j.jcrc.2022.154070. Epub 2022 Jun 2. PMID: 35660844.
- Rola P. The Effort-Variation Index, a Conceptual Tool for IVC Ultrasound. www.thinkingcriticalcare.com; April 29, 2014.
- Vellinga NA, Ince C, Boerma EC. Elevated central venous pressure is associated with impairment of microcirculatory blood flow in sepsis: a hypothesis generating post hoc analysis. BMC Anesthesiol 2013 Aug 7;(13):17. https://doi.org/10.1186/1471-2253-13-17. PMID: 23919272; PMCID: PMC3750825.
- Kattan E, Bakker J, Estenssoro E, Ospina-Tascon ‘ GA, Cavalcanti AB, Backer D, et al. Hemodynamic phenotype-based, capillary refill time-targeted resuscitation in early septic shock: the ANDROMEDA-SHOCK-2 Randomized Clinical Trial study protocol. Rev Bras Ter Intensiva 2022 Jan- Mar;34(1):96-106. https://doi.org/10.5935/0103-507X.20220004-pt. PMID: 35766659; PMCID: PMC9345585.
- Goldhammer E, Mesnick N, Abinader EG, Sagiv M. Dilated inferior vena cava: a common echocardiographic finding in highly trained elite athletes. J Am Soc Echocardiogr 1999 Nov;12(11):988-93. https://doi.org/10.1016/s0894-7317(99) 70153-7. PMID: 10552361.
- S0rensen E, Myrstad M, Solberg MG, 0ie E, Tveit A, Aarpn^s M. Right heart structure and function in lifelong recreational endurance athletes with and without paroxysmal atrial fibrillation. J Am Soc Echocardiogr 2022 Dec;35(12):1259-68. https://doi.org/10.1016/j.echo.2022.06.008. Epub 2022 Jun 26. PMID: 35760278.