Bệnh hô hấp, Bệnh tim mạch
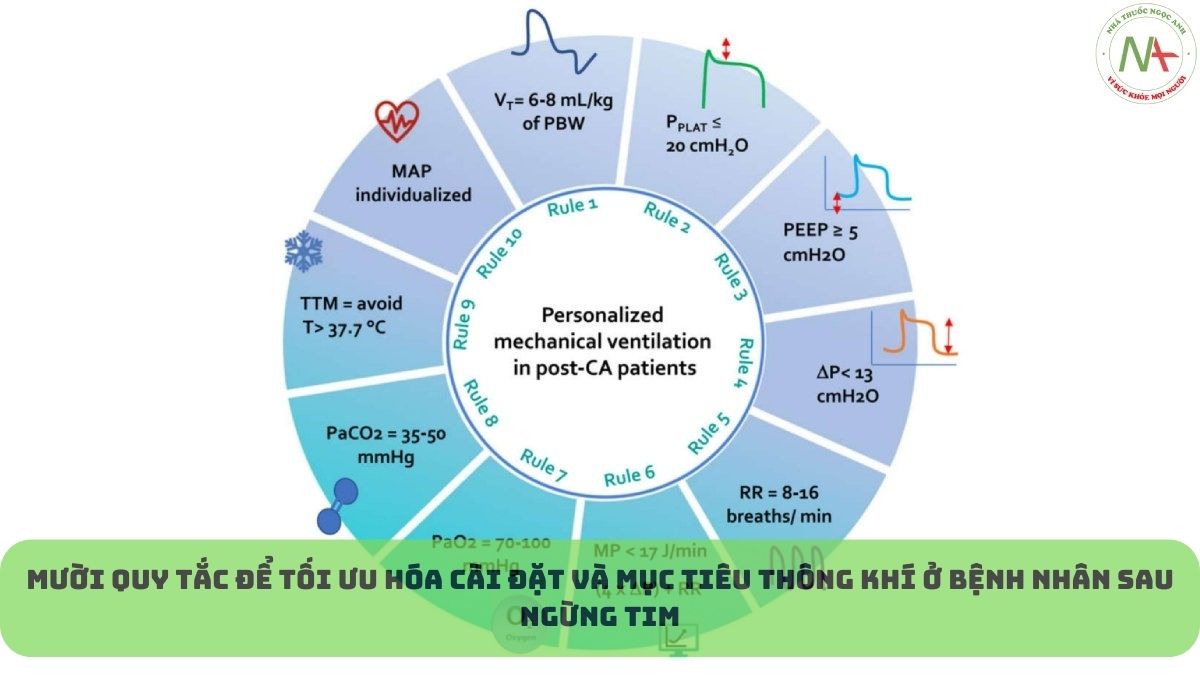
Mười quy tắc để tối ưu hóa cài đặt và mục tiêu thông khí ở bệnh nhân sau ngừng tim
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Mười quy tắc để tối ưu hóa cài đặt và mục tiêu thông khí ở bệnh nhân sau ngừng tim – tải file PDF Tại đây.
Dịch bài: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Ngừng tim (Cardiac arrest − CA) là nguyên nhân chính gây bệnh tật và tử vong thường liên quan đến tổn thương hệ thần kinh và các cơ quan hệ thống. Các chiến lược điều trị hỗ trợ như thở máy, cài đặt huyết động và quản lý nhiệt độ đã được thực hiện trong thập kỷ qua ở bệnh nhân sau CA, nhằm bảo vệ cả não và phổi và ngăn ngừa các biến chứng toàn thân. Chiến lược sử dụng máy thở bảo vệ phổi hiện là tiêu chuẩn chăm sóc cho những bệnh nhân bị bệnh nặng vì nó cho thấy tác dụng có lợi đối với tỷ lệ tử vong, số ngày không sử dụng máy thở và các kết quả lâm sàng khác. Vai trò của cài đặt thở máy bảo vệ và cá nhân hóa ở những bệnh nhân không mắc hội chứng nguy kịch hô hấp cấp tính và sau CA đang trở nên rõ ràng hơn. Ảnh hưởng cá nhân hóa của các thông số khác nhau của thông khí bảo vệ phổi, bao gồm công suất cơ học cũng như các mục tiêu oxy và carbon dioxide tối ưu, đối với kết quả lâm sàng là một vấn đề tranh luận ở bệnh nhân sau CA. Việc quản lý huyết động và nhiệt độ ở bệnh nhân sau CA thể hiện các bước quan trọng để đạt được cải thiện lâm sàng. Mục đích của tổng quan này là tóm tắt và thảo luận về bằng chứng hiện tại về cách tối ưu hóa thở máy ở bệnh nhân sau CA. Chúng tôi sẽ cung cấp mười quy tắc và thông tin chi tiết quan trọng để áp dụng chiến lược máy thở bảo vệ phổi ở bệnh nhân sau CA, xem xét tác động qua lại giữa phổi với các hệ thống và cơ quan khác, bao gồm cả não.
Bối cảnh
Ngừng tim (Cardiac arrest − CA) là nguyên nhân chính gây bệnh tật và tử vong với khả năng cao gây ra các biến chứng bất lợi hệ thống và não [1]. Một số chiến lược điều trị và hỗ trợ đã được thực hiện trong những năm qua để tối ưu hóa kết quả của bệnh nhân sau CA, nhằm cải thiện kết quả thần kinh và khả năng sống sót [2, 3]. Trong số những chiến lược khác nhau, các chiến lược hỗ trợ bao gồm cài đặt thở máy phù hợp, nhằm tối ưu hóa quá trình trao đổi khí và hạn chế tổn thương phổi do máy thở (ventilator-induced lung injury − VILI), đồng thời tránh các biến chứng toàn thân [3]. Thông khí cơ học nên được nhắm mục tiêu để hạn chế tình trạng thiếu oxy và tăng oxy máu và để duy trì mức carbon dioxide bình thường [4-8], đây là những nguyên nhân có thể gây tổn thương não và tái tưới máu thứ phát, tổn thương phổi và khả năng sống sót kém [3,9- 16].
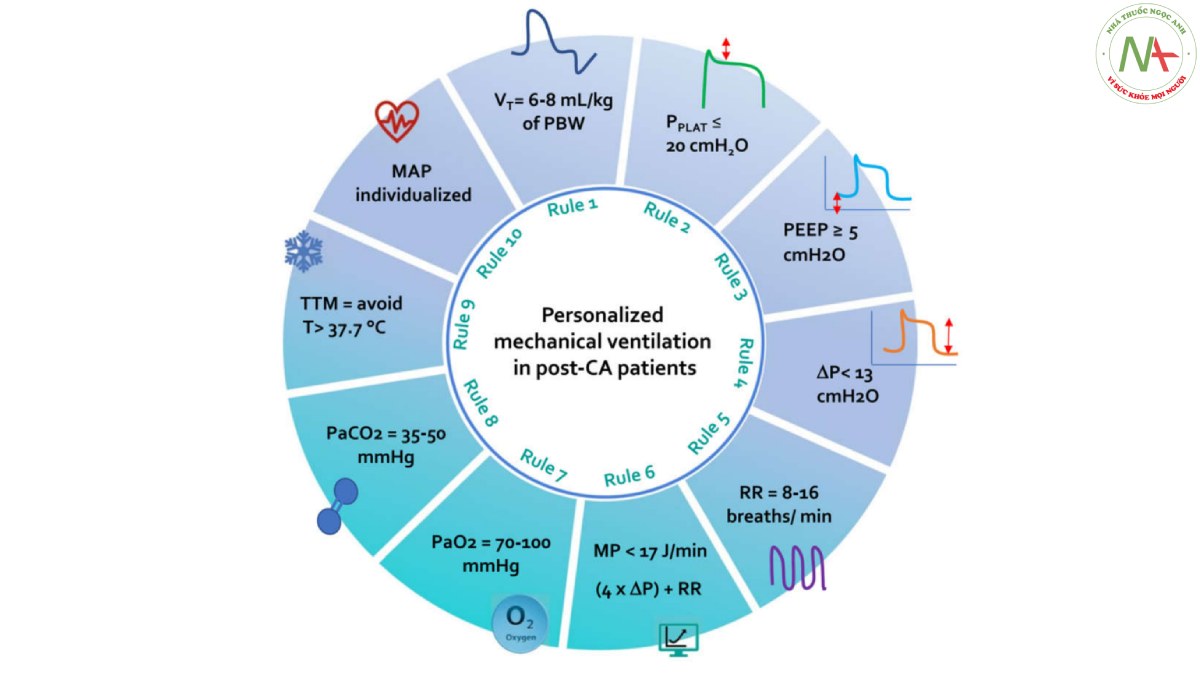
Tài liệu y văn đồng ý về tầm quan trọng của việc sử dụng các chiến lược máy thở bảo vệ phổi ở những bệnh nhân không phải CA (tức là nhắm mục tiêu ở thể tích khí lưu thông thấp = VT là 6–8 ml/Kg trọng lượng cơ thể dự đoán (predicted body weight − PBW), áp lực cao nguyên (plateau pressure) thấp = PPLAT < 20 cmH2O, áp lực đẩy (driving pressure) = ΔP < 13 cmH2O và áp lực dương cuối thì thở ra (positive end-expiratory pressure − PEEP) < 7 cmH2O [5, 17-27] với một số các biện pháp an toàn cho bệnh nhân bị/hoặc có nguy cơ chấn thương não [28]. Gần đây, khái niệm về công suất cơ học (mechanical power − MP), năng lượng cơ học do máy thở cung cấp mỗi lần trên hệ thống hô hấp hoặc phổi, cũng đã được đề xuất như một thành phần quan trọng của cài đặt thông khí cơ học. MP cao được phát hiện có liên quan đến kết quả tồi tệ hơn ở người không phải hội chứng nguy kịch hô hấp cấp tính (ARDS) [29] và bệnh nhân ARDS [30], nhưng tác động này chưa được làm rõ hoàn toàn ở bệnh nhân sau CA [28]. Ngoài ra, các mục tiêu thông khí tối ưu, tức là nồng độ oxy và carbon dioxide ở bệnh nhân sau CA, vẫn xứng đáng được làm rõ [3]. Đánh giá này nhằm mục đích thảo luận về những tiến bộ hiện tại trong chiến lược thở máy ở những bệnh nhân mắc hội chứng sau CA. Chúng tôi đề xuất mười quy tắc chính để tối ưu hóa thở máy ở bệnh nhân sau CA, xem xét tác động qua lại giữa phổi và các hệ thống và cơ quan khác, bao gồm cả não.
Quy tắc một: thể tích khí lưu thông phải ở mức bảo vệ
VT đại diện cho một trong những thông số chính của chiến lược máy thở bảo vệ phổi. Thể tích khí lưu thông (VT) thấp ở bệnh nhân không mắc ARDS (VT từ 6–8 mL/kg PBW) dẫn đến không có sự khác biệt về số ngày không thở máy, thời gian nằm đơn vị chăm sóc đặc biệt (intensive care unit − ICU) và thời gian nằm viện, tỷ lệ tử vong ngày 28 và ngày 90 so với chiến lược VT trung gian [21]. Trong nghiên cứu PROVENT-iMiC, Pisani và cộng sự không tìm thấy sự khác biệt về VT giữa những bệnh nhân có điểm dự đoán tổn thương phổi cao hơn hoặc thấp hơn (khoảng 8 mL/kg PBW) nhưng các giá trị thấp hơn (khoảng 7 mL/kg PBW) được áp dụng ở những bệnh nhân mắc ARDS [19]. Một phân tích tổng hợp 20 thử nghiệm ở những bệnh nhân bị bệnh nặng không mắc ARDS đã kết luận rằng chiến lược có VT thấp hơn có liên quan đến ít nhiễm trùng phổi, xẹp phổi và tỷ lệ tử vong hơn [31]. Các hướng dẫn của Hiệp hội Y học Chăm sóc Chuyên sâu Châu Âu (European Society of Intensive Care Medicine − ESICM) và Hội đồng Hồi sức Châu Âu (European Resuscitation Council − ERC) đã cung cấp một số thông tin chi tiết về thở máy (mechanical ventilation − MV) ở bệnh nhân bị chấn thương não và sau CA, đề xuất áp dụng VT từ 6–8 ml/kg PBW, nhưng những khuyến nghị này dựa trên các quần thể khác và chỉ có bằng chứng nhỏ ở bệnh nhân sau CA [32]. Một số nghiên cứu điều tra vai trò của VT ở bệnh nhân CA. Trong một nghiên cứu quan sát, Sutherasan và cộng sự đã báo cáo việc sử dụng VT trung bình là 8,9 mL/kg PBW với PEEP trung bình là 3,5 cmH2O [18]. VT cao hơn 10 mL/kg PBW có liên quan đến viêm phổi mắc phải tại ICU [18]. Trong một nghiên cứu khác từ Beitler và cộng sự, việc sử dụng VT thấp hơn có liên quan độc lập với kết quả nhận thức thần kinh thuận lợi và những ngày không thở máy trong một nhóm gồm 256 bệnh nhân sau CA [33]. Một phân tích phụ của thử nghiệm Quản lý nhiệt độ mục tiêu (Target Temperature Management − TTM)1 đã báo cáo VT trung bình là 7,7. mL/kg PBW (60% bệnh nhân được thở máy với VT thấp hơn 8 mL/kg PBW) và VT không liên quan đến tỷ lệ tử vong [26]. Bằng chứng từ một nghiên cứu bao gồm ba nhóm bệnh nhân mắc bệnh thần kinh khác nhau từ các năm khác nhau (2004, 2010 và 2016) đã đề xuất thực hiện các chiến lược máy thở bảo vệ phổi trong nhiều năm, đặc biệt là về VT [34]. Một nghiên cứu phụ gần đây về thử nghiệm TTM2 bao gồm 1848 bệnh nhân sau CA đã báo cáo VT trung bình là 7 mL/kg PBW và PEEP là 7 cmH2O mà không có sự khác biệt giữa những người sống sót và không sống sót [28]. Tất cả các nghiên cứu này cho thấy VT giảm dần qua nhiều năm, điều này có thể được hiểu là biểu hiện của việc áp dụng ngày càng nhiều các chiến lược máy thở bảo vệ phổi ở bệnh nhân CA. Mối liên quan giữa VT thấp hơn và kết quả không nhất quán giữa các nghiên cứu và không có thử nghiệm ngẫu nhiên có đối chứng nào được thực hiện trong phân nhóm bệnh nhân cụ thể [28]. Tuy nhiên, trong các môi trường lâm sàng khác, các hướng dẫn khuyến nghị sử dụng VT trong khoảng từ 6 đến 8 mL/kg PBW. Thông khí kiểm soát thể tích hiện được sử dụng thường xuyên hơn so với thông khí kiểm soát áp lực [18], nhưng không có dữ liệu nào cho thấy bất kỳ ưu thế nào giữa các chế độ khác nhau. Việc sử dụng thông khí hỗ trợ, chủ yếu là thông khí hỗ trợ áp lực (PSV), ngày càng được sử dụng nhiều ở bệnh nhân sau CA [18].
Chúng tôi đề xuất rằng ở những bệnh nhân sau CA, VT nên được đặt trong khoảng từ 6 đến 8 mL/kg PBW, trong thông khí được kiểm soát thể tích hoặc áp lực nhưng lưu ý đến sự tương tác giữa VT và các thông số khác của MV (ví dụ: PPLAT, ΔP, PEEP, MP) cũng như huyết động. Thông khí hỗ trợ có thể được sử dụng tùy theo tình trạng lâm sàng và mức độ an thần của bệnh nhân.
Quy tắc hai: áp lực cao nguyên nên được cá nhân hóa
PPLAT là một thông số quan trọng khác của thông khí bảo vệ phổi, vì nó phụ thuộc vào mối quan hệ giữa thể tích và độ giãn nở của hệ thống hô hấp khi lưu lượng bằng không. Khuyến nghị duy trì PPLAT dưới 20 cmH2O ở những bệnh nhân không mắc ARDS để giảm tỷ lệ tử vong [23, 35]. Thử nghiệm PREVENT ở những bệnh nhân bị bệnh nặng không ARDS đã báo cáo PPLAT thấp hơn (PPLAT = 18 cmH2O) ở nhóm có VT thấp hơn so với VT trung bình (PPLAT = 21 cmH2O), không có sự khác biệt đáng kể về số ngày không thở máy, thời gian nằm viện, biến chứng và tỷ lệ tử vong giữa hai nhóm [21]. Thử nghiệm Relax đã tìm thấy PPLAT tương tự giữa nhóm ở PEEP thấp hơn = 5 cmH2O (19,9 cmH2O) và nhóm ở PEEP cao hơn = 8 cmH2O (20 cmH2O), do đó gợi ý rằng chiến lược PEEP thấp hơn có thể thích hợp hơn ở những bệnh nhân không mắc ARDS [22]. Trong một nghiên cứu ở bệnh nhân sau CA, PPLAT khác biệt đáng kể giữa ba nhóm bệnh nhân ở các khung thời gian khác nhau, với giá trị cao nhất được quan sát thấy vào năm 1998 và thấp nhất vào năm 2010 (lần lượt là 22,7 và 19,5 cmH2O), cho thấy sự thay đổi tiến triển theo thời gian trong cài đặt máy thở trong quần thể này [18]; ngoài ra, PPLAT cao hơn 17 cmH2O được phát hiện có liên quan đến sự phát triển ARDS [18]. Một nghiên cứu rất gần đây trên một nhóm bệnh nhân sau CA đã đề xuất áp dụng PPLAT < 20 cmH2O [28]. Đối với VT, PPLAT nên được thiết lập với mục đích giảm VILI, nhưng quan trọng nhất là nên được xem xét trong chiến lược thông khí được cá nhân hóa, cũng tính đến các thông số thông khí khác có thể liên quan đến tỷ lệ tử vong, bao gồm nhịp thở, áp lực đẩy và MP [28]. Trong nghiên cứu của Robba và cộng sự, PPLAT có liên quan đáng kể với tỷ lệ tử vong trong 6 tháng [28]. PPLAT của hệ hô hấp và áp lực xuyên phổi có thể khác nhau trong trường hợp có sự thay đổi rõ rệt về độ đàn hồi của thành ngực, như xảy ra ở người béo phì. Ở những bệnh nhân béo phì hoặc những người bị tăng áp lực trong ổ bụng với PPLAT > 27 cmH2O, một công thức đơn giản hóa có thể giúp ước tính mức hiệu chỉnh PPLAT cần thiết: mục tiêu PPLAT + (áp lực trong ổ bụng – 13 cmH2O)/2 [36]. Ở những bệnh nhân không béo phì được thở máy, áp lực trong ổ bụng trung bình là 13 cmH2O và một nửa áp lực trong ổ bụng được truyền đến khoang ngực [37]. Chúng tôi đề nghị rằng ở những bệnh nhân sau CA, PPLAT nên được giữ bằng hoặc thấp hơn 20 cmH2O và điều chỉnh áp lực trong ổ bụng khi có chỉ định lâm sàng.
Quy tắc ba: áp lực dương cuối thì thở ra phải thấp nhưng đủ
PEEP đại diện cho một thành phần chính của thở máy. Bằng chứng đồng ý rằng PEEP rất thấp hoặc PEEP bằng 0 có thể làm trầm trọng thêm nguy cơ xẹp phổi và làm tổn thương phổi nặng hơn [38]. Tác động của PEEP cao hơn đối với chấn thương não và áp lực nội sọ đã được nghiên cứu rộng rãi nhưng vẫn còn gây tranh cãi [39]. PEEP cao có thể làm tăng áp lực trong lồng ngực, có khả năng làm suy giảm hoạt động của thất trái, giảm tiền tải, hậu tải và khả năng co bóp, do đó làm giảm sự hồi lưu của tĩnh mạch, phản ánh trên các tĩnh mạch cảnh hoạt động như các trở kháng Starling từ áp lực trong lồng ngực đến não. Các tĩnh mạch cổ thể hiện một cơ chế van giới hạn việc truyền áp lực quá mức trong lồng ngực đến khoang não. Thật vậy, có vẻ như nếu PEEP thấp hơn áp lực tĩnh mạch, thì sự gia tăng quá mức áp lực lên não sẽ không xảy ra [40]. Trong thử nghiệm PROVENT, khi ΔP được đưa vào mô hình, PEEP có liên quan đến kết quả [23]. Trong thử nghiệm Relax bao gồm những bệnh nhân bị bệnh nặng với phổi không bị tổn thương, chiến lược PEEP thấp hơn dẫn đến tỷ lệ tử vong và số ngày không thở máy tương tự so với chiến lược PEEP cao hơn mà không xảy ra tình trạng thiếu oxy nghiêm trọng [22]. Nghiên cứu quan sát PROVENT-iMiC đã kết luận rằng giá trị PEEP không liên quan đến kết quả khi phân tích đa biến [19]. Một số nghiên cứu đã điều tra việc thực hành sử dụng PEEP trong dân số sau CA, Sutherasan và cộng sự đã báo cáo giá trị PEEP trung bình là 3,5 cmH2O ở ba nhóm bệnh nhân sau CA [18], trong khi trong một phân tích phụ của thử nghiệm TTM1, PEEP trung bình là 6 cmH2O [26]. Không có thử nghiệm ngẫu nhiên nào về PEEP sau CA, nhưng phân tích tổng hợp các thử nghiệm ở bệnh nhân bị bệnh nặng không mắc ARDS đã xác nhận rằng chiến lược PEEP cao hơn (5–30 cmH2O) không liên quan đến kết quả tốt hơn, mặc dù nó có thể làm giảm tỷ lệ mắc ARDS và tình trạng thiếu oxy máu [41]. Trong bối cảnh này, nên tránh mức PEEP bằng 0 hoặc rất thấp trong dân số sau CA để đảm bảo oxygen hóa tối ưu đồng thời hạn chế xẹp phổi hoặc căng phồng phổi động, rối loạn huyết động, suy giảm sinh lý não và các biến chứng hệ thống khác [42, 43]. Phân tích phụ gần đây nhất của thử nghiệm TTM2 ở bệnh nhân sau CA cho thấy rằng trong quần thể này, việc áp dụng chiến lược thở máy bảo vệ phổi thậm chí còn phổ biến hơn, bao gồm cả việc sử dụng PEEP cao hơn so với trước đây. Trong nghiên cứu này, giá trị trung bình của PEEP là 7 cmH2O đã được sử dụng, nhưng PEEP đơn lẻ không liên quan đến kết quả của bệnh nhân, cho thấy rằng nên tính đến sự kết hợp của các thông số máy thở để thiết lập máy thở ở bệnh nhân sau CA (tức là, ΔP tùy thuộc vào PPLAT và PEEP) [28]. Chúng tôi đề xuất rằng ở những bệnh nhân sau CA, ban đầu nên sử dụng PEEP 5 cmH2O để đạt SatO2 ít nhất trên 92% và tăng dần trong trường hợp tụt độ bão hòa oxy hoặc làm xấu đi cơ học hô hấp.
==>> Xem thêm: Thất bại rút ống nội khí quản ở phòng chăm sóc đặc biệt: Dự đoán và xử trí
Quy tắc bốn: chú ý đến áp lực đẩy!
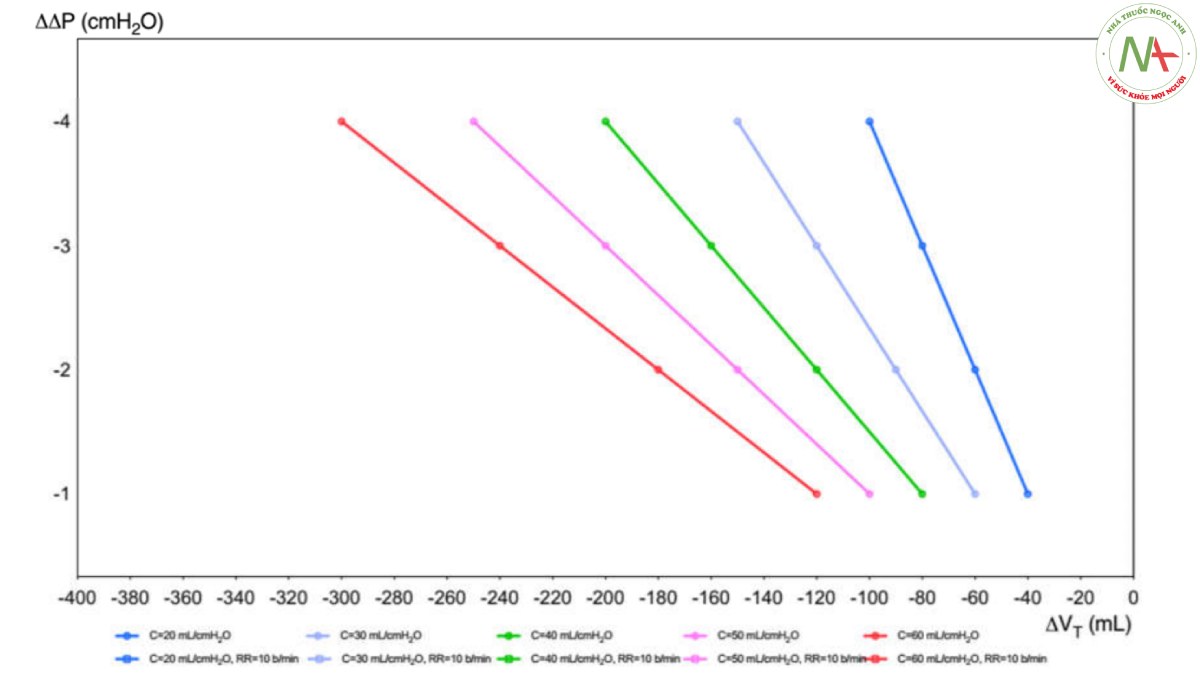
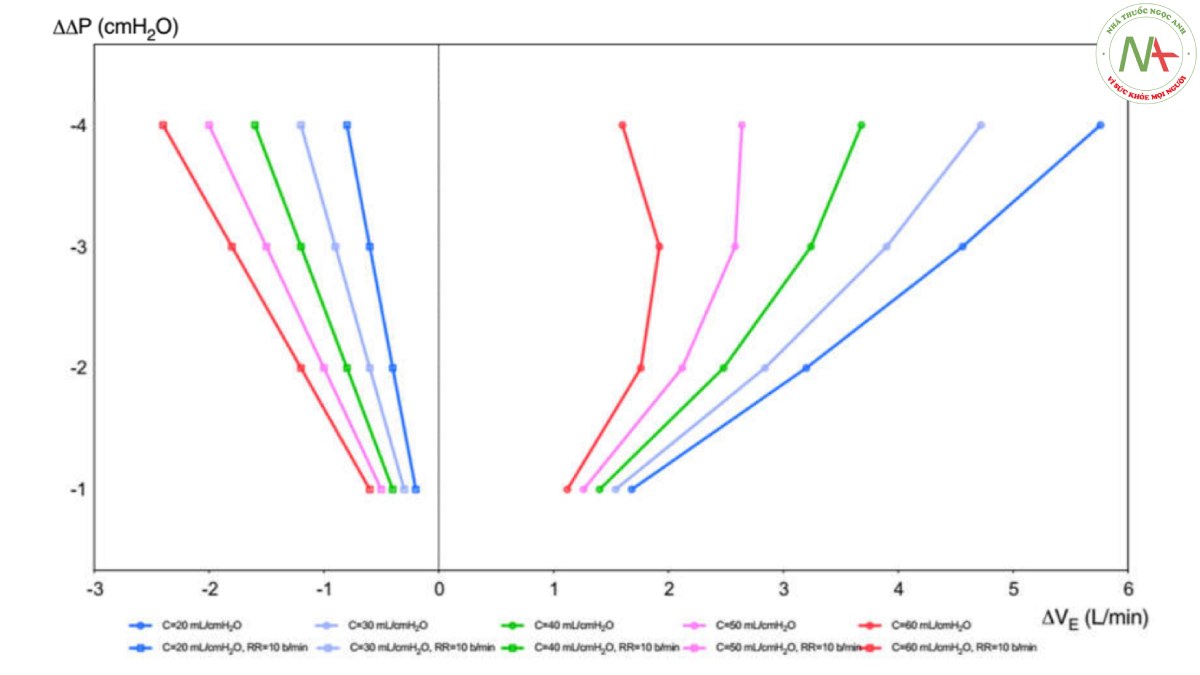
Áp lực đẩy (ΔP) đại diện cho áp lực căng của phổi, là kết quả của PPLAT trừ PEEP và đại diện cho stress tác động lên hệ hô hấp. VT thay đổi khác nhau ảnh hưởng đến sự thay đổi của ΔP (ΔΔP) và PPLAT, liên quan đến độ giãn nở tĩnh khác nhau của hệ hô hấp (Hình 1). Nghiên cứu PROVENT ở những bệnh nhân không mắc ARDS đã kết luận rằng ΔP không liên quan độc lập với tỷ lệ tử vong tại bệnh viện, mặc dù giá trị ΔP chỉ có sẵn cho 343 bệnh nhân [23]. Trong PROVENT- iMiC, trung vị ΔP tương tự nhau ở những bệnh nhân có hoặc không có tổn thương phổi nhưng cao hơn ở những bệnh nhân mắc ARDS. Khi phân tích đa biến, kết quả ΔP không liên quan đến kết cục [19]. Ở những bệnh nhân sau CA, trong một phân tích phụ của thử nghiệm TTM1, giá trị trung bình ΔP = 14,7 cmH2O đã được báo cáo [18]. Giá trị ΔP < 13 cmH2O đã được đề xuất, vì giá trị cao hơn có liên quan độc lập với tỷ lệ tử vong cao hơn [21, 22, 28, 32]. Trong nghiên cứu của Robba và cộng sự, ΔP có liên quan độc lập với tỷ lệ tử vong và kết quả thần kinh kém. Công thức của Costa và cộng sự, [(4 × ΔP) + tần số hô hấp], được nghiên cứu trước đây ở những bệnh nhân mắc ARDS, gần đây đã được áp dụng bởi Robba và cộng sự trong một nhóm lớn bệnh nhân sau CA, cho thấy mối liên hệ mạnh mẽ hơn với kết quả thần kinh kém và tỷ lệ tử vong, khi so sánh với MP đơn thuần [28]. Công thức này có thể dễ dàng hướng dẫn cài đặt máy thở ở đầu giường. Việc giảm VT để giảm ΔP xuống 1 cmH2O chỉ đáng giá nếu PaCO2 có thể được giữ không đổi bằng cách tăng nhịp thở dưới 4 nhịp thở/phút. Ngược lại, có thể đáng để giảm tần số hô hấp xuống bốn nhịp thở nếu việc tăng VT cần thiết để duy trì PaCO2 không đổi dẫn đến tăng ΔP dưới 1 cmH2O. Biến thiên của ΔP (ΔΔP) là hàm của biến thiên thông khí phút (ΔVE) ở các độ giãn nở tĩnh khác nhau của hệ hô hấp được mô tả trong Hình 2. Ở bên phải, tần số hô hấp thay đổi theo ΔP, trong khi ở bên trái nhịp thở cố định 10 lần/phút. Chúng tôi đề xuất ở những bệnh nhân sau CA nên duy trì ΔP < 13 cmH2O để tối ưu hóa VT cho độ giãn nở tương ứng của hệ hô hấp.
Quy tắc năm: tần số hô hấp nên được nhắm mục tiêu đến pHa và PaCO2
Nhịp thở là một trong những biến số chính của thở máy. Đóng góp của nó như tác hại trong MV thường bị đánh giá thấp. Tuy nhiên, cả nhịp thở tự thân và sự không nhạy cảm với nhịp thở (có nghĩa là khả năng của nhịp thở để kiểm soát thông khí phút) có thể gây tổn thương trong MV, do đó thúc đẩy VILI, siêu bơm phồng động và kiềm hô hấp [44]. Ngoài ra, nhịp thở đại diện cho một động lực phản hồi hóa học chính như áp lực riêng phần của oxy trong động mạch (PaO2), áp lực riêng phần của carbon dioxide trong động mạch (PaCO2) và pHa. Điều này giả định mối liên quan then chốt ở những bệnh nhân có/hoặc có nguy cơ chấn thương não như bệnh nhân sau CA, để điều chỉnh lưu lượng máu não và trương lực mạch máu, vì PaCO2 cao có thể gây giãn mạch máu não và phù não [45]. Trong điều kiện bình thường, khi thể tích hoặc áp lực tăng lên, nhịp thở sẽ giảm thông qua phản xạ Hering–Breuer [44].
Việc điều chỉnh PaCO2 và oxygen hóa trong dân số sau CA là một thách thức nhưng đáng được chú ý quan trọng để tránh tổn thương não thứ phát [28]. Trong một nghiên cứu của Harmon và cộng sự, nhịp thở, không phải là thông số thông khí nào khác có liên quan độc lập với tỷ lệ tử vong trong 28 ngày [26]. Tương tự, trong nghiên cứu của Robba và cộng sự, nhịp thở trung bình là 17 nhịp thở/phút và kết quả có liên quan độc lập với kết quả thần kinh kém và tử vong trong 6 tháng. Như đã thảo luận ở trên, tần số hô hấp nên được điều chỉnh theo ΔP và tổng công suất cơ học. Chúng tôi đề nghị rằng ở những bệnh nhân sau CA, tần số hô hấp nên được giữ trong khoảng từ 8 đến 16 nhịp thở/phút.
Quy tắc sáu: năng lượng cơ học là một mục tiêu hấp dẫn, nhưng hãy thận trọng
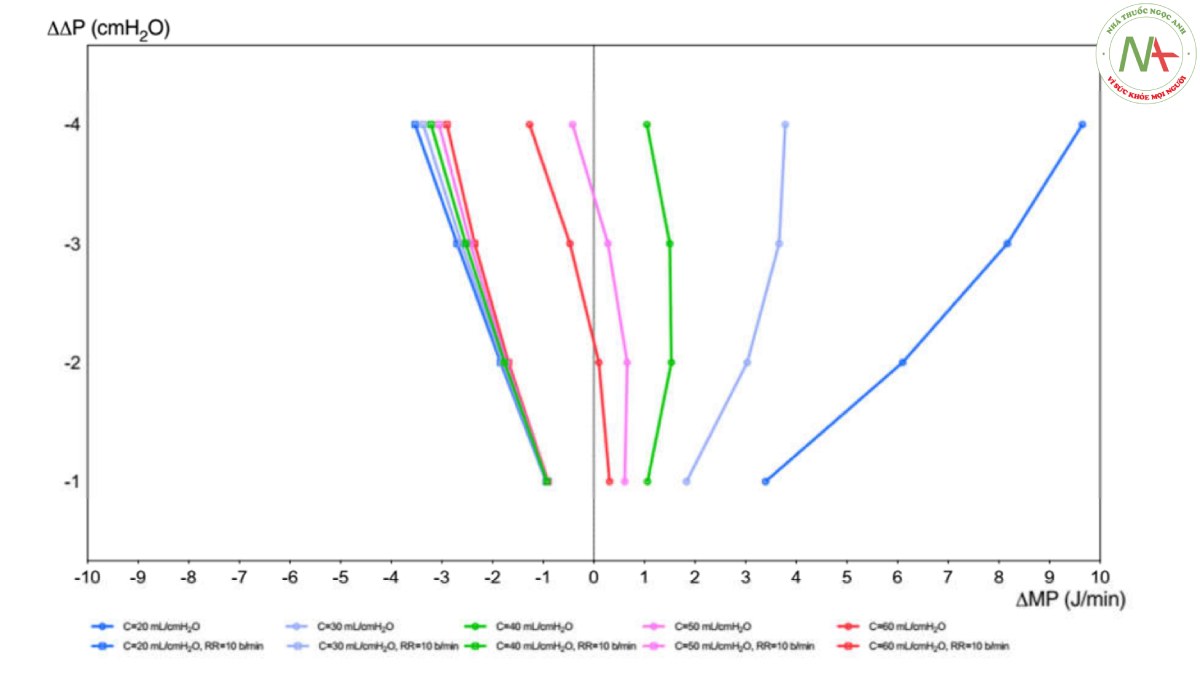
MP là sản phẩm của năng lượng cơ học và tần số hô hấp được áp dụng cho hệ thống hô hấp hoặc phổi. MP chiếm một số thông số của MV, và vì lý do này trong những năm hiện tại đang ngày càng được chú ý như một yếu tố có thể quyết định kết quả của bệnh nhân [46]. Trong một nhóm quan sát các bệnh nhân bị bệnh nặng không mắc ARDS, MP dẫn đến tỷ lệ tử vong tại bệnh viện, tỷ lệ tử vong trong ICU, tỷ lệ tử vong trong 30 ngày, số ngày không thở máy, thời gian nằm ICU và thời gian nằm viện, với sự gia tăng nhất quán về nguy cơ tử vong với MP cao hơn 17,0 J/phút [47]. MP thậm chí còn liên quan chặt chẽ hơn đến tỷ lệ tử vong khi nó được chuẩn hóa bằng chỉ số khối cơ thể [29]. Phương trình MP được tạo thành từ một số thông số của thông khí bảo vệ phổi. Vai trò tương ứng của từng thông số cài đặt máy thở riêng lẻ trong MP để xác định tác động đối với VILI và kết quả lâm sàng là không rõ ràng. Trong một nghiên cứu gần đây về bệnh nhân ARDS, Costa và cộng sự [46] nhận thấy rằng tác động của ΔP đối với tỷ lệ tử vong lớn gấp bốn lần so với tần số hô hấp. Điều này cho thấy rằng việc giảm 1 cmH2O trong ΔP sẽ dẫn đến tần số hô hấp tăng tối đa là 4 nhịp thở/phút, trong khi giảm 3 cmH2O trong ΔP sẽ dẫn đến tần số hô hấp tăng tối đa là 12 nhịp thở/phút. Tuy nhiên, những mối quan hệ này có thể thay đổi ở các mức độ tổn thương phổi và hô hấp hoặc độ đàn hồi phổi khác nhau. Các nghiên cứu trước đây về bệnh nhân sau CA không đánh giá MP là một biến có thể liên quan đến kết quả. Năm 2022, Robba và cộng sự phát hiện ra rằng ở những bệnh nhân sau CA, MP có liên quan độc lập với cả tỷ lệ tử vong và kết quả thần kinh trong 6 tháng [28]. Hình 3 cung cấp phân tích lý thuyết về năm độ giãn nở khác nhau của hệ hô hấp (từ 20 đến 60 mL/cmH2O) trong các biến thể của ΔP (ΔΔP) trong hàm biến thiên của MP (ΔMP). Ở phần bên phải của biểu đồ, công thức của Costa và cộng sự [(4 × ΔP) + nhịp độ hô hấp] được sử dụng để xem sự thay đổi của MP ở các độ giãn nở khác nhau của hệ hô hấp và các nhịp thở khác nhau được chấp nhận tối đa. Ở phần bên trái của biểu đồ, nhịp thở được duy trì không đổi đến 10 nhịp thở/phút trong khi độ giãn nở của hệ hô hấp thay đổi. Đặc biệt là ở độ giãn nở của hệ hô hấp dưới, sự thay đổi MP cao hơn ở nhịp thở cao nhất mà công thức Costa và cộng sự cho phép [(4 × ΔP) + nhịp độ hô hấp]. Điều này cho thấy tần số hô hấp nên được kiểm soát trong giới hạn nhất định và đóng vai trò liên quan để xác định sự gia tăng quá mức của MP, đặc biệt khi độ giãn nở hô hấp thấp. Công thức này có thể dễ dàng điều chỉnh cài đặt MV ở đầu giường, khi điều chỉnh nhịp thở để giữ pHa không đổi (khoảng 7,25) và PaCO2 [28]. Ở những bệnh nhân sau CA, chỉ một số tham số cấu thành công thức MP có liên quan độc lập với kết quả xấu và VILI, trong khi những tham số khác thì không (tức là VT và PEEP) [28]. Điều này cho thấy rằng cần thận trọng khi chỉ đặt cài đặt máy thở trên MP và bằng chứng thuyết phục về tiện ích lâm sàng thực sự của nó ở đầu giường được đảm bảo, đặc biệt ở bệnh nhân sau CA. Theo bằng chứng cho đến nay, nếu được đánh giá tại giường bệnh, chúng tôi đề xuất rằng ở bệnh nhân sau CA, MP nên được nhắm mục tiêu thấp hơn 17 J/phút, có tính đến ΔP và nhịp thở [28, 47].
Quy tắc bảy: oxygen hóa phải được nhắm mục tiêu chính xác đạt được mức oxy máu bình thường
Oxygen hóa là một thông số quan trọng để theo dõi ở bệnh nhân sau CA vì hội chứng này có thể kích hoạt các cơ chế khác nhau như tổn thương tái tưới máu và stress oxygen hóa, có thể góp phần gây tổn thương não và tổn thương tế bào thần kinh [48]. Cả tình trạng thiếu oxy và tăng oxy máu đều được xác định là những yếu tố kích thích bất lợi có thể xảy ra đối với kết quả của những bệnh nhân bị bệnh nặng. Tình trạng thiếu oxy trong hội chứng sau CA hoạt động bằng cách thay đổi quá trình chuyển hóa hiếu khí của não, nếu không được phục hồi, có thể dẫn đến tổn thương tế bào thần kinh và chết tế bào. Khi oxy được phục hồi sau khi tuần hoàn tự phát trở lại, một cơ chế tái tưới máu có thể xảy ra, do đó làm tăng tốc độ chết của tế bào thần kinh [3].
Ngược lại, tăng oxy máu có thể dẫn đến tăng sản xuất các gốc oxy hóa tự do trong ty thể và tổn thương oxy hóa cho các tế bào não và dường như cũng ảnh hưởng đến kết quả của bệnh nhân [3, 49]. Ngưỡng chịu trách nhiệm cho tổn thương tế bào thần kinh do thiếu oxy vẫn chưa được xác định và cho đến nay, nó thường được đặt ở mức 60 mmHg [50-53]. Harmon và cộng sự đã báo cáo một cách tiếp cận tự do đối với oxygen hóa, do đó, bệnh nhân có PaO2 lên đến 100 mmHg và với một tỷ lệ cao nồng độ oxy hít vào. Ở những người không sống sót, oxygen hóa thấp hơn [26]. Tuy nhiên, các báo cáo khác cho rằng tình trạng thiếu oxy cũng có thể gây bất lợi dưới 100 mmHg [18], trong khi Ebner và cộng sự gợi ý rằng thiếu oxy hoặc tăng oxy máu không liên quan đến kết quả ở bệnh nhân sau CA, nhưng khuyến nghị chuẩn độ độ bão hòa oxy ngoại vi (SpO2) trong khoảng từ 94 đến 98% [5]. Một nghiên cứu rất gần đây đã chứng minh rằng giá trị 60 mmHg có thể đánh giá thấp nguy cơ thiếu oxy trong dân số sau CA vì ngưỡng thấp nhất tốt nhất liên quan đến tỷ lệ tử vong gia tăng được tìm thấy ở PaO2 là 69 mmHg, trong khi ngưỡng trên tốt nhất của PaO2 là 195 mmHg [54]. Liên quan đến tình trạng tăng oxy máu, một phân tích tổng hợp gần đây [55], cho thấy tình trạng tăng oxy máu nặng (PaO2 > 300 mmHg) có liên quan đến kết quả thần kinh kém và tử vong khi theo dõi ở bệnh nhân sau CA. Trong một nghiên cứu của Roberts và cộng sự, tăng oxy máu với giá trị > 300 mmHg có liên quan đến kết quả xấu [56]. Trong nghiên cứu của Robba và cộng sự, cả tăng oxy máu “tự thân” và liều lượng (AUC) của tăng oxy máu theo thời gian đều có liên quan đến tỷ lệ tử vong nhưng không liên quan đến kết quả thần kinh kém. Điều này cho thấy rằng ảnh hưởng của tăng oxy máu có thể phụ thuộc vào thời gian tiếp xúc với nồng độ oxy cao. Trong nghiên cứu này, ngưỡng trên tốt nhất của PaO2 là > 195 mmHg. Điều này khác với các nghiên cứu trước đây, nhưng có thể giải thích tại sao trong các nghiên cứu trước đây, ngưỡng 300 mmHg không liên quan đến tỷ lệ tử vong hoặc kết quả thần kinh [57-60]. Bằng chứng hiện tại cũng cho thấy rằng “thời gian trôi qua” trong một hoặc một tình trạng khác có thể đóng một vai trò quan trọng đối với kết quả của bệnh nhân, hơn là một giá trị đơn lẻ, và cần chú ý nhiều hơn đến việc chuẩn độ oxy ở mức thấp hơn so với áp dụng trong quá khứ. Thử nghiệm ICU-ROX xác nhận liệu pháp oxy bảo tồn không có tác động đáng kể (độ bão hòa oxy ngoại vi mục tiêu = SpO2 > 90% và < 97%) so với liệu pháp oxy thông thường (SpO2 không có giới hạn trên nhưng cao hơn 90%) đến ngày không sử dụng máy thở [61]. Các khuyến nghị quan trọng sẽ đến từ thử nghiệm Mega-ROX (ANZCTRN 12620000391976) sẽ so sánh liệu pháp oxy tự do (SpO2 không có giới hạn trên, nhưng > 90%) so với liệu pháp oxy bảo tồn (SpO2 91–94%) ở bệnh nhân nặng [62]. Trong một thử nghiệm ngẫu nhiên có kiểm soát gần đây, nhắm mục tiêu chiến lược oxygen hóa hạn chế (68–75 mmHg) so với tự do (98–105 mmHg) ở bệnh nhân hôn mê sau CA không làm thay đổi kết quả (tử vong, tàn tật nặng và hôn mê) [63]. Trong khi chờ đợi kết quả của các thử nghiệm lâm sàng đang diễn ra, theo các phát hiện cho đến nay, ngưỡng PaO2 là 70–110 mmHg có vẻ hợp lý ở nhóm bệnh nhân này.
Quy tắc tám: carbon dioxide phải ở trong phạm vi bình thường
Vai trò của nồng độ carbon dioxide thường bị đánh giá thấp ở những bệnh nhân sau CA. Hypercapnia và hypocapnia gây bất lợi cho sinh lý não. Sự thay đổi của PaCO2 có thể ảnh hưởng rộng rãi đến sự thay đổi pH nội bào và ảnh hưởng đến năng lượng trao đổi chất và nhu cầu oxy đến não [3]. Giảm CO2 máu là nguyên nhân gây co mạch não và tổn thương do thiếu máu cục bộ chuyển sang chuyển hóa yếm khí và kích hoạt phản ứng viêm toàn thân. Mặt khác, tăng CO2 máu có thể gây giãn mạch và thúc đẩy giảm lưu lượng máu não [3]. Mặc dù một số nhà nghiên cứu đề xuất sử dụng tăng CO2 nhẹ (PaCO2 50–55 mmHg) để cải thiện quá trình oxygen hóa não so với CO2 bình thường, nồng độ PaCO2 tăng cao có thể dẫn đến pH thấp hơn và ảnh hưởng tiêu cực đến kết quả [64]. Do đó, những thay đổi về PaCO2 cũng như thở máy trong và sau CA có thể ảnh hưởng đến nồng độ carbon dioxide và pH, đồng thời kích hoạt các con đường nguy hiểm xung quanh pH, nhu cầu tế bào và giải phóng catecholamine [3], do đó ảnh hưởng đến kết quả. Ebner và cộng sự [25] không tìm thấy bất kỳ mối liên quan nào giữa giảm CO2 máu (< 34 mmHg) hoặc tăng CO2 máu (> 45 mmHg) và kết quả thần kinh sau CA. Trong khi chờ đợi kết quả của thử nghiệm lâm sàng ngẫu nhiên TAME (NCT03114033), ngưỡng thích hợp để áp dụng cho bệnh nhân sau CA vẫn chưa được xác định. Theo tài liệu, giá trị PaCO2 nằm trong khoảng từ 35 đến 50 mmHg có vẻ phù hợp hơn [3].
==>> Xem thêm” Theo dõi Carbon Dioxide thở ra ở bệnh nhân đặt và không đặt nội khí quản
Quy tắc chín: nhiệt độ có thể ảnh hưởng đến chức năng thông khí
Vai trò của quản lý nhiệt độ ở bệnh nhân sau CA ngày càng trở nên rõ ràng, nhưng ảnh hưởng của nó đối với việc cài đặt thông số thông khí và trao đổi khí vẫn chưa chắc chắn. Hạ thân nhiệt ở nhiệt độ mục tiêu là 33°C không mang lại lợi ích so với nhiệt độ mục tiêu là 36°C [65]. Mục tiêu hạ thân nhiệt ở 33°C sau đó là làm ấm lại có kiểm soát không làm giảm tỷ lệ tử vong trong 6 tháng so với mục tiêu giữ nhiệt độ bình thường [66]. Nhiệt độ là một yếu tố ảnh hưởng tiềm năng đến quá trình trao đổi khí và độ hòa tan của PaCO2 tăng ở nhiệt độ thấp hơn. Thật vậy, phân tích khí máu thường được chuẩn hóa theo nhiệt độ, nếu không có thể báo cáo các giá trị không chính xác. Tương tự, trong một nghiên cứu hồi cứu nhỏ, PaCO2 giảm nhiều hơn đáng kể ở nhóm quản lý nhiệt độ mục tiêu so với nhóm chứng [67]. Về oxy, một nghiên cứu gần đây cho thấy không có sự khác biệt đáng kể về ngưỡng oxy liên quan đến tỷ lệ tử vong giữa mục tiêu hạ thân nhiệt và mục tiêu thân nhiệt bình thường, do đó gợi ý rằng hạ thân nhiệt không cải thiện khả năng dung nạp oxy [66]. Ảnh hưởng của nhiệt độ tương đối nhỏ nếu khoảng chết không tăng. Những ảnh hưởng này của nhiệt độ đã được nghiên cứu thông qua phương trình thông khí khoảng chết phế nang: (PaCO2 – end-tidal (et)CO2)/PaCO2, trong đó việc quản lý nhiệt độ ở 33°C dẫn đến mức etCO2 thấp hơn và tỷ lệ khoảng chết phế nang cao hơn so với 36°C với thông khí phút tương tự [26]. Hiệu ứng này có thể được giải thích là do tưới máu phổi thấp hơn do tăng co mạch, cũng phù hợp với mức lactate cao hơn ở 33°C so với 36°C [26]. Ở những bệnh nhân vẫn còn hôn mê sau CA, hướng dẫn khuyến nghị theo dõi liên tục nhiệt độ cơ thể và phòng ngừa sốt (được định nghĩa là nhiệt độ > 37,7°C) trong ít nhất 72 giờ. Không đủ bằng chứng để khuyến nghị hoặc phản đối việc kiểm soát nhiệt độ ở 32–36°C hoặc làm lạnh sớm sau CA [68].
Quy tắc mười: huyết động nên được duy trì ổn định
Huyết động học đại diện cho một phần quan trọng khác để tối ưu hóa MV. Ở những bệnh nhân sau CA, quản lý MV, dịch truyền và thuốc vận mạch, và kiểm soát nhiệt độ có thể ảnh hưởng đến huyết động và kết quả. Thông khí áp lực dương có thể ảnh hưởng đến lưu lượng và phân phối máu phổi, do đó làm xấu đi chức năng tim mạch và trao đổi khí [69]. Thật vậy, máy thở nên được đặt để cho phép đủ thời gian thở ra để hạn chế sự phát triển của siêu bơm phồng động, và tác động của PEEP nội tại và áp lực MV dương để tránh trụy tim mạch, đặc biệt ở những bệnh nhân sau CA thường xuyên báo cáo chức năng tim mạch bị thay đổi [69]. Việc truyền dịch để phục hồi thể tích cuối tâm trương có thể được xem xét khi có hiện diện của PEEP nếu đồng thời suy giảm chức năng co bóp của tâm thất trái và cung lượng tim xảy ra. Thuốc vận mạch, thuốc tăng co bóp cơ tim hoặc thuốc giãn mạch máu như epinephrine, dobutamine hoặc milrinone có thể được sử dụng để hỗ trợ cung lượng tim sau khi tối ưu hóa dịch truyền và cài đặt máy thở, nhưng chúng có thể làm tăng nhu cầu oxy [69]. Một thử nghiệm gần đây gợi ý rằng mục tiêu áp lực động mạch trung bình là 63 mmHg hoặc 77 mmHg ở bệnh nhân sau CA không cải thiện tỷ lệ tử vong hoặc kết quả thần kinh [70]. Những kết quả này gợi ý áp dụng một chiến lược huyết động cá nhân. Mục tiêu nhiệt độ có thể ảnh hưởng đến huyết động. Hạ thân nhiệt ở 33°C, khi so sánh với 36°C, có liên quan đến sự thay đổi huyết động (nghĩa là giảm nhịp tim, tăng nồng độ lactate và cần tăng hỗ trợ thuốc vận mạch). Huyết áp động mạch trung bình thấp và nhu cầu sử dụng thuốc vận mạch liều cao có liên quan độc lập với tỷ lệ tử vong gia tăng ở cả hai nhóm [71]. Một phân tích hậu kỳ của thử nghiệm TTM2 cho thấy ở những bệnh nhân sau CA được hỗ trợ thuốc vận mạch vừa phải khi nhập viện, hạ thân nhiệt ở nhóm 33°C làm tăng tử vong không do thần kinh. Thật vậy, ở nhóm 33°C, huyết động không ổn định và rối loạn nhịp tim xảy ra thường xuyên hơn [72]. Tóm lại, những bệnh nhân mắc hội chứng sau CA cần được theo dõi chặt chẽ về các tương tác bất lợi có thể xảy ra với hô hấp và tim mạch, do đó tính đến việc quản lý nhiệt độ mục tiêu (khoảng 36°C) và các mục tiêu tim mạch được cá nhân hóa.
Định hướng tương lai
Vai trò của thở máy bảo vệ ở bệnh nhân sau CA ngày càng trở nên rõ ràng hơn. Hình 4 tiếp tục các quy tắc chính để tối ưu hóa cài đặt máy thở ở bệnh nhân sau CA trong khi tính toán các tương tác phổi-tim và não. Nghiên cứu PROVENT-iMiC cho thấy rằng thở máy bảo vệ dễ dàng đạt được theo các quy tắc đơn giản ngay cả ở các quốc gia có thu nhập thấp và trung bình, nơi nguồn lực khan hiếm hơn so với các quốc gia có thu nhập cao [19]. Tuy nhiên, cách đặt máy thở đúng cách cho bệnh nhân mắc hội chứng sau CA cũng như ARDS hoặc các bệnh khác cần được giáo dục và đào tạo với các chương trình can thiệp chuyên biệt [73].
Kết luận
Vai trò của cài đặt thở máy bảo vệ và cá nhân hóa ở bệnh nhân không mắc ARDS và sau CA ngày càng trở nên rõ ràng. Tối ưu hóa thông khí cơ học là rẻ và có thể được áp dụng ở các nước có thu nhập kinh tế cao và trung bình thấp chỉ cần đào tạo và giáo dục. Tuy nhiên, vai trò riêng của từng thông số thông khí bảo vệ để giảm thiểu tổn thương phổi và mối liên hệ của chúng với các kết quả lâm sàng chính vẫn chưa được làm rõ hoàn toàn ở bệnh nhân sau CA và cần được nghiên cứu thêm.
Tài liệu tham khảo
- Eastwood GM, Tanaka A, Espinoza EDV, Peck L, Young H, Mårtensson J, et al. Conservative oxygen therapy in mechanically ventilated patients following cardiac arrest: a retrospective nested cohort study. Resuscitation. 2016;101:108–14.
- Kim Y-M, Yim H-W, Jeong S-H, Lou KM, Callaway CW. Does therapeutic hypothermia benefit adult cardiac arrest patients presenting with non-shockable initial rhythms? A systematic review and meta-analysis of randomized and non-randomized Resuscitation. 2012;83:188–96.
- Robba C, Siwicka-Gieroba D, Sikter A, Battaglini D, Dąbrowski W, Schultz MJ, et al. Pathophysiology and clinical consequences of arterial blood gases and pH after cardiac Intensive Care Med Exp. 2020;8:19.
- Newell C, Grier S, Soar J. Airway and ventilation management during cardiopulmonary resuscitation and after successful Crit Care. 2018;22:190.
- Ebner F, Ullén S, Åneman A, Cronberg T, Mattsson N, Friberg H, et al. Associations between partial pressure of oxygen and neurological outcome in out-of-hospital cardiac arrest patients: an explorative analysis of a randomized Crit Care. 2019;23:30.
- Bellomo R, Bailey M, Eastwood GM, Nichol A, Pilcher D, Hart GK, et al. Arterial hyperoxia and in-hospital mortality after resuscitation from cardiac arrest. Crit Care. 2011;15:R90.
- Wang C-H, Chang W-T, Huang C-H, Tsai M-S, Yu P-H, Wang A-Y, et al. The effect of hyperoxia on survival following adult cardiac arrest: a systematic review and meta-analysis of observational studies. Resuscitation. 2014;85:1142–8.
- Vincent J-L, Taccone FS, He X. Harmful effects of hyperoxia in postcardiac arrest, sepsis, traumatic brain injury, or stroke: the importance of individualized oxygen therapy in critically ill patients. Can Respir J. 2017;2017:1–
- Nolan JP, Neumar RW, Adrie C, Aibiki M, Berg RA, Böttiger BW, et Post-cardiac arrest syndrome: epidemiology, pathophysiology, treatment, and prognostication. Resuscitation. 2008;79:350–79.
- Sekhon MS, Ainslie PN, Griesdale DE. Clinical pathophysiology of hypoxic ischemic brain injury after cardiac arrest: a “two-hit” model. Crit Care. 2017;21:90.
- Brueckl C, Kaestle S, Kerem A, Habazettl H, Krombach F, Kuppe H, et al. Hyperoxia-induced reactive oxygen species formation in pulmonary capillary endothelial cells in Am J Respir Cell Mol Biol. 2006;34:453–63.
- Brugniaux JV, Coombs GB, Barak OF, Dujic Z, Sekhon MS, Ainslie PN. Highs and lows of hyperoxia: physiological, performance, and clinical Am J Physiol Integr Comp Physiol. 2018;315:R1-27.
- Farquhar H, Weatherall M, Wijesinghe M, Perrin K, Ranchord A, Simmonds M, et Systematic review of studies of the effect of hyperoxia on coronary blood flow. Am Heart J. 2009;158:371–7.
- Cornet AD, Kooter AJ, Peters MJ, Smulders YM. The potential harm of oxygen therapy in medical emergencies. Crit 2013;17:313.
- Damiani E, Donati A, Girardis Oxygen in the critically ill. Curr Opin Anaesthesiol. 2018;31:129–35.
- Crawford P, Good PA, Gutierrez E, Feinberg JH, Boehmer JP, Silber DH, et al. Effects of supplemental oxygen on forearm vasodilation in humans. J Appl 1997;82:1601–6.
- Sutherasan Y, Vargas M, Pelosi P. Protective mechanical ventilation in the non-injured lung: review and meta- Crit Care [Internet]. BioMed Central; 2014 [cited 2019 May 3];18:211. Available from: http://www.ncbi.nlm.nih.gov/pubmed/24762100
- Sutherasan Y, Peñuelas O, Muriel A, Vargas M, Frutos-Vivar F, Brunetti I, et al. Management and outcome of mechanically ventilated patients after cardiac arrest. Crit 2015;19:215.
- Pisani L, Algera AG, Serpa Neto A, Ahsan A, Beane A, Chittawatanarat K, et al. Epidemiological characteristics, ventilator management, and clinical outcome in patients receiving invasive ventilation in intensive care units from 10 Asian middle-income countries (PRoVENT-iMiC): an international, multicenter, prospective Am J Trop Med Hyg. 2021. https://doi.org/10.4269/ajtmh.20-1177.
- Neto AS, Barbas CSV, Simonis FD, Artigas-Raventós A, Canet J, Determann RM, et Epidemiological characteristics, practice of ventilation, and clinical outcome in patients at risk of acute respiratory distress syndrome in intensive care units from 16 countries (PRoVENT): an international, multicentre, prospective study. Lancet Respir Med. 2016;4:882–93.
- Simonis FD, Serpa Neto A, Binnekade JM, Braber A, Bruin KCM, Determann RM, et Effect of a low vs intermediate tidal volume strategy on ventilator-free days in intensive care unit patients without ARDS. JAMA. 2018;320:1872.
- Algera AG, Pisani L, Serpa Neto A, den Boer SS, Bosch FFH, Bruin K, et al. Effect of a lower vs higher positive end-expiratory pressure strategy on ventilator-free days in ICU patients without ARDS: a randomized clinical JAMA J Am Med Assoc. 2020;324:2509.
- Simonis FD, Barbas CSV, Artigas-Raventós A, Canet J, Determann RM, Anstey J, et al. Potentially modifiable respiratory variables contributing to outcome in ICU patients without ARDS: a secondary analysis of PRoVENT. Ann Intensive 2018;8:39.
- Silva PL, Pelosi P, Rocco PRM. Optimal mechanical ventilation strategies to minimize ventilator-induced lung injury in non-injured and injured Expert Rev Respir Med. 2016;10:1243–5.
- Ebner F, Harmon MBA, Aneman A, Cronberg T, Friberg H, Hassager C, et al. Carbon dioxide dynamics in relation to neurological outcome in resuscitated out-of-hospital cardiac arrest patients: an exploratory target temperature management trial substudy. Crit 2018;22:196.
- Harmon MBA, van Meenen DMP, van der Veen ALIP, Binnekade JM, Dankiewicz J, Ebner F, et al. Practice of mechanical ventilation in cardiac arrest patients and effects of targeted temperature management: a substudy of the targeted temperature management Resuscitation. 2018;129:29–36.
- Sutherasan Y, Raimondo P, Pelosi P. Ventilation and gas exchange management after cardiac arrest. Best Pract Res Clin Anaesthesiol. 2015;29:413–24.
- Robba C, Badenes R, Battaglini D, Ball L, Brunetti I, Jakobsen JC, et al. Ventilatory settings in the initial 72 h and their association with outcome in out-of-hospital cardiac arrest patients: a preplanned secondary analysis of the targeted hypothermia versus targeted normothermia after out-of-hospital cardiac arrest (TTM2) Intensive Care Med. 2022;online ahead of print.
- Serpa Neto A, Deliberato RO, Johnson AE, Pollard TJ, Celi LA, Pelosi P, et al. Normalization of mechanical power to anthropometric indices: impact on its association with mortality in critically ill patients. Intensive Care Med. 2019;45:1835–7.
- Chen L, Grieco DL, Beloncle F, Chen G-Q, Tiribelli N, Madotto F, et al. Partition of respiratory mechanics in patients with acute respiratory distress syndrome and association with outcome: a multicentre clinical study. Intensive Care Med. 2022;48:888–98.
- Serpa Neto A, Cardoso SO, Manetta JA, Pereira VGM, Espósito DC, de Pasqualucci MOP, et Association between use of lung-protective ventilation with lower tidal volumes and clinical outcomes among patients without acute respiratory distress syndrome. JAMA. 2012;308:1651.
- Nolan JP, Sandroni C, Böttiger BW, Cariou A, Cronberg T, Friberg H, et al. European resuscitation council and European society of intensive care medicine guidelines 2021: post-resuscitation care. Intensive Care Med. 2021;47:369–421.
- Beitler JR, Ghafouri TB, Jinadasa SP, Mueller A, Hsu L, Anderson RJ, et al. Favorable neurocognitive outcome with low tidal volume ventilation after cardiac Am J Respir Crit Care Med. 2017;195:1198–206.
- Tejerina EE, Pelosi P, Robba C, Peñuelas O, Muriel A, Barrios D, et Evolution over time of ventilatory management and outcome of patients with neurologic disease. Crit Care Med. 2021;49:1095–106.
- Pisani L, Algera AG, Neto AS, Azevedo L, Pham T, Paulus F, et al. Geoeconomic variations in epidemiology, ventilation management, and outcomes in invasively ventilated intensive care unit patients without acute respiratory distress syndrome: a pooled analysis of four observational Lancet Glob Heal. 2022;10:e227–35.
- Pelosi P, Ball L, Barbas CSV, Bellomo R, Burns KEA, Einav S, et al. Personalized mechanical ventilation in acute respiratory distress syndrome. Crit 2021;25:250.
- Regli A, Pelosi P, Malbrain Ventilation in patients with intra-abdominal hypertension: what every critical care physician needs to know. Ann Intensive Care. 2019;9:52.
- Farias LL, Faffe DS, Xisto DG, Santana MCE, Lassance R, Prota LFM, et al. Positive end-expiratory pressure prevents lung mechanical stress caused by recruitment/derecruitment. J Appl 2005;98:53–61.
- Robba C, Ball L, Nogas S, Battaglini D, Messina A, Brunetti I, et al. Effects of positive end-expiratory pressure on lung recruitment, respiratory mechanics and intracranial pressure in mechanically ventilated brain injured Front Physiol. 2021;12: 711273.
- Riforgiato C, Battaglini D, Robba C, Pelosi P. Mechanical ventilation—PEEP. Essentials evidence-based pract neuroanesthesia neurocritical Elsevier; 2022. p. 33–42.
- Yi H, Li X, Mao Z, Liu C, Hu X, Song R, et Higher PEEP versus lower PEEP strategies for patients in ICU without acute respiratory distress syndrome: a systematic review and meta-analysis. J Crit Care. 2022;67:72–8.
- Robba C, Poole D, McNett M, Asehnoune K, Bösel J, Bruder N, et al. Mechanical ventilation in patients with acute brain injury: recommendations of the European society of intensive care medicine consensus. Intensive Care 2020;46:2397–410.
- Algera AG, Pierrakos C, Botta M, Zimatore C, Pisani L, Tuinman P-R, et al. Myocardial function during ventilation with lower versus higher positive end-expiratory pressure in patients without J Clin Med. 2022;11:2309.
- Akoumianaki E, Vaporidi K, Georgopoulos D. The injurious effects of elevated or nonelevated respiratory rate during mechanical ventilation. Am J Respir Crit Care 2019;199:149–57.
- Heffner Controlled hyperventilation in patients with intracranial hypertension. Arch Intern Med. 1983;143:765.
- EL Costa V, Slutsky AS, Brochard LJ, Brower R, Serpa-Neto A, Cavalcanti AB, et al. Ventilatory variables and mechanical power in patients with acute respiratory distress Am J Respir Crit Care Med. 2021;204:303–11.
- Serpa Neto A, Deliberato RO, Johnson AEW, Bos LD, Amorim P, Pereira SM, et Mechanical power of ventilation is associated with mortality in critically ill patients: an analysis of patients in two observational cohorts. Intensive Care Med. 2018;44:1914–22.
- Taran S, Pelosi P, Robba C. Optimizing oxygen delivery to the injured brain. Curr Opin Crit Care. 2022;28:145–
- Ni Y-N, Wang Y-M, Liang B-M, Liang Z-A. The effect of hyperoxia on mortality in critically ill patients: a systematic review and meta analysis. BMC Pulm 2019;19:53.
- Shin HK, Dunn AK, Jones PB, Boas DA, Lo EH, Moskowitz MA, et al. Normobaric hyperoxia improves cerebral blood flow and oxygenation, and inhibits peri-infarct depolarizations in experimental focal ischaemia. Brain. 2007;130:1631–42.
- Alternative Therapy Evaluation Committee for the Insurance Corporation of Brithish Columbia. A review of the scientific evidence on the treatment of traumatic brain injuries and strokes with hyperbaric oxygen. Brain Inj. 2003;17:225–36.
- Rincon F, Mayer SA, Rivolta J, Stillman J, Boden-Albala B, Elkind MSV, et al. Impact of delayed transfer of critically ill stroke patients from the emergency department to the neuro-ICU. Neurocrit 2010;13:75–81.
- Le Gall JR. A new simplified acute physiology score (SAPS II) based on a European/North American multicenter JAMA J Am Med Assoc. 1993;270:2957–63.
- Robba C, Badenes R, Battaglini D, Ball L, Sanfilippo F, Brunetti I, et Oxygen targets and 6-month outcome after out of hospital cardiac arrest: a pre-planned sub-analysis of the targeted hypothermia versus targeted normothermia after out-of-hospital cardiac arrest (TTM2) trial. Crit Care. 2022;26:323.
- La Via L, Astuto M, Bignami EG, Basalacchi D, Dezio V, Girardis M, et al. The effects of exposure to severe hyperoxemia on neurological outcome and mortality after cardiac Minerva Anestesiol. 2022;Online ahead of print.
- Roberts BW, Kilgannon JH, Hunter BR, Puskarich MA, Pierce L, Donnino M, et al. Association between early hyperoxia exposure after resuscitation from cardiac arrest and neurological Circulation. 2018;137:2114–24.
- Johnson NJ, Dodampahala K, Rosselot B, Perman SM, Mikkelsen ME, Goyal M, et al. The association between arterial oxygen tension and neurological outcome after cardiac Ther Hypothermia Temp Manag. 2017;7:36–41.
- Kim TJ, Kim J-M, Lee JS, Park S-H, Jeong H-B, Choi J-K, et al. Prognostication of neurological outcome after cardiac arrest using wavelet phase coherence analysis of cerebral Resuscitation. 2020;150:41–9.
- Ebner F, Riker RR, Haxhija Z, Seder DB, May TL, Ullén S, et al. The association of partial pressures of oxygen and carbon dioxide with neurological outcome after out-of-hospital cardiac arrest: an explorative international cardiac arrest registry 0 study. Scand J Trauma Resusc Emerg Med. 2020;28:67.
- Peluso L, Belloni I, Calabró L, Dell’Anna AM, Nobile L, Creteur J, et al. Oxygen and carbon dioxide levels in patients after cardiac Resuscitation. 2020;150:1–7.
- ICU-ROX Investigators and the Australian and New Zeland Intensive Care Society Clinical Trials Conservative oxygen therapy during mechanical ventilation in the ICU. N Engl J Med. 2020;382:989–98.
- Young PJ, Arabi YM, Bagshaw SM, Bellomo R, Fujii T, Haniffa R, et Protocol and statistical analysis plan for the mega randomised registry trial research program comparing conservative versus liberal oxygenation targets in adults receiving unplanned invasive mechanical ventilation in the ICU (Mega-ROX). Crit Care Resusc. 2022;24:137–49.
- Schmidt H, Kjaergaard J, Hassager C, Mølstrøm S, Grand J, Borregaard B, et al. Oxygen targets in comatose survivors of cardiac arrest. N Engl J 2022;Online ahead of print.
- Tiruvoipati R, Pilcher D, Botha J, Buscher H, Simister R, Bailey M. Association of hypercapnia and hypercapnic acidosis with clinical outcomes in mechanically ventilated patients with cerebral JAMA Neurol. 2018;75:818–26.
- Nielsen N, Wetterslev J, Cronberg T, Erlinge D, Gasche Y, Hassager C, et Targeted temperature management at 33 °C versus 36 °C after cardiac arrest. N Engl J Med. 2013;369:2197–206.
- Dankiewicz J, Cronberg T, Lilja G, Jakobsen JC, Levin H, Ullén S, et al. Hypothermia versus normothermia after out-of-hospital cardiac arrest. N Engl J 2021;384:2283–94.
- Karnatovskaia LV, Festic E, Freeman WD, Lee AS. Effect of therapeutic hypothermia on gas exchange and respiratory mechanics: a retrospective cohort Ther Hypothermia Temp Manag. 2014;4:88–95.
- Sandroni C, Nolan JP, Andersen LW, Böttiger BW, Cariou A, Cronberg T, et ERC-ESICM guidelines on temperature control after cardiac arrest in adults. Intensive Care Med. 2022;48:261–9.
- Mahmood SS, Pinsky MR. Heart-lung interactions during mechanical ventilation: the basics. Ann Transl Med. 2018;6:349–349.
- Kjaergaard J, Møller JE, Schmidt H, Grand J, Mølstrøm S, Borregaard B, et al. Blood-pressure targets in comatose survivors of cardiac arrest. N Engl J 2022;online ahead of print.
- Bro-Jeppesen J, Annborn M, Hassager C, Wise MP, Pelosi P, Nielsen N, et al. Hemodynamics and vasopressor support during targeted temperature management at 33 °C versus 36 °C after out-of-hospital cardiac Crit Care Med. 2015;43:318–27.
- Düring J, Annborn M, Cariou A, Chew MS, Dankiewicz J, Friberg H, et al. Influence of temperature management at 33 °C versus normothermia on survival in patients with vasopressor support after out-of-hospital cardiac arrest: a post hoc analysis of the TTM-2 trial. Crit Care. 2022;26:231.
- Battaglini D, Ionescu Maddalena A, Caporusso RR, Garofalo E, Bruni A, Bocci MG, et al. Acquisition of skills in critical emergency medicine: an experimental study on the SIAARTI Academy CREM Minerva Anestesiol. 2021;87:1174–82.