Hướng dẫn điều trị
Lactate là đích của giai đoạn đầu hồi sức trong sepsis
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Lactate là đích giai đoạn đầu hồi sức trong sepsis – Tải file PDF Tại đây.
GIỚI THIỆU
Hồi sức bệnh nhân trong sepsis là một thách thức vì nhiều lý do. Một câu hỏi quan trọng là: Ai cần loại hồi sức nào? Trong guidelines hiện tại, hồi sức chủ yếu hướng đến những bệnh nhân có tỉ lệ tử vong cao. Trong bài review này, tôi sẽ thảo luận về giá trị lactate trong phát hiện bệnh nhân có thể có lợi từ việc điều trị và cách sử dụng các mức lactate.
BỆNH CẢNH LÂM SÀNG
Mặc dù lactate là marker chỉ điểm giảm tưới máu mô theo Surviving Sepsis Campaign khi nó tăng trên 1 mmol/L,(1) bù dịch hồi sức tích cực chỉ được khuyến cáo trên những bệnh nhân lactate trên 4 mmol/L, do nó liên quan đến tỉ lệ tử vong cao.(2) Tuy nhiên, về nguồn gốc gây tăng lactate máu và điều trị nó có thể phức tạp hơn. Về cơ chế, đầu tiên điều quan trọng là nhận ra giảm tưới máu mô không gây tăng lactate cho đến khi giảm phân phối oxy đến mô (là hệ quả của giảm tưới máu), khi không đáp ứng đủ nhu cầu oxy tới mô.(3) Thứ hai, gan gần như mất khả năng thanh thải trong sepsis,(4) gây tăng lactate dai dẳng không do rối loạn oxy tại mô. Cuối cùng, các yếu tố khác trong sepsis có thể góp phần tăng lactate dù đảm bảo oxy mô đầy đủ.(5) Bất kể cơ chế nào, lactate là một chỉ điểm quan trọng đánh giá đáp ứng điều trị ban đầu trên bệnh nhân. Trong TÂT CẢ các dạng suy tuần hoàn cấp tính, giảm được nồng độ lactate mang lại kết cục tốt hơn.(6) Do vậy, từ điều này chúng tôi có thể hình thành kết luận đầu tiên: Nếu lactate KHÔNG giảm sau điều trị ban đầu, something is wrong (có gì đó sai sai).
Mặc dù có nhiều lý do gây tăng lactate trên bệnh nhân sepsis, trong giai đoạn đầu biểu hiện trên những bệnh nhân này, không đủ oxy phân phối đến mô là nguyên nhân quan trọng nhất. Nó cũng là nguyên nhân duy nhất chúng ta có thể điều trị mang lại hiệu quả khi đã loại trừ ngộ độc và các nguyên nhân rối loạn chuyển hóa khác gây tăng lactate.(5) Điều trị ban đầu với tình trạng tăng lactate máu trên bệnh nhân sepsis nên hướng tới cải thiện phân phối oxy đến mô. Điều này được thực hiện hiệu quả nhất bằng cách cải thiện lưu lượng máu, mục đích cải thiện tưới máu vi tuần hoàn. Các biện pháp khác có thể phối hợp đồng thời bao gồm cải thiện độ bão hòa oxy máu động mạch, cải thiện Hb và giảm nhu cầu oxy. Bắt đầu ngay lập tức khi nhập vào ICU, điều này không chỉ có hiệu quả trong giảm nồng độ lactate; nó còn cải thiện tỉ lệ sống sót 20%.(7) Mặc dù những bệnh nhân đã được đề cập trong nghiên cứu (7) có nồng độ lactate từ 3 mmol/L trở lên, nhưng có thể hình dung bệnh nhân có nồng độ lactate thấp hơn cũng có thể có lợi, vì nồng độ lactate từ 2.0-3.9 mmol/L ở bệnh nhân nhiễm trùng cũng liên quan đến tỉ lệ tử vong đáng kể, kể cả không có tụt huyết áp.(8) Khái niệm sử dụng “treatment package” trong nghiên cứu của Jansen và cộng sự(7) trong giai đoạn sớm hồi sức (8 giờ đầu nhập ICU) gần đây được xác nhận trong một nghiên cứu về tỉ lệ sống sót trong septic shock. Hernandez và cộng sự(9) đánh giá tỉ lệ bình thường hóa của lactate và cho thấy tồn tại đường cong hai pha. Trong vài giờ đầu (6 giờ đầu), bình thường hoá nồng độ lactate nhanh chóng sau điều trị ban đầu. Trong pha 2 (lên đến 24 giờ), bình thường hoá lactate chậm hơn. Cuối cùng, 50% bệnh nhân (tất cả những trẻ còn sống) có tăng lactate trong 24 giờ sau điều trị ban đầu. Các tác giả đã suy đoán rằng, trong giai đoạn đầu của sepsis, nồng độ lactate đáp ứng nhanh chóng khi cải thiện cung cấp oxy mô (chịu ảnh hưởng chủ yếu nhờ tăng cung lượng tim qua bù dịch và cải thiện áp lực tưới máu bằng vận mạch). Do đó giai đoạn này có thể đại diện cho pha tăng lactate phụ thuộc dòng máu, trong khi pha sau tăng lactate có thể do nhiều yếu tố khác. Điều này cho phép đi đến kết luận thứ hai về việc sử dụng lactate trên bệnh nhân sepsis: Tăng nồng độ lactate nên được coi là hậu quả của oxy hoá mô không đủ trong giai đoạn đầu của sepsis. Ngoài ra, việc tiếp tục đưa nồng độ lactate của bệnh nhân về bình thường bằng cách tiếp tục hồi sức đảm bảo tưới máu/oxy hoá mô có thể không hiệu quả nữa.
Mục tiêu sau cùng trong hồi sức là phục hồi tưới máu vi tuần hoàn, không phải là huyết động đại tuần hoàn.(10) Tuy nhiên, các guidelines/protocols hiện tại hầu hết vẫn hướng tới các thông số đại tuần hoàn, như huyết áp, bù dịch tích cực. Mặc dù các thử nghiệm gần đây sử dụng EGDT (early goal directed therapy) không cho thấy lợi ích trong chăm sóc thông thường,(11) chúng tôi nên nhận ra việc hồi sức bệnh nhân sepsis có thay đổi đáng kể. Trong các nghiên cứu EGDT gần đây, bù dịch hồi sức trên phần lớn bệnh nhân. Kể cả trong nghiên cứu lactate của Jansen và cộng sự,(7) lactate levels có quỹ đạo giống hệ nhau ở nhóm bệnh nhân đối chứng so với nhóm bệnh nhân theo phác đồ, mặc dù thực tế các nhóm điều trị không biết về nồng độ thật sự. Điều này mang lại một câu hỏi liên quan: Nếu nồng độ lactate không khác biệt giữa hai nhóm, tại sao bệnh nhân ở nhóm định hướng lactate có tỉ lệ sống sót cao hơn? Trung bình, bệnh nhân trong nhóm protocol được truyền với khoảng >= 500 mL dịch trong giai đoạn điều trị và dưới 1L dịch trong giai đoạn theo dõi (8-72 giờ sau điều trị ban đầu). Ngoài ra, sử dụng nitroglycerin để cải thiện tưới máu vi tuần hoàn nhiều hơn trong nhóm protocol so với nhóm chứng (43% so với 20% bệnh nhân). Mặc dù điều này không gây ra sự khác biệt về nồng độ lactate, nhưng sự điều chỉnh trong điều trị có thể tác động đáng kể trên bệnh nhân đã được bù nhiều dịch và vận mạch nhưng vẫn không cải thiện được lactate (giảm 20% trong 2 giờ ở nhóm protocol). Thứ hai, dùng ít dịch hơn trong giai đoạn theo dõi có thể giúp giảm tỉ lệ bệnh tật liên quan đến quá tải dịch.
Một khía cạnh, liên quan đến một nhận xét được đưa ra trước đó, không được ghi lại trong nghiên cứu. Mục tiêu là giảm lactate ít nhất 20% trong 2 giờ; khi không đạt được mục tiêu này, nên đánh giá lại phương án điều trị, và ở một số bệnh nhân có thể làm thêm các cận lâm sàng (siêu âm, chụp CT….) và thay đổi điều trị.
Do đó, với những lập luận trên, chúng ta có thể kết luận rằng, ở bệnh nhân sepsis, hồi sức sớm nhằm mục đích cải thiện cân bằng giữa cung và cầu oxy, do đó phục hồi quá trình oxy hoá mô bằng tiếp cận đa phương thức có hiệu quả trong cải thiện tỉ lệ sống sót. Một số yếu tố quan trọng được xét đến khi sử dụng cách tiếp cận này. Đầu tiên, tiếp cận này nên sử dụng trong thời gian hạn chế (bằng chứng hiện tại gợi ý 6-8 giờ). Mặc dù các nghiên cứu ban đầu sử dụng mức lactate trên 3 mmol/L, nhưng các nghiên cứu cho thấy phác đồ này có thể hiệu quả ở tất cả bệnh nhân sepsis có tăng lactate (trên 2 mmol/L).
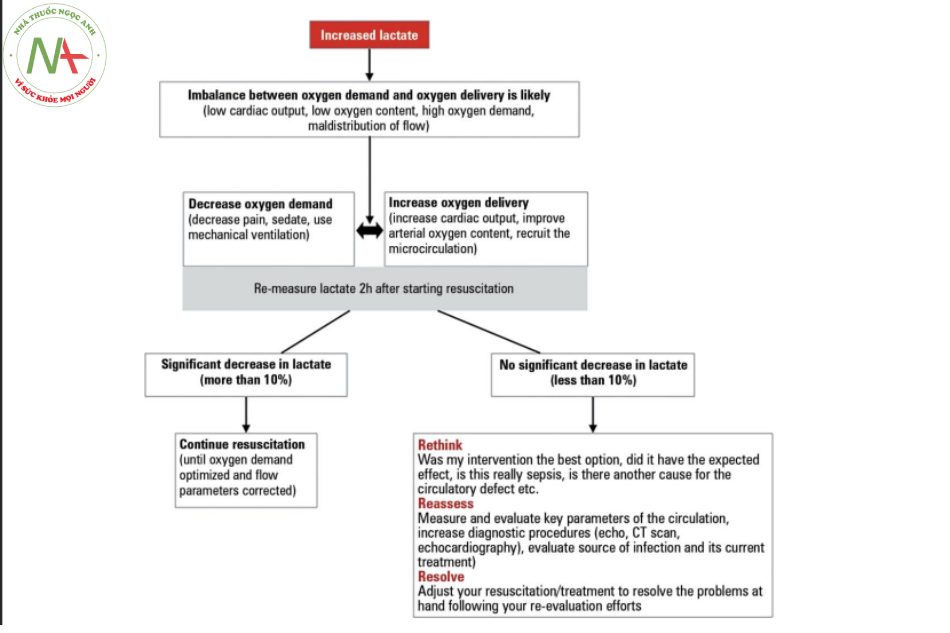
Sau khi bắt đầu hồi sức, nồng độ lactate nên giảm xuống nhanh chóng nếu cân bằng được oxy cung và cầu (Hình 1). Do đó, đo thường xuyên (ít nhất mỗi 2 giờ) nên được đưa vào trong protocol. Nếu lactate không giảm nhanh sau điều trị, NGHĨ LẠI, ĐÁNH GIÁ LẠI VÀ GIẢI QUYẾT hay RETHINK, REASSESS & RESOLVE.
TÀI LIỆU THAM KHẢO
- Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, Sevransky JE, Sprung CL, Douglas IS, Jaeschke R, Osborn tM, Nunnally ME, Townsend SR, Reinhart K, Kleinpell RM, Angus DC, Deutschman CS, Machado FR, Rubenfeld GD, Webb SA, Beale RJ, Vincent JL, Moreno R; Surviving Sepsis Campaign Guidelines Committee including the Pediatric Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 2013;41(2):580-637.
- Casserly B, Phillips GS, Schorr C, Dellinger RP, Townsend SR, Osborn TM, et al. Lactate measurements in sepsis-induced tissue hypoperfusion: results from the Surviving Sepsis Campaign database. Crit Care Med. 2015;43(3): 567-73.
- Cecconi M, De Backer D, Antonelli M, Beale R, Bakker J, Hofer C, et al. Consensus on circulatory shock and hemodynamic monitoring. Task force of the European Society of Intensive Care Medicine. Intensive Care Med. 2014;40(12):1795-815.
- Tapia P, Soto D, Bruhn A, Alegría L, Jarufe N, Luengo C, et al. Impairment of exogenous lactate clearance in experimental hyperdynamic septic shock is not related to total liver hypoperfusion. Crit Care. 2015;19(1):188.
- Bakker J, Nijsten MW, Jansen TC. Clinical use of lactate monitoring in critically ill patients. Ann Intensive Care. 2013;3(1):12.
- Vincent JL, Quintairos E Silva A, Couto L Jr, Taccone FS. The value of blood lactate kinetics in critically ill patients: a systematic review. Crit Care. 2016;20(1):257.
- Jansen TC, van Bommel J, Schoonderbeek FJ, Sleeswijk Visser SJ, van der Klooster JM, Lima AP, Willemsen SP, Bakker J; LACTATE study group. Early lactate-guided therapy in intensive care unit patients: a multicenter, open-label, randomized controlled trial. Am J Respir Crit Care Med. 2010;182(6):752-61.
- Puskarich MA, Illich BM, Jones AE. Prognosis of emergency department patients with suspected infection and intermediate lactate levels: a systematic review. J Crit Care. 2014;29(3):334-9.
- Hernandez G, Luengo C, Bruhn A, Kattan E, Friedman G, Ospina-Tascon GA, et al. When to stop septic shock resuscitation: clues from a dynamic perfusion monitoring. Ann Intensive Care. 2014;4:30.
- Dunser MW, Takala J, Brunauer A, Bakker J. Re-thinking resuscitation: leaving blood pressure cosmetics behind and moving forward to permissive hypotension and a tissue perfusion-based approach. Crit Care. 2013;17(5):326.
- Angus DC, Barnato AE, Bell D, Bellomo ‘ R, Chong CR, Coats TJ, et al. A systematic review and meta-analysis of early goal-directed therapy for septic shock: the ARISE, ProCESS and ProMISe Investigators. Intensive Care Med. 2015;41(9):1549-60.
- Legrand M, Dupuis C, Simon C, Gayat E, Mateo J, Lukaszewicz AC, et Association between systemic hemodynamics and septic acute kidney injury in critically ill patients: a retrospective observational study. Crit Care. 2013;17(6):R278.
- Vellinga NA, Ince C, Boerma EC. Elevated central venous pressure is associated with impairment of microcirculatory blood flow in sepsis: a hypothesis generating post hoc analysis. BMC Anesthesiol. 2013; 13:17.
- Kelm DJ, Perrin JT, Cartin-Ceba R, Gajic O, Schenck L, Kennedy CC. Fluid overload in patients with severe sepsis and septic shock treated with early goal-directed therapy is associated with increased acute need for fluid- related medical interventions and hospital death. Shock. 2015;43(1):68-73.