Thẩm mỹ - Làm đẹp
Kỹ thuật ghép mỡ vùng mặt: Nguyên lý và một số quan niệm chung
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tác giả: Jose Maria Serra-Renom
Biên dịch: Thạc sĩ – Bác sĩ Đinh Công Phúc
nhathuocngocanh.com – Bài viết Kỹ thuật ghép mỡ vùng mặt: Nguyên lý và một số quan niệm chung được trích từ chương 3 sách Kỹ thuật ghép mỡ ở vùng mặt. Căng da mặt đường mổ nhỏ.
Thiếu hụt tổ chức mô mềm và không đối xứng là tình trạng hay gặp và cũng là một thách thức cho các bác sĩ phẫu thuật trong thực hành lâm sàng. Để khắc phục những vấn đề này, các kỹ thuật phẫu thuật áp dụng để có được tổ chức mô khỏe mạnh từ các vùng cơ thể khác. Ngoài ra, một loạt các chất liệu làm đầy có sẵn để sử dụng; tuy nhiên, mặc dù kết quả ngắn hạn có thể đạt được là tốt với phần lớn các chất làm đầy, một số trong số đó có liên quan đến các biến chứng đáng kể như trồi chất liệu hoặc di chuyển chất liệu được tiêm, phản ứng quá mẫn và nhiễm trùng [1, 2].
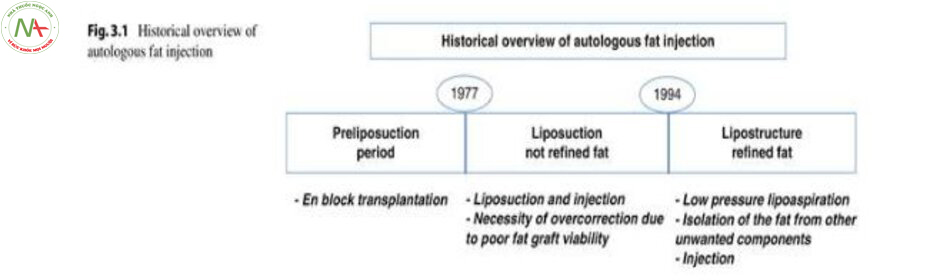
Ý tưởng cố gắng tái tạo những thiếu hụt với chất liệu tương tự hoặc tương đồng theo một trong các nguyên lí của Converse đã khiến nhiều bác sĩ phẫu thuật muốn dùng thử việc ghép mỡ tự thân như chất làm đầy filler. Sự phát triển của ghép mỡ này đã có sự thay đổi kể từ khi ra đời của kỹ thuật hút mỡ chuẩn , sau đó là ghép mỡ cấu trúc vào cuối những năm 1990 (Hình 3.1)[3].
Kể từ khi tác giả Coleman đã chuẩn hóa mô tả kỹ thuật hút mỡ [4, 5], rất nhiều ứng dụng lâm sàng đã được báo cáo để tăng thể tích và cải thiện chất lượng tổ chức [6], như trong trường hợp mô bị chiếu xạ sau phẫu thuật ung thư vú [7] hoặc đầu và cổ [8]. Tuy nhiên, mỡ cũng thường được nghiên cứu trong lĩnh vực kỹ thuật mô như một nguồn tế bào phong phú với khả năng tái sinh cao [9].
Mỡ tạo nên nhiều lợi thế như là một chất làm đầy. Nó như là một chất liệu ghép tự thân, không gây độc hại, tương thích sinh học, không gây bệnh, và không gây dị ứng, và không di chuyển chỗ khác. Nó có đặc điểm tương tự như đặc điểm vật lý của mô được cấy ghép, và kỹ thuật lấy mỡ là đơn giản bằng cách sử hút mỡ có áp lực thấp. Nó cũng tương đối rẻ tiền. Một lợi thế khác cần xem xét khi sử dụng ghép mỡ như một chất làm đầy là khả năng vốn có của nó để cải thiện chất lượng của các mô và da, làm trẻ hóa những vùng được tiêm.
Khoảng 30% tế bào mỡ hút ra là tế bào mỡ đã trưởng thành. Hai phần ba còn lại là hình thành từ các tế bào rất đa dạng, còn được gọi là phân đoạn mạch máu (SVF), chủ yếu bao gồm nguyên bào sợi, sợi mô liên kết, tế bào nội mô và tế bào tiền thân của chúng, tế bào điều hòa miễn dịch (ví dụ, đại thực bào, tế bào lympho) và tế bào gốc có nguồn gốc từ mỡ (ADSCs) [10].Tuy nhiên, nhược điểm của mỡ là một phần mỡ bị tiêu đi. Là một chất liệu ghép có được nuôi chất dinh dưỡng thông qua khuếch tán huyết tương từ khi bắt đầu cấy ghép cho đến khi phục hồi mạch máu, một số tế bào của nó sẽ trải qua quá trình tự chết. Vấn đề này đã được ng-hiên cứu sâu bởi Eto và cộng sự. [11] và Kato et al. [12]. Những tác giả này mô tả ba vùng trong mỗi syringe tiêm: phần ngoài cùng, tiếp xúc trực tiếp với vùng tiếp nhận và được gọi là khu vực sống sót; một vùng ở giữa đượcgọi là vùng tái sinh; và vùng trong cùng gọi là vùng hoại tử.
Trong vùng sống sót, cả tế bào mỡ và ADSC đều sống sót. Trong vùng tái sinh, các tế bào mỡ trải qua quá trình tự chết, nhưng các ADSC vẫn sống sót vì chúng tiếc ra chất chống tình trạng thiếu oxy. Các tế bào mỡ tự chết tiếc ra một loạt các tín hiệu cho các ADSC để bắt đầu quá trình biệt hóa và tăng sinh để trở thành tế bào mỡ tiền thân và sau đó là các tế bào mỡ trưởng thành. Tuy nhiên, trong vùng hoại tử, cả tế bào mỡ và ADSC đều chết; không có tế bào thay thế, và vùng này sẽ hình thành nên mô sẹo hay u nang dạng dầu.
Chính xác để tăng khả năng duy trì thể tích tiêm và sự sống sót của mỡ ghép, nhiều bác sĩ phẫu thuật đã cố gắng làm giàu mỡ bằng các tế bào SVF [13] hoặc bằng cách sử dụng các chiến lược phát triển khác như huyết tương giàu tiểu cầu (PRP) [14], cải thiện các điều kiện trong vùng tiếp nhận mỡ [15] hoặc ng-hiên cứu từng giai đoạn chuẩn bị của nó.
Với số lượng ngày càng tăng của dữ liệu thực nghiệm và lâm sàng liên quan đến các khía cạnh kỹ thuật, chúng tôi sẽ xem xét ngắn gọn việc chuẩn bị mỡ từ khi lấy cho đến khi tiêm.
Lấy mỡ
Lựa chọn vị trí lấy mỡ
Theo y văn hiện tại [16 -22]
|
Lấy mỡ dễ dàng và an toàn không phải là tiêu chí duy nhất để thực hiện chú ý trong việc lựa chọn vùng lấy mỡ: sự tăng cường các đường cong của bệnh nhân cũng nên xem xét. Khi đã quyết định lấy mỡ từ vùng chi dưới hoặc bên sườn,cũng cần phải chú ý hút mỡ ở bên đối diện để cho đối xứng.
Các vết mổ để lấy mỡ nên rạch ở các vết sẹo có trước hoặc nếp gấp da tự nhiên hoặc các vị trí bị che khuất bởi quần áo (tốt nhất là những vùng che khuất bởi đồ lót).
Nói chung, và đặc biệt là khi lấy mỡ để ghép cho vùng mặt thì nên lấy khối lượng mỡ nhỏ hơn yêu cầu chúng tôi cố gắng sử dụng các vị trí bất thường ít hoặc vùng lấy mỡ sẽ không gây chú ý cho bệnh nhân.
Mặt trong của đầu gối và đùi là những ví dụ điển hình; ngược lại, với những bất thường ở bụng thì rất dễ nhìn thấy. Bên trong của đầu gối và đùi là vị trí ở phụ nữ cơ bắp hoặc gầy có xu hướng lượng mỡ cao.
Dung dịch tumescent
Theo y văn hiện tại
|
Có thể thực hiện ghép mỡ dưới gây mê nội khí quản, tê tủy sống, hoặc gây tê tại chỗ có hoặc không có thuốc giảm đau.
Khi thực hiện phẫu thuật dưới gây tê tại chỗ, vùng lấy mỡ sẽ bôi thuốc tê tại chỗ khoảng 2h trước khi phẫu thuật lấy mỡ (chỉ định khi khám bệnh nhân trước phẫu thuật). Dung dịch tumescent chứa 0,05% lido-caine trong dung dịch muối và epinephrine 1: 200.000.
Khi thực hiện kỹ thuật dưới gây mê nội khí quản, dung dịch tumescent có thể pha loãng với thuốc co mạch trong dung dịch nước muối sinh lí hoặc bằng cách thêm nồng độ thấp thuốc gây tê tại chỗ (ưu tiên của tác giả là 0,02% lidocaine).
Chích dung dịch tumes-cent nên thực hiện chậm từ từ, tránh di chuyển đột ngột để đảm bảo sự thoải mái tối đa cho bệnh nhân, đặc biệt là khi gây mê và không sử dụng thuốc giảm đau an thần. Nói chung, thể tích dịch chích vào sẽ thường tương đương với thể tích mỡ được hút ra (tỷ lệ 1: 1).
Việc hút mỡ được bắt đầu sau khi chờ khoảng 20 phút dung dịch tumescent có hiệu lực.
Chọn cannula để lấy mỡ
Theo y văn hiện tại29-34
|
Phải có sẵn nhiều cannu-la với nhiều kích cỡ khác nhau, có 1 lỗ hay nhiều lỗ để hút lấy mỡ với đầu cannula nhiều lỗ đầu cùn hay 1 lỗ đầu vát.
Để có được phương pháp ghép mỡ cấu trúc hoặc ghép mỡ macrofat, thường sử dụng ống hút 3 mm. Nếu mục đích là để có được mảnh ghép microfat, cho dù họ tiêm bằng cannula hoặc tiêm bằng kim (trong trường đầu kim nhọn có thể tiêm mỡ vào trong da (SNIF)), khi hút mỡ bằng cannula microport 2,4 mm thì chích mỡ bằng cannula 1 mm có đầu vát là rất hữu ích. Hiện tại, hai công ty thương mại để sản xuất chúng:
Tulip Medical Products (San Di-ego, CA) và Wells Johnson (Tuc-son, AZ).
Hút mỡ
Theo y văn hiện tại [35 -44]
|
Trong thực tế hàng ngày của chúng ta, khi cần lấy một lượng nhỏ để ghép, chúng tôi sử dụng ống syringe cầm tay kết nối với syringe 10 ml có khóa của Luer. Dùng syringe để hút mỡ thì áp lực húc 0,37 atm. Nếu khi cần một số lượng lớn mỡ, chúng tôi thực hiện hút bằng máy hút áp lực âm, áp lực hút lúc này thấp (0,5 atm).
Để tránh những bất thường trong vùng hút lấy mỡ và có kết quả tốt nhất có thể trong vùng cho mỡ thì cần lưu ý những điểm sau:
- Trong quá trình hút mỡ, nên thay đổi vị trí hút và hướng của đầu ống hút và đi qua các đường hút từ hai đường rạch da khác nhau ở bất kỳ vị trí nào có thể.
- Sau khi hút mỡ, và sau khi quá trình chiết tách mỡ hoàn thành, nên dùng cannula để đẩy qua lại vị trí cho mỡ mà không hút mỡ ra, trước khi khâu các vết rạch da bằng khâu mũi rời với chỉ 5-0.
Kỹ thuật xử lí mỡ
| Theo y văn hiện tại [45 -60]
Các kỹ thuật xử lý mỡ ghép như: ly tâm, lọc, rửa và lăn Telfa. Khi đã đánh giá tất cả các khía cạnh, không có một kỹ thuật nào là vượt trội rõ ràng hơn so với kỹ thuật khác. Vẫn còn có một mức độ chưa chuẩn lắm vì kết quả không đồng nhất trên động vật và trên người Khi chúng ta ly tâm mỡ, một số nghiên cứu cho thấy là quay 3000 vòng/phút (1.200g) sẽ gây ra tổn thương tế bào nhiều hơn. Để xác định số thiết lập số lượng mỡ cần ghép, cần biết được cần phải quay ly tâm mỡ bao nhiêu vòng/phút. |
Kỹ thuật xử lý mỡ là nhằm mục đích phân lập mỡ đã hút từ hỗn hợp dầu, máu và các mảnh vụn và các thành phần khác không mong muốn của dung dịch tumescent. Đây là điều rất quan trọng vì những yếu tố này có thể ảnh hưởng xấu đến khả năng sống sót và duy trì của mảnh mỡ ghép. Để phân lập mỡ thì nên theo các bước sau:
Ly tâm
Chưa có sự thống nhất về quay ly tâm bao nhiêu vòng/phút và bao nhiêu phút cho hợp lí. Coleman [4, 5] đã báo cáo là quay khoảng ‘3000 vòng / phút trong 3 phút, trong khi chúng tôi chỉ sử dụng 2000 vòng / phút trong 2 phút.
Sau khi ly tâm, chúng ta nhìn ống mỡ thì thấy 3 mức: Dưới cùng là chứa máu và mảnh vụn, nước và các thành phần của dung dịch tumescent; ở lớp giữa bao gồm mỡ để tiêm; và trên cùng bao gồm các sản phẩm của axit béo.
Để tách các sản phẩm thuộc về máu thì chúng ta mở cuối syringe ra thì hỗn dịch này sẽ chảy ra hết. Các sản phẩm axit béo ở trên cùng thì có thể nghiên syringe để đổ ra, và nếu cần thiết có thể loại bỏ bằng cách dùng một miếng gạc lót nhỏ. Phương pháp như trên là có thể tách lấy phần mỡ cần tiêm được dễ dàng sau khi ly tâm.
Rửa và lọc mỡ
Trong kỹ thuật này, mỡ sẽ được tách ra khỏi các thành phần khác bằng cách sử dụng dung dịch nước muối sinh lí để rửa và lọc mỡ. Cả hai cách lọc mỡ kín và lọc mỡ mở cũng đã được báo cáo.
Rửa và chiết tách
Để rửa và gạn lấy mỡ, chúng tôi thích rửa xoay vòng kín. Chúng tôi hút 5 ml mỡ + 4 ml dung dịch nước muối sinh lí vào ống tiêm. Sau khi gạn lấy mỡ và loại bỏ những chất nổi ở lớp trên, chúng tôi lặp lại thao tác cho đến khi thu được mỡ cô đặc.
Trộn Telfa
Kỹ thuật này bao gồm đổ mỡ đã hút vào miếng băng lớn Telfa không cố định. Mỡ sẽ nhẹ nhàng lăn và nhào quanh gạc rồi chuyển trở lại một lần nữa vào ống tiêm.
Khi đã thu được mỡ, thì chuyển mỡ vào syringe 1 ml thông qua đầu nối chuyển khóa Luer
Tiêm mỡ
Theo y văn hiện tại [33, 61- 64]
|
Một số tác giả coi thời điểm tiêm là phần quan trọng nhất của kỹ thuật.
Nói chung, và khi tổ chức cần ghép mỡ không bị xơ hóa, nên dùng cannula đầu tù để tiêm mỡ. Tuy nhiên, khi có sẹo co rút hoặc xơ hóa, thì nên sử dụng kim sắc nhọn để tách tổ chức trước khi tiêm mỡ mục đích để tránh làm hỏng dây thần kinh, mạch hoặc cấu trúc giải phẫu khác. Trong trường hợp mà mỡ cần phải tiêm vào các mặt phẳng dưới da nông hơn, tiêm trực tiếp bằng kim cũng có thể hữu ích.
Mỗi lần tiêm thì nên tiêm một lượng nhỏ ít mỡ, là để tăng cường sự sống sót của mảnh ghép mỡ và sự tích hợp của mô mỡ được cấy vào vị trí nơi nhận.
Đầu tiên chúng tôi đẩy cannula mà không chích mỡ, sau đó chúng tôi rút cannula ngược lại và tiêm mỡ vào tổ chức. Điều này tạo ra một hiệu ứng như hạt trên vòng cổ, tạo ra một số mức độ tiêm, và kỹ thuật phải nên lặp đi lặp lại nhiều lần ở nhiều mặt phẳng. Điều đó cũng rất quan trọng để đưa mỡ vào các vùng khác nhau để tạo ra một mô hình mạng lưới hoặc chéo nhau và để làm các đường hầm ở tất cả mặt phẳng là để ngăn chặn sự tích tụ mỡ.
Tài liệu tham khảo
- Rzany B, DeLorenzi C. Understand-ing, avoiding, and managing severe filler complications. Plast Reconstr Surg. 2015;136(5 Suppl): 196S–203.
- Sorensen EP, Urman C. Cosmet-ic complications: rare and serious events following botulinum toxin and soft tissue filler administration. J Drugs Dermatol. 2015;14:486–91.
- Mojallal A, Foyatier JL. Historique de l’utilisation du tissu adipeux com-me produit de comblement en chiru-rgie plastique. Ann Chir Plast Esthet.2004;49:419–25.
- Coleman SR. Lipoinfi ltration in the upper lip white roll. Aesth Surg. 1994;14:231–4.
- Coleman SR. Long term survival of fat transplants: controlleddemonstrations. Aesthetic Plast Surg. 1995;19:421–5.
- Mazzola RF, Mazzola IC. History of fat grafting: from ram fat to stem cells. Clin Plast Surg. 2015;42:147–53.
- Serra-Renom JM, Muñoz-Olmo JL, Serra-Mestre JM. Fat grafting in postmastectomy breast reconstruc-tion with expanders and prostheses in patients who have received radio-therapy: formation of new subcu-taneous tissue. Plast Reconstr Surg. 2010;125:12–8.
- Karmali RJ, Nguyen AT, Skoracki RJ, et al. Outcomes following autologous fat grafting in head and neck onco-logic reconstruction. Plast Reconstr Surg. 2015;136(4 Suppl):49–50.
- Laschke MW, Menger MD. Ad-ipose tissue-derived microvascu-lar fragments: natural vasculariza-tion units for regenerative medicine. Trends Biotechnol. 2015;33:442–8.
- Avram AS, Avram MM, James WD. Subcutaneous fat in normal and diseased states: 2. Anatomy and physiology of white and brown ad-ipose tissue. J Am Acad Dermatol. 2005;53:671–83.
- Eto H, Kato H, Suga H, Aoi N, Doi K, Kuno S, Yoshimura K. The fate of adipocytes after nonvascularized fat grafting: evidence of early death and replacement of adipocytes. Plast Re-constr Surg. 2012;129:1081–92.
- Kato H, Mineda K, Eto H, Doi K, Kuno S, Kinoshita K, et al. Degeneration, regeneration, and cic-atrization after fat grafting: dynamic total tissue remodeling during the first 3 months. Plast Reconstr Surg. 2014;133:303e–13.
- Kakudo N, Tanaka Y, Morimoto N, Ogawa T, Kushida S, Hara T, Kusumo-to K. Adipose-derived regenerative cell (ADRC)-enriched fat grafting: op-timal cell concentration and effects on grafted fat characteristics. J Transl Med. 2013;11:254.
- Serra-Mestre JM, Serra-Renom JM, Martinez L, Almadori A, D’An-drea F. Platelet-rich plasma mixed-fat grafting: a reasonable prosurvival strategy for fat grafts? Aesthetic Plast Surg. 2014;38:1041–9.
- Forbes SJ, Rosenthal N. Preparing the ground for tissue regeneration: from mechanism to therapy. Nat Med. 2014;20:857–69.
- Rohrich RJ, Sorokin ES, Brown SA. In search of improved fat transfer vi-ability: a quantitative analysis of the role of centrifugation and harvest site. Plast Reconstr Surg. 2004;113:391–5.
- Ullmann Y, Shoshani O, Fodor A, Ramon Y, Carmi N, Eldor L, Gilhar A. Searching for the favorable donor site for fat injection: in vivo study us-ing the nude mice model. Dermatol Surg. 2005;31:1304–7.
- Padoin AV, Braga-Silva J, Martins P, Rezende K, Rezende AR, Grechi B, et al. Sources of processed lipoaspirate cells: influence of donor site on cell concentration. Plast Reconstr Surg. 2008;122:614–8.
- Kishi K, Imanishi N, Ohara H, Ni-nomiya R, Okabe K, Hattori N, et al. Distribution of adipose-derived stem cells in adipose tissues from human cadavers. J Plast Reconstr Aesthet Surg. 2010;63:1717.
- Lim AA, Fan K, Allam KA, Wan D, Tabit C, Liao E, et al. Autologous fat transplantation in the craniofacial pa-tient. J Craniofac Surg. 2012;23:1061–21.
- Li K, Gao J, Zhang Z, Li J, Cha P, Liao Y, et al. Selection of donor site for fat grafting and cell isolation. Aesthetic Plast Surg. 2013;37:153–8.
- Small K, Choi M, Petruolo O, Lee C, Karp N. Is there an ideal donor site of fat for secondary breast reconstruc-tion? Aesthet Surg J. 2014;34:545–50.
- Moore Jr JH, Kolaczynski JW, Mo-rales LM, Considine RV, Pietrzkow-ski Z, Noto PF, Caro JF. Viability of fat obtained by syringe suction li-pectomy: effects of local anesthesia with lidocaine. Aesthetic Plast Surg. 1995;19:335–9.
- Kim IH, Yang JD, Lee DG, Chung HY, Cho BC. Evaluation of centrifu-gation technique and effect of epi-nephrine on fat cell viability in au-tologous fat injection. Aesthet Surg J. 2009;29:35–9.
- Shoshani O, Berger J, Fodor L, Ra-mon Y, Shupak A, Kehat I, et al. The ef-fect of lidocaine and adrenaline on the viability of injected adipose tissue: an experimental study in nude mice. J Drugs Dermatol. 2005;4:311–6.
- Keck M, Zeyda M, Gollinger K, Bur-jak S, Kamolz LP, Frey M, Stulnig TM. Local anesthetics have a major im-pact on viability of preadipocytes and their differentiation into adipocytes. Plast Reconstr Surg. 2010;126:1500–5.
- Livaoğlu M, Buruk CK, Uraloğ-lu M, Ersöz S, Livaogğlu A, Sözen E, Agdoğan Ö. Effects of lidocaine plus epinephrine and prilocaine on autol-ogous fat graft survival. J Craniofac Surg. 2012;23:1015–8.
- Agostini T, Lazzeri D, Pini A, Mari-no G, Li Quattrini A, Bani D, Dini M. Wet and dry techniques for structural fat graft harvesting. Plast Reconstr Surg. 2012;130:331e–9.
- Shiffman MA, Mirrafati S. Fat trans-fer techniques: the effect of harvest and transfer methods on adipocyte viability and review of the literature. Dermatol Surg. 2001;27:819–26.
- Özsoy Z, Kul Z, Bilir A. The role of cannula diameter in improved adipo-cyte viability: a quantitative analysis. Aesthet Surg J. 2006;26:287–9.
- Erdim M, Tezel E, Numanoglu A, Sav A. The effects of the size of lipo-suction cannula on adipocyte surviv-al and the optimum temperature for fat graft storage: an experimental study. J Plast Reconstr Aesthet Surg. 2009;62:1210–4.
- Kirkham JC, Lee JH, Medina MA, McCormack MC, Randolph MA, Aus-ten Jr WG. The impact of liposuction cannula size on adipocyte viability. Ann Plast Surg. 2012;69:479–81.
- Nguyen PS, Desouches C, Gay AM, Hautier A, Magalon G. Development of micro-injection as an innovative autologous fat graft technique: the use of adipose tissue as dermal fill-er. J Plast Reconstr Aesthet Surg. 2012;65:1692–9.
- Alharbi Z, Opländer C, Almakadi S, Fritz A, Vogt M, Pallua N. Conven-tional vs. micro-fat harvesting: how fat harvesting technique affects tis-sue-engineering approaches using adipose tissue-derived stem/stromal cells. J Plast Reconstr Aesthet Surg. 2013;66:1271–8.
- Rohrich RJ, Morales DE, Krueger JE, Ansari M, Ochoa O, Robinson Jr J, Beran SJ. Comparative lipoplasty anal-ysis of in vivotreated adipose tissue. Plast Reconstr Surg. 2000;105:2152–8.
- Pu LL, Cui X, Fink BF, Cibull ML, Gao D. The viability of fatty tissue within adipose aspirates after conventional liposuction: a comprehensive study. Ann Plast Surg. 2005;54:288–92.
- Smith P, Adams Jr WP, Lipschitz AH, Chau B, Sorokin E, Rohrich RJ, Brown SA. Autologous human fat grafting: effect of harvesting and preparation techniques on adipocyte graft survival. Plast Reconstr Surg. 2006;117:1836–44.
- Pu LL, Coleman SR, Cui X, Fergu-son Jr RE, Vasconez HC. Autologous fat grafts harvested and refined by the Coleman technique: a compar-ative study. Plast Reconstr Surg. 2008;122:932–7.
- Crawford JL, Hubbard BA, Colbert SH, Puckett CL. Fine tuning lipoaspi-rate viability for fat grafting. Plast Re-constr Surg. 2010;126:1342–8.
- Lee JH, Kirkham JC, McCormack MC, Nicholls AM, Randolph MA, Aus-ten Jr WG. The effect of pressure and shear on autologous fat grafting. Plast Reconstr Surg. 2013;131:1125–36.
- Fisher C, Grahovac TL, Schafer ME, Shippert RD, Marra KG, Rubin JP. Comparison of harvest and process-ing techniques for fat grafting and ad-ipose stem cell isolation. Plast Recon-str Surg. 2013;132:351–61.
- Schafer ME, Hicok KC, Mills DC, Cohen SR, Chao JJ. Acute adipocyte viability after third-generation ultra-sound-assisted liposuction. Aesthet Surg J. 2013;33:698–704.
- Keck M, Kober J, Riedl O, Kitzing-er HB, Wolf S, Stulnig TM, et al. Pow-er assisted liposuction to obtain ad-ipose-derived stem cells: impact on viability and differentiation to adipo-cytes in comparison to manual aspiration. J Plast Reconstr Aesthet Surg. 2014;67:e1–8.
- Yin S, Luan J, Fu S, Wang Q, Zhuang Q. Does water-jet force make a differ-ence in fat grafting? In vitro and in vivo evidence of improved lipoaspi-rate viability and fat graft survival. Plast Reconstr Surg. 2015;135:127–38.
- Boschert MT, Beckert BW, Puckett CL, Concannon MJ. Analysis of lipo-cyte viability after liposuction. Plast Reconstr Surg. 2002;109:761–5; discussion 766–7.
- Butterwick KJ. Lipoaugmentation for aging hands: a comparison of the longevity and aesthetic results of cen-trifuged versus noncentrifuged fat. Dermatol Surg. 2002;28:987–91.
- Ramon Y, Shoshani O, Peled IJ, Gilhar A, Carmi N, Fodor L. Enhanc-ing the take of injected adipose tis-sue by a simple method for concen-trating fat cells. Plast Reconstr Surg. 2005;115:197–201.
- Rose JG, Lucarelli MJ, Lemke BN, Dortzbach RK, Boxrud CA, Obagi S, Pa-tel S. Histologic comparison of autolo-gous fat processing methods. Ophthal Plast Reconstr Surg. 2006;22:195–200.
- Kurita M, Matsumoto D, Shigeura T, Sato K, Gonda K, Harii K, et al. In-fluences of centrifugation on cells and tissues in liposuction aspirates: opti-mized centrifugation for lipotrans-fer and cell isolation. Plast Reconstr Surg. 2008;121:1033–41.
- Khater R, Atanassova P, Anastass-ov Y, Pellerin P, Martinot-Duquennoy V. Clinical and experimental study of autologous fat grafting after process-ing by centrifugation and serum la-vage. Aesthetic Plast Surg. 2009;33:37–43.
- Condé-Green A, de Amorim NF, Pitanguy I. Influence of decantation, washing and centrifugation on adi-pocyte and mesenchymal stem cell content of aspirated adipose tissue: a comparative study. J Plast Reconstr Aesthet Surg. 2010;63:1375–81.
- Condé-Green A, Baptista LS, de Amorin NF, de Oliveira ED, da Silva KR, Pedrosa Cda S. Effects of centrif-ugation on cell composition and via-bility of aspirated adipose tissue pro-cessed for transplantation. Aesthet Surg J. 2010;30:249–55.
- Xie Y, Zheng D, Li Q, Chen Y, Lei H, Pu LL. The effect of centrifugation on viability of fat grafts: an evaluation with the glucose transport test. J Plast Reconstr Aesthet Surg. 2010;63:482–7.
- Zhu M, Zhou Z, Chen Y, Schreiber R, Ransom JT, Fraser JK, et al. Sup-plementation of fat grafts with adi-pose-derived regenerative cells im-proves long-term graft retention. Ann Plast Surg. 2010;64:222–8.
- Minn KW, Min KH, Chang H, Kim S, Heo EJ. Effects of fat preparation methods on the viabilities of autolo-gous fat grafts. Aesthetic Plast Surg. 2010;34:626–31.
- Botti G, Pascali M, Botti C, Bodog F, Cervelli V. A clinical trial in facial fat grafting: filtered and washed versus centrifuged fat. Plast Reconstr Surg. 2011;127:2464–73.
- Ferraro GA, De Francesco F, Tiri-no V, Cataldo C, Rossano F, Nicoletti G, D’Andrea F. Effects of a new cen-trifugation method on adipose cell viability for autologous fat grafting. Aesthetic Plast Surg. 2011;35:341–8.
- Pulsfort AK, Wolter TP, Pallua N. The effect of centrifugal forces on viability of adipocytes in centri-fuged lipoaspirates. Ann Plast Surg. 2011;66:292–5.
- Hoareau L, Bencharif K, Girard AC, Delarue P, Hulard O, Festy F, et al. Ef-fect of centrifugation and washing on adipose graft viability: a new method to improve graft efficiency. J Plast Re-constr Aesthet Surg. 2013;66:712–9.
- Pfaff M, Wu W, Zellner E, Stein-bacher DM. Processing technique for lipofilling influences adipose-derived stem cell concentration and cell via-bility in lipoaspirate. Aesthetic Plast Surg. 2014;38:224–9.
- Dasiou-Plakida D. Fat injections for facial rejuvenation: 17 years ex-perience in 1720 patients. J Cosmet Dermatol. 2003;2:119–25.
- Trepsat F. Midface reshaping with micro-fat grafting. Ann Chir Plast Es-thet. 2009;54:435–43.
- Mazzola RF. Fat injection: from filling to regeneration. St. Louis: Qual-ity Medical Publishing; 2009. p. 373–422.
- Tonnard P, Verpaele A, Peeters G, Hamdi M, Cornelissen M, Declercq H. Nanofat grafting: basic re-search and clinical applications. Plast Reconstr Surg. 2013;132:1017–26.

