Bệnh Nhi khoa, Bệnh hô hấp
Hội chứng nguy kịch hô hấp cấp tính ở trẻ em: Các phương pháp tiếp cận thông khí cơ học
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Hội chứng nguy kịch hô hấp cấp tính ở trẻ em: Các phương pháp tiếp cận thông khí cơ học tải về file pdf ở đây.
Bài dịch: BS. Đặng Thanh Tuấn – Khoa Hồi sức ngoại – BV Nhi Đồng 1
Hội chứng nguy kịch hô hấp cấp tính ở trẻ em (Pediatric Acute Respiratory Distress Syndrome – PARDS) là do sự phá vỡ hàng rào phế nang-mao mạch không có nguồn gốc từ tim mạch. Tổn thương có thể xảy ra trực tiếp với biểu mô phế nang (tức là PARDS nguyên phát do viêm phổi) hoặc gián tiếp đến nội mô mao mạch do viêm hệ thống (tức là PARDS thứ phát do nhiễm trùng huyết). Về mặt lâm sàng, PARDS là một bệnh phổi hạn chế, được đặc trưng bởi tình trạng thiếu oxy máu, các hình ảnh thâm nhiễm trên phim chụp X quang, giảm thể tích phổi cuối thì thở ra (end-expiratory lung volume – EELV), giảm độ giãn nở của phổi và tăng khoảng chết phế nang. Bài đánh giá sinh lý học ngắn gọn về y học chăm sóc tích cực cho trẻ em này tập trung vào các chiến lược thông khí nhằm cải thiện sự an toàn của thở máy (mechanical ventilation – MV) ở bệnh nhân mắc PARDS.
CƠ SỞ LÝ LUẬN NỀN TẢNG CÁC CHIẾN LƯỢC THỞ MÁY TRONG PARDS
Nguyên nhân phổ biến nhất của PARDS là viêm phổi do virus, mặc dù có thể có các nguyên nhân khác như viêm phổi do vi khuẩn, nhiễm trùng huyết, chấn thương, hít sặc và truyền máu (1–4). Trong quá trình tiến triển của hội chứng này, hai giai đoạn bệnh lý thường chồng lên nhau theo thời gian và theo vùng trong phổi. Ví dụ, Hình 1 minh họa một tiến trình theo thời gian của PARDS. Giai đoạn “xuất tiết” sớm được đặc trưng bởi rối loạn chức năng hàng rào phế nang-mao mạch dẫn đến thay đổi tính thấm của các tế bào biểu mô và nội mô phế nang. Mất tính toàn vẹn của tế bào phế nang, với phù nề protein ở phế nang, kết hợp với tổn thương liên quan đến máy thở và không thể sửa chữa tổn thương phổi, sau đó báo trước giai đoạn “tăng sinh xơ hóa” và tiếp theo là những thay đổi xơ hóa trong phổi (5).
Do đó, các nguyên tắc điều trị cơ bản trong quản lý bệnh nhân trong PARDS từ trung bình đến nặng, nói chung, nhằm mục đích sau: sử dụng MV kịp thời với huyết động ổn định và ngăn ngừa quá tải dịch, giảm thiểu bơm phồng theo chu kỳ thở trong khi đạt được sự đồng bộ đầy đủ giữa bệnh nhân và máy thở, duy trì tổng quát sức mạnh cơ bắp và cơ hoành, đồng thời ngăn ngừa bệnh tật mới. Cuối cùng, mặc dù cơ học phổi trong PARDS chủ yếu là hạn chế, nhưng điều quan trọng là phải xác định xem có thành phần gây tắc nghẽn hay không, vì các phương pháp điều trị bằng thuốc và thông khí có thể trái ngược nhau. Hình 2 minh họa một phương pháp sử dụng dạng sóng MV để phân biệt giữa suy hô hấp cấp hạn chế và tắc nghẽn.
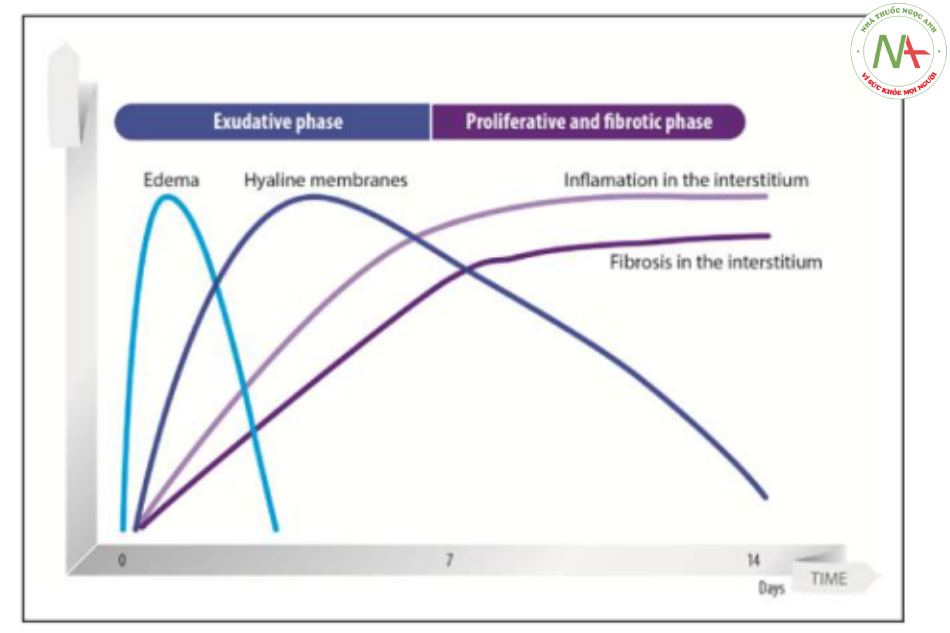
Giai đoạn sớm xuất tiết được đặc trưng bởi rối loạn chức năng hàng rào mao mạch phế nang dẫn đến thay đổi tính thấm của các tế bào biểu mô và nội mô phế nang. Do mất tính toàn vẹn của tế bào, các phế nang bị phù protein, làm giảm dung tích cặn chức năng và trao đổi khí. Sự phân bố của thể tích bị bơm phồng sẽ phụ thuộc vào độ dốc dọc do trọng lực áp đặt, xác định các vùng không phụ thuộc và phụ thuộc. Tổn thương dai dẳng và không thể sửa chữa tổn thương phổi góp phần vào phản ứng tăng sinh xơ hóa bệnh lý, dẫn đến những thay đổi rõ rệt về cấu trúc và chức năng của phổi.
CƠ CHẾ SINH HỌC CỦA TỔN THƯƠNG PHỔI: STRESS, STRAIN, VÀ HUY ĐỘNG THEO CHU KỲ THỞ
Về mặt cơ học, phổi có thể được mô tả như một mạng lưới dự ứng lực (prestressed network) gồm các thành phần mô đàn hồi nhớt bị biến dạng do sức căng bề mặt và hoạt động của các cơ hô hấp. Những đặc điểm này cho phép biến dạng phụ thuộc vào thời gian trong quá trình hít vào và quay trở lại cấu hình ban đầu trong khi thở ra (6). Do đó, thở tự nhiên (spontaneous breathing – SB) tạo ra hiện tượng biến dạng theo chu kỳ liên tục trong phổi, trong đó áp lực tác dụng là áp lực xuyên phổi (transpulmonary pressure – PTP). Theo thuật ngữ cơ sinh học, biến dạng trong phổi được đo bằng “strain”, có thể được định nghĩa cho toàn bộ phổi bằng tỷ lệ giữa thể tích khí lưu thông (tidal volume – Vt) và thể tích tham chiếu (chẳng hạn như EELV). Lực trên một đơn vị diện tích tạo ra strain này được gọi là “stress” (nghĩa là PTP tương ứng với stress của phổi). Kết hợp lại với nhau, các mối quan hệ cơ học sinh học này có thể được sử dụng để xác định mô đun Young của mô đàn hồi phổi, để đo biến dạng đàn hồi (elastic deformation) có thể đảo ngược và để xác định ngưỡng biến dạng chất dẻo (plastic deformation) có hại. Không có gì đáng ngạc nhiên, stress và strain phổi đều được coi là các thông số chính trong quá trình khởi phát và phát triển tổn thương phổi do thở máy (ventilator-induced lung injury – VILI) ở người lớn bị bệnh nặng (7–10). Hơn nữa, ở người lớn mắc hội chứng suy hô hấp cấp tính (ARDS), strain tổng thể (global strain) cao hơn trong MV có liên quan đến tỷ lệ tử vong tăng lên và kết quả cải thiện xảy ra ở những bệnh nhân có Vt thấp trong MV (11), dẫn đến giảm strain tổng thể.
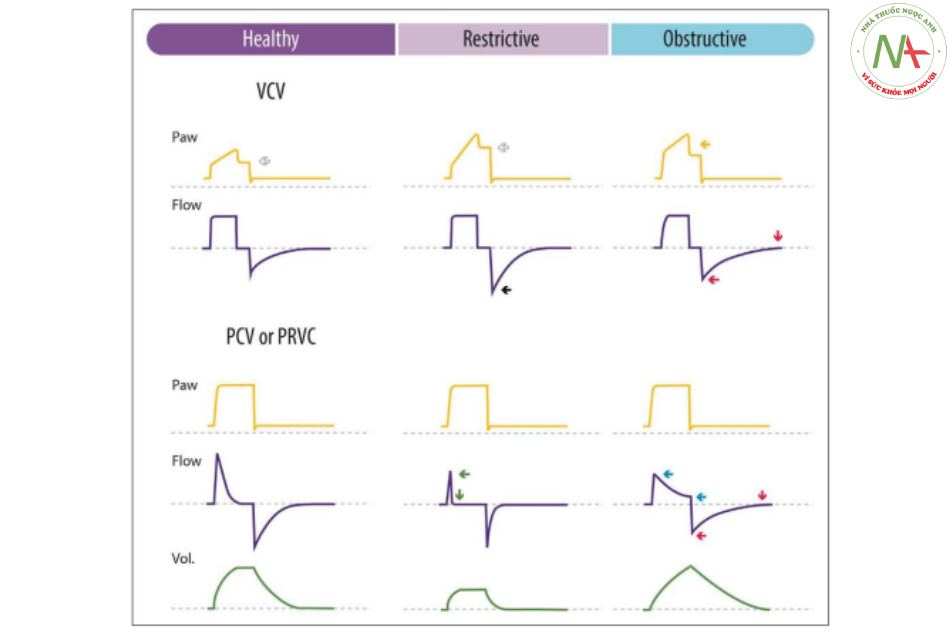
Sóng hít vào: thông khí kiểm soát thể tích (VCV): áp lực hít vào đỉnh (PIP) – áp lực bình nguyên (Pplat) thấp (< 6 cm H2O, mũi tên trắng) ở bệnh nhân hạn chế và cao ở bệnh nhân tắc nghẽn (> 10 cm H2O, mũi tên vàng). Thông khí kiểm soát áp lực (PCV) và kiểm soát thể tích điều chỉnh áp lực (PRVC): lưu lượng hít vào đỉnh cao và giảm thời gian hít vào ở bệnh nhân hạn chế (mũi tên xanh). Lưu lượng hít vào đỉnh thấp và tăng thời gian hít vào ở bệnh nhân tắc nghẽn (mũi tên xanh). Sóng thở ra: Tất cả các chế độ: lưu lượng thở ra đỉnh cao và giảm thời gian thở ra ở bệnh nhân hạn chế (mũi tên đen). Lưu lượng đỉnh thở ra thấp, thời gian thở ra tăng và áp lực dương cuối kỳ thở ra nội sinh ở bệnh nhân tắc nghẽn (mũi tên đỏ).
Siêu bơm phồng theo chu kỳ thở (tidal hyperinflation) và mở và xẹp theo chu kỳ của các đơn vị phổi có thể huy động trong quá trình thông khí theo chu kỳ thở (huy động theo chu kỳ thở bình thường) là những yếu tố quan trọng góp phần vào sự phát triển của VILI (12–14). Trong môi trường lâm sàng, huy động theo chu kỳ thở (tidal recruitment) rất khó phát hiện đặc biệt là chụp CT độ phân giải cao được coi là phương pháp tiêu chuẩn vàng để đánh giá. Tuy nhiên, một cách tiếp cận khác để đánh giá siêu bơm phồng theo chu kỳ thở – dễ thích nghi hơn với bối cảnh lâm sàng – là kiểm tra “Chỉ số căng thẳng”, (Stress Index) dựa trên hình dạng của đường cong biểu thị áp lực đường thở theo thời gian trong lưu lượng không đổi (15, 16). Đường cong này có thể phù hợp với một phương trình năng lượng (power equation), trong đó áp lực đường thở = a × timeb + c. Giá trị của hệ số b (chỉ số căng thẳng) và siêu bơm phồng theo chu kỳ thở có mối tương quan đáng kể (17). Khi b bằng 1, hình dạng của đường cong là một đường thẳng; khi b nhỏ hơn 1, đường cong có dạng lồi; và khi b lớn hơn 1, đường cong có dạng lõm. Siêu bơm phồng theo chu kỳ thở không đáng kể khi chỉ số căng thẳng thay đổi từ 0,9 đến 1,1, nhưng nó tăng theo cấp số nhân nếu chỉ số căng thẳng lớn hơn 1,1 (17). Ở những bệnh nhân mắc ARDS, chỉ số căng thẳng nhạy cảm và cụ thể hơn so với áp lực cao nguyên (Pplat, xem phần Tốc độ strain: Sinh lý học và mức độ liên quan) trong việc phân biệt các ngưỡng của MV gây tổn thương (15). Hình 3 minh họa một phương pháp có thể được sử dụng để đánh giá siêu bơm phồng theo chu kỳ thở từ các dạng sóng thông khí bằng cách kiểm tra trực quan đường cong áp lực-thời gian (16).
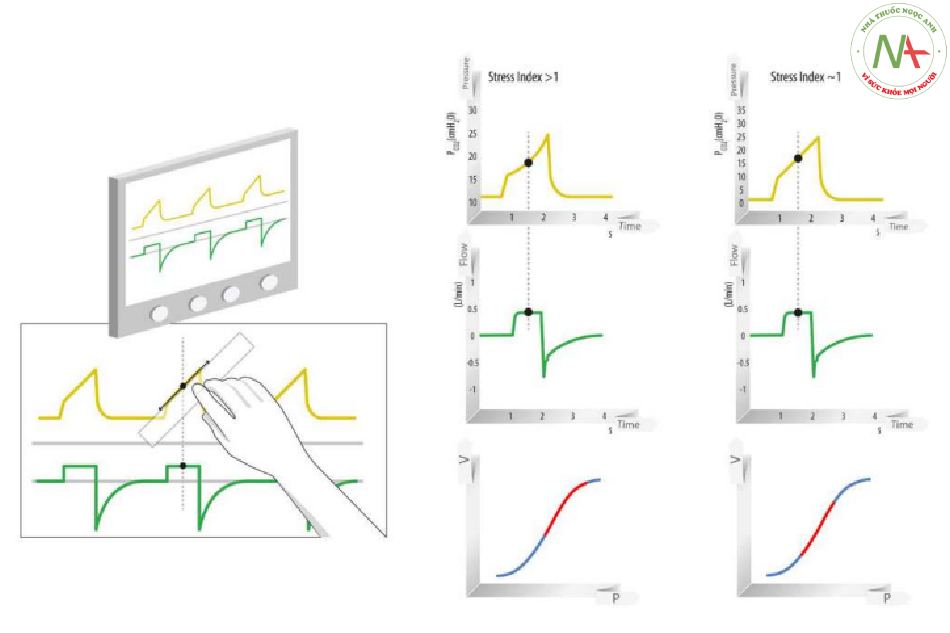
Ở những bệnh nhân được thông khí kiểm soát thể tích (lưu lượng không đổi) mà không tự thở, đường cong áp lực-thời gian được phân tích trực tiếp từ màn hình máy thở ở đầu giường. Nếu chỉ số căng thẳng gần bằng 1 (0,9–1,1, đường cong thẳng), siêu bơm phồng theo chu kỳ thở là không đáng kể. Chỉ số căng thẳng càng cao (>1,1, độ lõm hướng lên), siêu bơm phồng theo chu kỳ thở càng lớn.
Về mặt thực nghiệm, như mong đợi, dường như có một ngưỡng áp lực tổng thể cao trong MV gây ra VILI (9). Tuy nhiên, hiện tượng như vậy có chuyển thành thực hành lâm sàng ở người không? Lý thuyết cơ sinh học chắc chắn áp dụng cho một khái niệm đơn vị phổi hoặc mô hình biến dạng đàn hồi và dẻo (là giả định khi chúng ta sử dụng các biện pháp đường thở tổng thể như PTP, Vt và EELV), nhưng trong ARDS/PARDS, bệnh lý không đồng nhất, và có sự không chắc chắn về địa hình (topography) của strain. Ví dụ, có thể có “những yếu tố gây tăng căng thẳng” (stress raisers) ở những vùng phổi có strain cao, hoặc với bệnh lý và huy động theo chu kỳ thở không đồng nhất; các thực thể khu vực này có khả năng khuếch đại bất kỳ ứng suất nào (10, 18–21). Cho đến nay, các nghiên cứu thực nghiệm ủng hộ những ý tưởng này vì người ta đã chứng minh rằng strain vùng và hiện tượng viêm có mối tương quan với nhau (22–26). Do đó, thay vì một mô hình strain có hại đồng nhất hoặc tổng thể, việc tạo ra các lực cơ học có hại không đồng nhất có thể là do bản chất không đồng nhất của ARDS và bơm phồng/xả xuống động. Thật thú vị, việc xác định các ngưỡng năng lượng tiêu tán có khả năng thúc đẩy tổn thương phổi trong PARDS hiện là chủ đề (27– 30).
TỐC ĐỘ STRAIN: SINH LÝ VÀ SỰ LIÊN QUAN
Hình 4 cho thấy các dạng sóng của sự chuyển đổi áp lực đường thở liên quan đến việc tạm dừng cuối thì hít vào ở một bệnh nhân trải qua MV bằng chế độ kiểm soát thể tích (VC) hoặc kiểm soát áp lực (PC). Có hai khía cạnh chính cần xem xét ở đây: thứ nhất, mối quan hệ giữa strain và stress. Strain không đổi trong thời gian tạm dừng cuối thì hít vào. Tuy nhiên, có một phần của sức căng (tension) được tạo ra ban đầu sẽ giảm bớt khi tạm dừng, được gọi là “thư giãn căng thẳng” (stress relaxation). Sự phục hồi stress này được thể hiện bằng sự sụt giảm áp lực từ áp lực ban đầu ở lưu lượng bằng 0 (P1) đến áp lực giật đàn hồi cuối cùng (P2), mà theo quy ước được gọi là Pplat (31). Sự khác biệt trong P1 và P2 (P1 – P2 hoặc P1 – Pplat) không chỉ do sự thư giãn căng thẳng, mà còn do hiện tượng “pendelluft”, là sự phân phối lại khí trong phổi do sự bất bình đẳng về hằng số thời gian ở phế nang (31– 34). Trong bối cảnh này, “tốc độ strain” biểu thị vận tốc của P1 – P2 (hoặc P1 – Pplat) mà theo quy ước được coi là có liên quan đến thời gian hít vào.
Thứ hai, xem xét tác động của lưu lượng hít vào đường thở (airway inspiratory flow – Qi), xác định áp lực sức cản hoặc ma sát được tạo ra trong đường thở và được biểu thị bằng sự khác biệt giữa áp lực hít vào đỉnh (PIP) và P1 (tức là PIP – P1). PIP kết hợp các thành phần ma sát, đàn hồi nhớt và đàn hồi thuần túy. P1, áp lực giảm đầu tiên khi đạt đến lưu lượng bằng 0, không bao gồm bất kỳ thành phần ma sát nào. Ảnh hưởng của Qi đối với P1 và độ đàn hồi động đã được nghiên cứu bằng thực nghiệm (32), cũng như y tế (33) và ở người lớn mắc ARDS (34). Nói chung, các nghiên cứu này cho thấy rằng việc tăng Qi không làm thay đổi P2 hoặc độ đàn hồi tĩnh, nhưng nó làm tăng P1, tốc độ strain và độ đàn hồi động (32–34). Do đó, cùng nhau kết hợp thành phần nhớt chất dẻo của áp lực làm việc và tác động của pendelluft, sự cần thiết phải đo Pplat như vậy, thay vì sử dụng P1 làm đại diện cho Pplat, có thể là một lĩnh vực nghiên cứu trong PARDS.
LƯU LƯỢNG HÍT VÀO VÀ TỔN THƯƠNG PHỔI
Các nghiên cứu thực nghiệm đã được sử dụng để kiểm tra vai trò của Qi trong VILI. Ví dụ: khi động vật khỏe mạnh trải qua quá trình thông khí VC (VCV) với PIP cao (50 cm H2O), Vt cao (>38–60 mL/Kg), nhịp thở thấp (RR, 5/phút) và Qi thấp (15 L/phút), không có bằng chứng về VILI. Ngược lại, khi thông khí PC (PCV) được sử dụng với cùng Vt, RR và thời gian hít vào (Ti) và Qi trung bình là 60 L/phút, sẽ có VILI mở rộng (35).
Làm thế nào và tại sao VILI xảy ra? Một nghiên cứu khác cho thấy rằng Qi cực đại có thể quan trọng hơn Qi trung bình như một yếu tố tạo ra VILI (36). Vt cao (30 mL/Kg), RR (20/phút) và áp lực cuối kỳ thở ra bằng 0 (ZEEP) được sử dụng trong hai chế độ MV: VC điều chỉnh áp lực (PRVC) và VCV. Việc sử dụng PRVC dẫn đến Qi đỉnh cao hơn và nhiều VILI hơn khi so sánh với VCV, ngay cả với cùng một Ti và do đó, cùng một Qi trung bình (36). Ngoài ra, có phải Qi khuếch đại tác động của áp lực đường thở, Vt hoặc căng thẳng quá mức, do đó làm tăng nguy cơ VILI? Ở đây, hãy xem xét tác động của Qi (dưới dạng tốc độ strain với strain/Ti) đối với VILI. Trong một nghiên cứu, động vật khỏe mạnh được thở máy trong 54 giờ bằng cách sử dụng VCV, với RR 15/phút, ZEEP và các giá trị khác nhau của Ti và strain tổng thể (37). MV có Qi cao hơn (trái ngược với Qi thấp hơn) có liên quan đến phù phổi và tử vong nhiều hơn, cũng như độ giãn nở phổi, trao đổi khí và VILI kém hơn. Đó là, mặc dù có strain tổng thể tương tự nhưng với tốc độ strain khác nhau, những dữ liệu này chứng thực tác động của Qi đối với tốc độ strain và mối quan hệ của nó với VILI. Các nghiên cứu lâm sàng hiện đang cần thiết để hỗ trợ những quan sát thử nghiệm này.
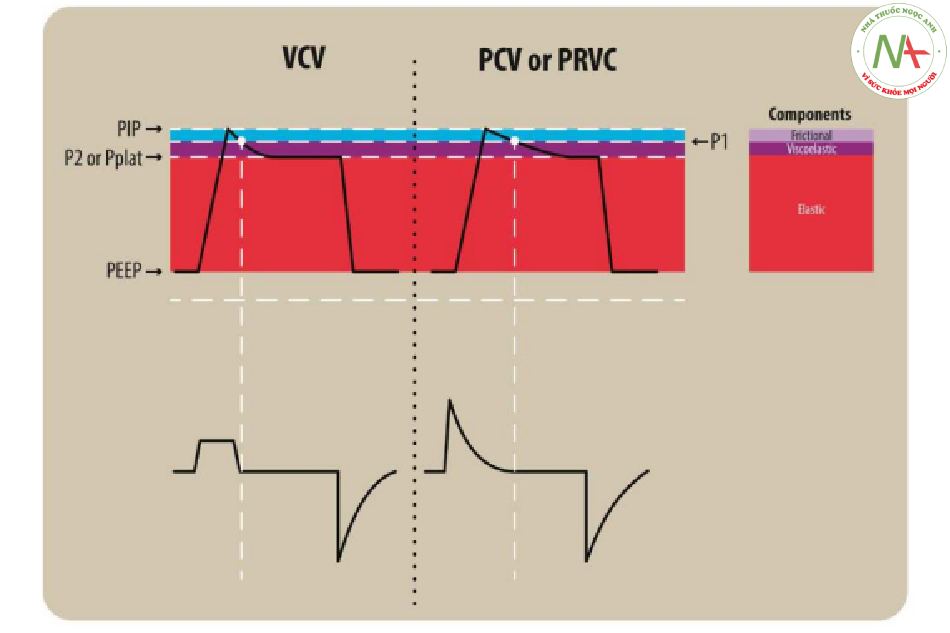
Sự chuyển đổi áp lực đường thở liên quan đến tạm dừng cuối thì hít vào ở bệnh nhân được thở máy ở chế độ thông khí kiểm soát thể tích (VCV) (trái) hoặc thông khí kiểm soát áp lực (PCV)/kiểm soát thể tích điều chỉnh áp lực (PRVC) (phải). PIP kết hợp các thành phần ma sát, đàn nhớt và đàn hồi thuần túy. Áp lực đầu tiên giảm khi đạt đến lưu lượng bằng không là P1 và loại trừ thành phần ma sát. Áp lực giật đàn hồi ở cuối thời gian tạm dừng hít vào được hiển thị là P2 và thường được gọi là áp lực cao nguyên (Pplat). PEEP = áp lực dương cuối thì thở ra, PIP = áp lực đỉnh hít vào.
THÔNG KHÍ KHOẢNG CHẾT TRONG PARDS
Sự không phù hợp giữa thông khí-tưới máu trong phổi ở dạng “shunt” (nghĩa là tưới máu mà không thông khí) được cho là cơ chế chính của tình trạng thiếu oxy trong ARDS và PARDS. Tuy nhiên, không có sự thống nhất giữa mức độ shunt và tình trạng thiếu oxy máu (38). Một phần, sự thiếu liên kết này có thể được giải thích bằng sự thay đổi trong cân bằng nội môi, chẳng hạn như phản ứng co mạch phổi do thiếu oxy làm giảm tưới máu cho các đơn vị phổi được thông khí với các phế nang bị thiếu oxy. Nói cách khác, chúng ta cũng nên coi PARDS là một vấn đề với khoảng chết. Ví dụ, tỷ lệ khoảng chết trên Vt (Vd/Vt) có thể đưa ra đánh giá về tưới máu phổi và thông khí bổ sung cho các số liệu truyền thống về oxy hóa. Ngoài ra, shunt càng lớn thì càng có nhiều khả năng Vt được phân phối lại trong EELV nhỏ hơn, do đó trực tiếp làm tăng Vd/Vt phế nang. Do đó, trên thực tế, Vd/Vt phế nang có thể không chỉ phản ánh cường độ của shunt mà còn đánh giá quá cao mức độ của Vd/Vt trong phế nang, đặc biệt là khi shunt đạt đến giá trị cao, đó là hiện tượng được gọi là “khoảng chết của shunt” (39 – 41).
Vì Vd/Vt có liên quan đến tỷ lệ tử vong trong PARDS (42, 43), nên việc đo lường và mô tả đặc điểm để phân tầng rủi ro trong các nghiên cứu lâm sàng cần được đánh giá thêm.
TỔN THƯƠNG PHỔI DO BỆNH NHÂN TỰ GÂY RA
Các nghiên cứu thực nghiệm và thông tin lâm sàng gián tiếp cho thấy rằng nỗ lực hô hấp tích cực và liên tục có thể gây ra sự tiến triển của tổn thương phổi trong ARDS/PARDS, một hiện tượng được gọi là “tổn thương phổi do bệnh nhân tự gây ra” (patient self-inflicted lung injury – P-SILI).
Trong các trường hợp ARDS nhẹ, SB trong MV được coi là có lợi. Tuy nhiên, lợi ích như vậy không xảy ra trong ARDS nghiêm trọng. Ví dụ, trong SB trước khi được đặt nội khí quản cho MV, có những nỗ lực hô hấp mạnh mẽ của các cơ hô hấp, từ đó tạo ra các lực khu vực có khả năng gây ra các tác động bất lợi trong phổi (44). Co cơ hoành mạnh và sử dụng các cơ phụ—trong bối cảnh tăng PTP, xẹp phổi và xẹp đường thở theo chu kỳ—sẽ tạo ra những dao động không đồng đều về áp lực màng phổi trên bề mặt phổi. Một hậu quả là phổi bị kéo căng quá mức không thể đoán trước ở các vùng phụ thuộc, điều này cũng tạo ra hiện tượng pendelluft và khuếch đại tổn thương mô học của phổi (44–47).
Câu hỏi rõ ràng phát sinh. Tại sao có tác dụng khác biệt của SB trong ARDS nhẹ và nặng? ARDS cần nghiêm trọng đến mức nào để SB có thể gây bất lợi? Hiện tại chúng tôi chưa biết, nhưng ba dòng bằng chứng từ nghiên cứu kiểm tra sự tương tác giữa hơi thở và tiến triển của tổn thương phổi có thể cung cấp một số hiểu biết sâu sắc. Đầu tiên, trong một mô hình thử nghiệm, trong đó tăng thông khí do thuốc dẫn đến rối loạn chức năng phổi nghiêm trọng trong vòng 3,5–13 giờ, có thể sử dụng thuốc ức chế thần kinh cơ và MV hỗ trợ để ngăn ngừa tổn thương phổi (48). Thứ hai, trong một mô hình thử nghiệm về ARDS nghiêm trọng được hỗ trợ bằng cách loại bỏ carbon dioxide ngoài cơ thể và được so sánh với MV bảo vệ cộng với phong tỏa thần kinh cơ bằng hóa chất, các nỗ lực hô hấp cường độ thấp không dẫn đến tiến triển ARDS (49). Cuối cùng, ở những bệnh nhân mắc ARDS, có bằng chứng gián tiếp cho thấy việc ức chế SB bằng cách sử dụng phong bế thần kinh cơ trong MV làm giảm tỷ lệ tử vong (50–52). Tổng hợp tất cả những quan sát này lại với nhau, chuyên gia của chúng tôi sẽ cần nghiên cứu thêm về phương pháp lâm sàng tốt nhất để hỗ trợ bệnh nhân mắc PARDS (53, 54): việc cho phép SB trong thời gian dài trước khi bắt đầu MV có thực sự hợp lý không?
Nhìn chung, khi chúng ta so sánh VILI và P-SILI, có vẻ hợp lý khi nghĩ rằng chúng nên chia sẻ cùng một kiểu tổn thương phổi, vì phổi tiếp xúc với năng lượng gây biến dạng mô. Tuy nhiên, dữ liệu thử nghiệm sơ bộ cho thấy rằng P-SILI gây ra tổn thương mạch máu lớn hơn nhiều so với tổn thương biểu mô—vốn chiếm ưu thế trong VILI— và tổn thương có thể liên quan đến dao động áp lực âm và tăng lưu lượng máu phổi trong SB (44, 47, 55, 56).
CÀI ĐẶT BAN ĐẦU THỞ MÁY TRONG PARDS
Không có đủ bằng chứng để chỉ ra rằng một chế độ MV cụ thể vượt trội so với các chế độ khác ở bệnh nhân mắc PARDS. Do đó, hiện tại, phương pháp thông gió dự kiến vẫn tùy thuộc vào sở thích và kinh nghiệm của địa phương. Các công cụ liên quan đến VCV cho phép theo dõi quá mức khí lưu thông theo thời gian thực (17) và đo hằng số thời gian hít vào (KTI) (57). Ngoài ra, VCV cung cấp Qi thấp hơn cho cùng một Vt và Ti, về mặt lý thuyết làm giảm tốc độ strain. Pplat cũng có thể được đo chính xác ở chế độ PC (58, 59). Điều đó nói rằng, có bốn nguyên tắc cần được xem xét, dù chọn chế độ nào.
- Chuẩn độ áp lực dương cuối kỳ thở ra (PEEP): PEEP bên ngoài—PEEP được cung cấp bởi MV— chịu ảnh hưởng mạnh mẽ của áp lực thủy tĩnh mô phổi. Hồi sức bằng dịch truyền lượng lớn ở bệnh nhân có thể cần sử dụng mức PEEP lớn hơn 10 cm H2O, trong khi những bệnh nhân được quản lý bằng phương pháp hồi sức truyền dịch bảo tồn có thể sẽ cần mức PEEP thấp hơn (≤10 cm H2O) (60–62). Chuẩn độ kết hợp mức PEEP và mức nồng độ oxy hít vào (tức là biểu đồ PEEP/FiO2) là một hướng dẫn rất tốt (63). Bệnh nhân mắc PARDS nặng yêu cầu điều chỉnh PEEP cho từng cá nhân, tốt nhất là thử nghiệm giảm PEEP thấp hơn hoặc giảm dần, có thể được lựa chọn dựa trên độ giãn nở động của phổi, trạng thái oxygen hóa, Vd/Vt được tối ưu hóa, EELV hoặc trở kháng tốt hơn và chỉ số căng thẳng.
Mục tiêu oxygen hóa rõ ràng được liên kết với cách tiếp cận biểu đồ PEEP/FiO2. Có hai nguyên tắc ở đây: tránh tăng oxy máu với độ bão hòa oxy mạch nẩy (SpO2) lớn hơn 97% và tránh giảm oxy máu với SpO2 dưới 88%. Do đó, việc sử dụng oxy được điều chỉnh cẩn thận để đạt được giá trị PaO2 nằm trong phạm vi sinh lý bằng cách sử dụng FiO2 thấp nhất có thể. Trong PARDS nhẹ đến trung bình, mục tiêu SpO2 thích hợp là từ 92% đến 97%, nhưng trong PARDS nặng, mục tiêu SpO2 là 88–91% có thể là đủ, nếu phép đo độ bão hòa oxy tĩnh mạch trung tâm và lactate được theo dõi chặt chẽ để tìm bằng chứng về thiếu máu cục bộ hệ thống (64–66).
- Vt sinh lý: Vt gần sinh lý (khoảng 6 ml/kg, sử dụng giá trị thấp hơn trong hai ước tính được tính từ trọng lượng cơ thể lý tưởng và hiện tại) được sử dụng, và không có lý do gì để biện minh cho Vt cao hơn mức sinh lý ở những bệnh nhân bị giảm EELV (67). Áp lực đẩy bình thường (ΔP), là sự khác biệt giữa Pplat và PEEP, ở trẻ khỏe mạnh là gần 5–6 cm H2O (68). Do đó, các giá trị nên được giới hạn ở mức nhỏ hơn hoặc bằng 15 cm H2O (69, 70).
- Tần số hô hấp: RR gần với bình thường được sử dụng trong MV. Ví dụ: ở trẻ sơ sinh, hãy chọn tần số 30–40/phút bằng cách điều chỉnh sự kết hợp giữa Vt và RR để có thể tích phút dự kiến là 180–200 mL/kg. Các điều chỉnh tiếp theo có thể được thực hiện bằng cách sử dụng khí máu động mạch sau đó và thông tin từ quá trình thông khí, bao gồm: Ti, sự hiện diện của PEEP nội tại (tức là, siêu bơm phồng cuối kỳ thở ra không chủ ý hoặc không đo được) và quan sát rằng lưu lượng thở ra tiến gần đến 0 khi kết thúc kỳ thở
Thời gian hít vào được liên kết phức tạp với RR. Ở trẻ sơ sinh, phương pháp ưa thích của tôi là sử dụng Ti tùy chỉnh, khoảng 0,5–0,7 giây, gần gấp 3–4 lần so với KTI (57). EELV càng thấp thì thời gian hít vào và thở ra càng ngắn. Thật thú vị, khi RR và Ti được thiết lập bằng cách sử dụng các hằng số thời gian hít vào và thở ra ở trẻ em, tỷ lệ hít vào và thở ra gần bằng 1:1,5 (57, 68). Nếu các đặc tính cơ học cho phép, việc tạm dừng cuối thì hít vào có thể cải thiện hiệu quả thông khí, do đó làm giảm PaCO2 cho cùng một thể tích phút (71).
- Chấp nhận tình trạng tăng CO2 máu cho phép: Tình trạng tăng CO2 máu cho phép, chẳng hạn như giới hạn dưới của pH lớn hơn hoặc bằng 7,2, hiện là một chiến lược được chấp nhận trong MV của các trường hợp PARDS. Tuy nhiên, chiến lược này chống chỉ định trong bệnh não cấp tính nặng, rối loạn huyết động nặng, một số bệnh tim bẩm sinh và tăng áp động mạch phổi cao hơn hệ thống (64). Trong thời gian đầu của PARDS, nhiễm toan hô hấp sẽ làm tăng điều hòa hô hấp, và vì những lý do đã thảo luận trong phần trước, thuốc ức chế thần kinh cơ bằng thuốc sẽ cần được sử dụng để tránh Vt quá mức. Khi tình trạng hô hấp được cải thiện và tình trạng nhiễm toan được điều chỉnh (ví dụ: > 7.3), có thể ngừng phong tỏa thần kinh cơ bằng thuốc, trừ khi có một số lý do khác để tiếp tục với nó.
HỖ TRỢ THỞ MÁY CÁ NHÂN HÓA
Sau khi cài đặt hỗ trợ MV ban đầu cho bệnh nhân PARDS của bạn, điều cần làm tiếp theo là đánh giá cơ bản về cơ học phổi sẽ cho phép bạn cá nhân hóa mức độ hỗ trợ. Thông thường, đánh giá như vậy bao gồm đo Vt, Pplat, PEEP, ΔP và độ giãn nở của hệ hô hấp (tức là CRS = Vt/ΔP). Hỗ trợ quyết định bằng máy tính có thể là một công cụ có giá trị để tùy chỉnh hỗ trợ thông khí (72, 73).
Cài đặt ban đầu cho Pplat và ΔP lần lượt là nhỏ hơn hoặc bằng 28 cm H2O và nhỏ hơn hoặc bằng 15 cm H2O. Nếu trao đổi khí đầy đủ, Vt có thể giảm; Do đó, sẽ có sự giảm ΔP nếu chúng ta cho rằng có một số thông khí không hiệu quả do sự gia tăng Vd/Vt phế nang. Cài đặt MV cũng có thể được tinh chỉnh bằng cách sử dụng theo dõi chức năng phổi, ví dụ: chỉ số căng thẳng, capnography thể tích (ít nhất là tỷ lệ khoảng chết cuối thì thở ra), đo áp lực thực quản, siêu âm phổi và chụp cắt lớp trở kháng điện. Nhiều công cụ trong số này được sử dụng trong nghiên cứu hơn là chăm sóc lâm sàng thông thường. May mắn thay, đối với hầu hết bệnh nhân, việc giải thích đầy đủ các đường cong thời gian áp lực và lưu lượng-thời gian, khí máu động mạch và tĩnh mạch trung tâm, và CO2 thở ra, tích hợp với theo dõi huyết động thông thường, là đủ.
KHÓ KHĂN SAU KHỞI ĐẦU THỞ MÁY VÀ GIẢI PHÁP TIỀM NĂNG
Hầu hết bệnh nhân PARDS được thông khí đầy đủ với cài đặt ban đầu thích hợp, nhưng có thể phát sinh một số khó khăn nhất định. Điều quan trọng là phải loại trừ các vấn đề rõ ràng và dễ giải quyết, ví dụ, định vị ống nội khí quản, tràn khí màng phổi hoặc tràn dịch màng phổi và tình trạng huyết động không ổn định nghiêm trọng. Trong hầu hết các trường hợp sau, cần phải phong tỏa thần kinh cơ bằng thuốc và người dùng nên tuân theo các chính sách và quy trình của địa phương để điều trị như vậy.
- Khi Pplat hoặc ΔP vượt quá giới hạn an toàn: Đầu tiên, nên cố gắng giảm Vt bằng cách cố gắng duy trì thể tích phút không đổi. Trong một số trường hợp, Vt có thể giảm xuống 4 mL/kg mà không cần các chiến lược khác để loại bỏ CO2. Các cách tiếp cận khác được sử dụng trong tài liệu với bằng chứng hạn chế, dù theo cách nào, là tư thế nằm sấp, thông khí dao động tần số cao (HFOV) để huy động phổi và oxygen hóa qua màng ngoài cơ thể (ECMO) (74, 75).
- Khi có toan hô hấp nặng: Như đã thảo luận, thuốc ức chế thần kinh cơ bằng thuốc được sử dụng trong trường hợp này. Cần theo dõi thể tích phút và cẩn thận điều chỉnh đầy đủ Ti và RR, đồng thời hạn chế PEEP nội tại. Việc không đáp ứng có thể đồng nghĩa với việc dùng thử hỗ trợ với HFOV hoặc
- Khi bị thiếu oxy máu nghiêm trọng: Trong trường hợp này, có nhiều điều đã được mô tả trong tài liệu (ví dụ: phong tỏa thần kinh cơ bằng thuốc, tư thế nằm sấp, thao tác huy động và oxit nitric dạng hít), nhưng không có bằng chứng rõ ràng. Một lần nữa, nên tuân thủ các thủ tục tại địa phương với việc chuyển viện thích hợp cho ECMO (76).
KẾT LUẬN
PARDS là một hội chứng lâm sàng phức tạp, trong đó một số tình trạng phổi hội tụ trong bệnh lý phổi của chúng để duy trì công thở và đảm bảo trao đổi khí hô hấp đầy đủ, đồng thời hạn chế bệnh lý phổi đang diễn ra hoặc tiến triển. Theo truyền thống, chúng tôi đã nghĩ về MV trong PARDS bằng cách tập trung vào thể tích (tức là Vt) và áp lực (tức là ΔP và Pplat). Tuy nhiên, một sự hiểu biết mới về sinh lý học của strain và stress phổi, cũng như sinh lý bệnh của VILI và P-SILI có nghĩa là cần có nhiều nghiên cứu liên quan đến lâm sàng nếu chúng ta muốn tạo ra tác động đến kết quả tốt hơn (Hình 5).
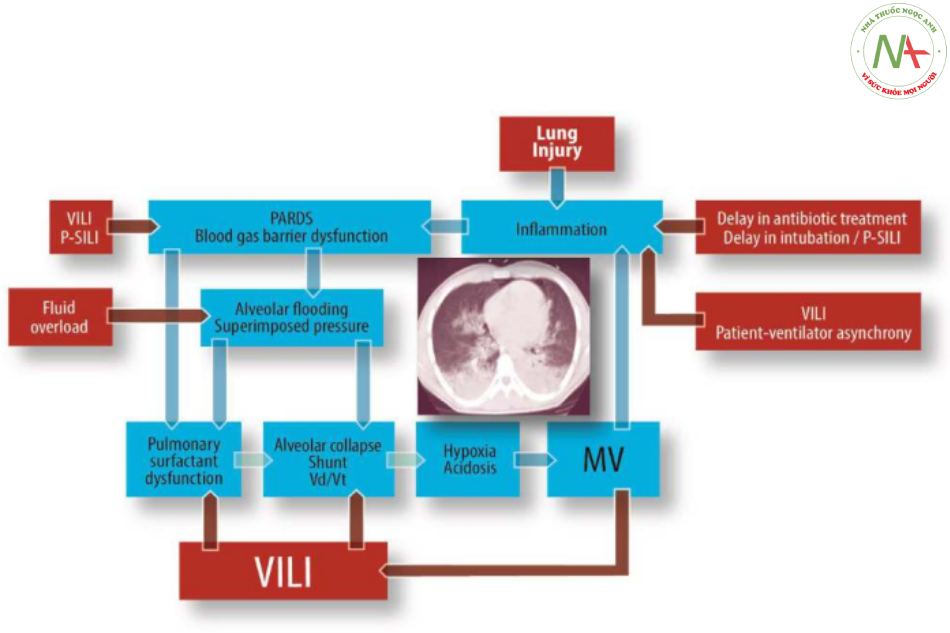
Các yếu tố có thể sửa đổi được tô sáng trong hình chữ nhật màu đỏ. MV = thở máy, PARDS = hội chứng nguy kịch hô hấp cấp tính ở trẻ em, P-SILI = tổn thương phổi do bệnh nhân tự gây ra, Vd/Vt = khoảng chết, VILI = tổn thương phổi do thở máy.
