Bệnh hô hấp
Có nên tăng thông khí để kiểm soát áp lực nội sọ sau chấn thương không và thực hiện như thế nào?
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tác giả: Daniel Agustín Godoy, Ali Seifi, David Garza, Santiago Lubillo-Montenegro and Francisco Murillo-Cabezas
Biên dịch: Bác sĩ Đặng Thanh Tuấn – bệnh viện Nhi Đồng 1
Để tải file PDF của bài viết Có nên tăng thông khí để kiểm soát áp lực nội sọ sau chấn thương không và thực hiện như thế nào?, xin vui lòng click vào link ở đây.
Trong chấn thương sọ não, tăng áp nội sọ (ICH, intracranial hypertension) có thể trở thành một tình trạng đe dọa tính mạng nếu nó không được xử trí nhanh chóng và đầy đủ. Các bác sĩ sử dụng phương pháp điều trị tăng thông khí để giảm áp lực nội sọ (ICP, intracranial pressure) tăng cao bằng cách điều chỉnh các chức năng tự điều hòa kết nối với phản ứng CO2 trong mạch máu não. Gây giảm CO2 máu thông qua tăng thông khí làm giảm áp suất riêng phần của carbon dioxide động mạch (PaCO2), kích thích sự co mạch ở các tiểu động mạch tạo sức cản não. Sự co thắt này làm giảm lưu lượng máu não, làm giảm lượng máu não và cuối cùng, làm giảm ICP của bệnh nhân. Tác động của tăng thông khí (HV, hyperventilation) điều trị là thoáng qua, nhưng các nguy cơ đi kèm với những thay đổi này trong sinh lý não và hệ thống phải được xem xét cẩn thận trước khi có thể được khuyến khích điều trị. Sự chỉ trích nổi bật nhất của phương pháp này là khả năng phát triển thiếu máu não và thiếu oxy mô được trích dẫn. Mặc dù đúng là cần phải có một số biện pháp nhất định, chẳng hạn như theo dõi ôxy não, để giảm thiểu những tình trạng nguy hiểm này, nhưng việc sử dụng bằng chứng có sẵn về kết cục kém liên quan đến HV để biện minh cho việc bác bỏ việc thực hiện HV điều trị vẫn còn gây tranh cãi và vẫn là một chủ đề gây tranh cãi giữa các bác sĩ. Đánh giá này nhấn mạnh các vấn đề khác nhau xung quanh việc sử dụng HV như một phương tiện kiểm soát ICH sau chấn thương, bao gồm các chỉ định điều trị, nguy cơ tiềm ẩn và lợi ích, và thảo luận về những kỹ thuật có thể được thực hiện để tránh các biến chứng bất lợi.
Giới thiệu
Các bác sĩ bắt đầu khám phá tăng thông khí (HV) như một cách để giảm thể tích máu não (CBV, cerebral blood volume) trong những năm 1920 (1). Một trong những mô tả tài liệu sớm nhất về phương pháp điều trị này có từ năm 1959, khi Lundberg báo cáo việc sử dụng HV để giảm mức độ tăng áp lực nội sọ (ICP) (2). HV gây ra co mạch tiểu động mạch, dẫn đến giảm lưu lượng máu não (CBF, cerebral blood flow) và do đó, giảm CBV (3-5). Theo thời gian, liệu pháp dễ thực hiện này đã được sử dụng rộng rãi để điều trị tăng áp nội sọ (ICH) thứ phát sau chấn thương sọ não (sTBI, traumatic brain injury) nặng (6–8). Vào giữa những năm 1990, tại các trung tâm phẫu thuật thần kinh ở Hoa Kỳ và Vương quốc Anh, tỷ lệ sử dụng HV tương ứng là 83 và 97% (6, 7). Một phân tích cơ sở dữ liệu châu Âu được công bố vào năm 2008 chỉ ra rằng trong 24 giờ đầu tiên sau khi bị tổn thương, các bác sĩ đã sử dụng HV dự phòng cho hơn một nửa số trường hợp TBI của họ (9).
Mặc dù HV làm giảm ICP một cách nhanh chóng và hiệu quả, các tác dụng này chỉ thoáng qua và không liên quan đến việc cải thiện kết cục của bệnh nhân cuối cùng (10, 11). Vì HV có khả năng gây ra các tổn thương do thiếu máu não cục bộ thứ phát và tạo ra những hậu quả bất lợi ảnh hưởng đến các hệ cơ quan khác, và liệu pháp này vẫn còn là một chủ đề gây tranh cãi và tranh luận sôi nổi (10, 11). Các bằng chứng hiện có chỉ ra rằng HV dự phòng cường độ cao hoặc kéo dài là bất lợi và nên tránh, đặc biệt là trong giai đoạn cấp tính của sTBI; tuy nhiên, liệu pháp này vẫn được khuyến nghị như một cách để kiểm soát tạm thời tình trạng tăng ICP đe dọa tính mạng (12). Mục tiêu của tổng quan này là cung cấp một bản cập nhật đánh giá các nghiên cứu hiện tại mô tả HV để kiểm soát ICP để xác định xem HV có vai trò gì trong việc xử trí chấn thương não cấp tính hay không.
Sinh lý học CO2: Các khái niệm cơ bản
Tăng thông khí dẫn đến tăng thông khí phế nang (AV, alveolar ventilation) (13, 14), thể tích không khí mỗi phút đi vào các vùng hô hấp (tiểu phế quản, phế nang, v.v.) cũng sẵn sàng để trao đổi khí (13). Bởi vì một phần của thể tích đó vẫn còn ở những nơi mà khí không khuếch tán vào máu, AV có thể được xác định bằng công thức sau (13):
- AV = RR (tần số hô hấp) × (VT [thể tích khí lưu thông] −VDS [thể tích khoảng chết]).
Thông khí phế nang có mối quan hệ tỷ lệ nghịch với nồng độ CO2 phế nang; khi AV tăng, nồng độ CO2 phế nang giảm (13, 14). Tuy nhiên, CO2 phế nang có mối liên hệ trực tiếp với áp suất riêng phần của CO2 động mạch (PaCO2), phản ánh sự cân bằng giữa sản xuất và đào thải CO2 (13, 14):
- PaCO2 = CO2 tạo ra – CO2 đào thải.
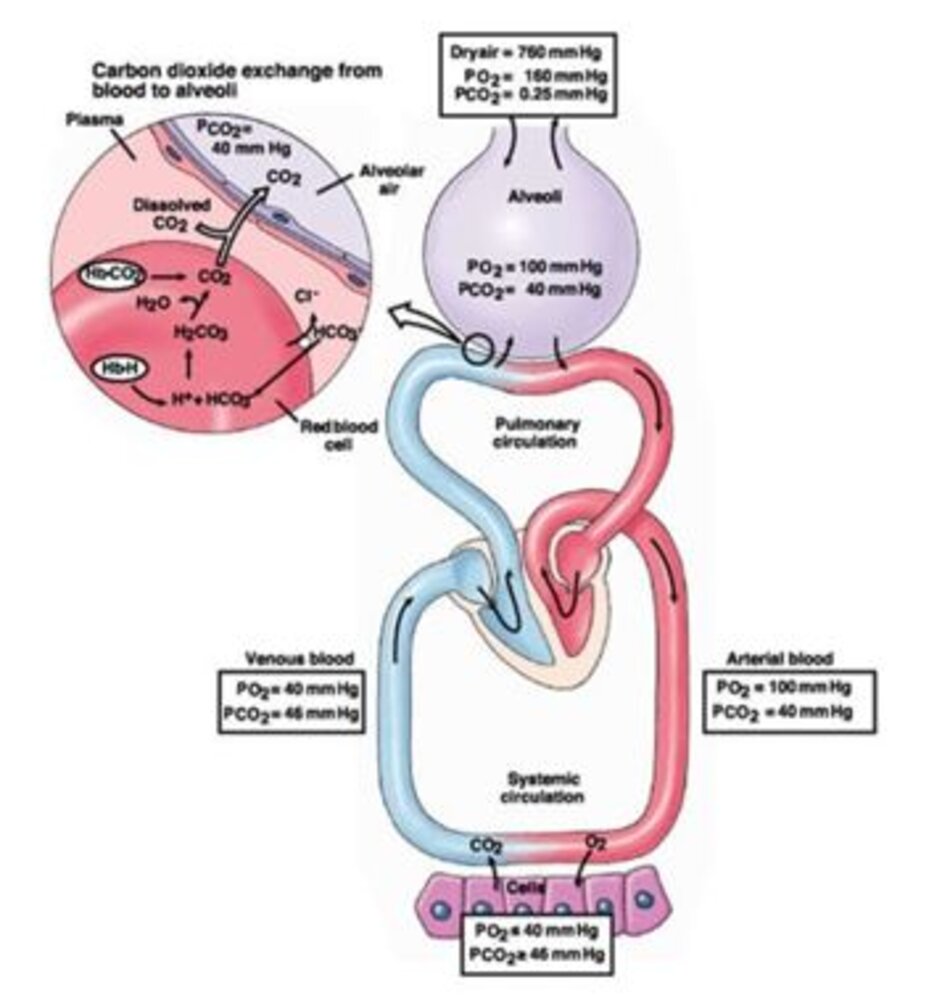
Việc sản xuất CO2 trong tế bào của bệnh nhân phụ thuộc vào một số biến số, bao gồm chế độ ăn uống, tập thể dục, nhiệt độ và hoạt động của hormone (tuyến giáp) (13). Sự sản sinh CO2 tương đối ổn định và không đổi, ngoại trừ trong các trạng thái tăng chuyển hóa nghiêm trọng. Nếu vận chuyển CO2 và cung lượng tim không thay đổi, nồng độ PaCO2 sẽ được xác định tỷ lệ nghịch với tốc độ thải CO2 qua AV (13). CO2 là một chất khí hòa tan và khuếch tán được vận chuyển theo ba cách khác nhau: 10– 15% nó được hòa tan theo PaCO2 (Định luật Henry); 20–30% trong số đó được liên kết với protein huyết tương và hemoglobin để tạo thành phức hợp carbaminic, và 65–70% trong số đó được chuyển thành bicarbonat/axit cacbonic trong hồng cầu và huyết tương (13). Phản ứng tạo phức thứ ba này giúp duy trì trạng thái cân bằng giữa các ion bicacbonat (HCO-3) và hydro (H+) (13, 14) (Hình 1).
Giá trị PaCO2 bình thường dao động trong khoảng 35 đến 45 mmHg (4,7–6 kPa) ở nhiệt độ cơ thể bình thường và ở mực nước biển với áp suất khí quyển là 760 mmHg (13, 14).
Nếu nhiệt độ cơ thể giảm, độ hòa tan của CO2 tăng và PaCO2, do đó, giảm (13, 15). PaCO2 giảm 4,5% cho mỗi lần giảm nhiệt độ độ C. Điều ngược lại xảy ra khi nhiệt độ tăng (Bảng 1) (15). Ở độ cao cao hơn, áp suất khí quyển giảm, kích thích AV, do đó mức PaCO2 bình thường thấp hơn (Bảng 2) (16–20).
![Có nên tăng thông khí để kiểm soát áp lực nội sọ sau chấn thương không và thực hiện như thế nào? 19 Bảng 1. Sự thay đổi các giá trị PaCO2 bình thường theo sự thay đổi của nhiệt độ trung tâm ([ref] 15).](https://nhathuocngocanh.com/wp-content/uploads/2022/01/co_nen_tang_thong_khi_de_kiem_soat_tinh_trang_tang_ap_luc_noi_so_sau_chan_thuong_khong_va_thuc_hien_nhu_the_nao_anh_2.jpg)
Những thay đổi trong sinh lý não trong quá trình giảm PaCO2
Não là một trong những cơ quan hoạt động trao đổi chất nhiều nhất trong toàn bộ cơ thể. Bởi vì nó thiếu dự trữ oxy và glucose, hai chất dinh dưỡng quan trọng để duy trì hoạt động sinh lý mạnh mẽ, điều quan trọng là não phải có một số hệ thống phân phối liên tục để có thể nhận các chất nền này (21). Hệ thống phân phối này xảy ra thông qua CBF. CBF rất quan trọng đến mức não đã phát triển các cơ chế thích ứng để duy trì dòng chảy đầy đủ và liên tục bất chấp những thay đổi trong các biến sinh lý hoặc các yêu cầu trao đổi chất (21–23). Việc duy trì CBF được gọi là “quá trình tự điều hòa của não”, và nó chủ yếu đạt được nhờ các tiểu động mạch sức cản (22, 23). Bằng cách giãn ra hoặc co lại để đáp ứng với những thay đổi về huyết áp động mạch, độ nhớt, khí và nhu cầu trao đổi chất, các tiểu động mạch có thể điều chỉnh CBF (22, 23).
Lưu lượng máu não
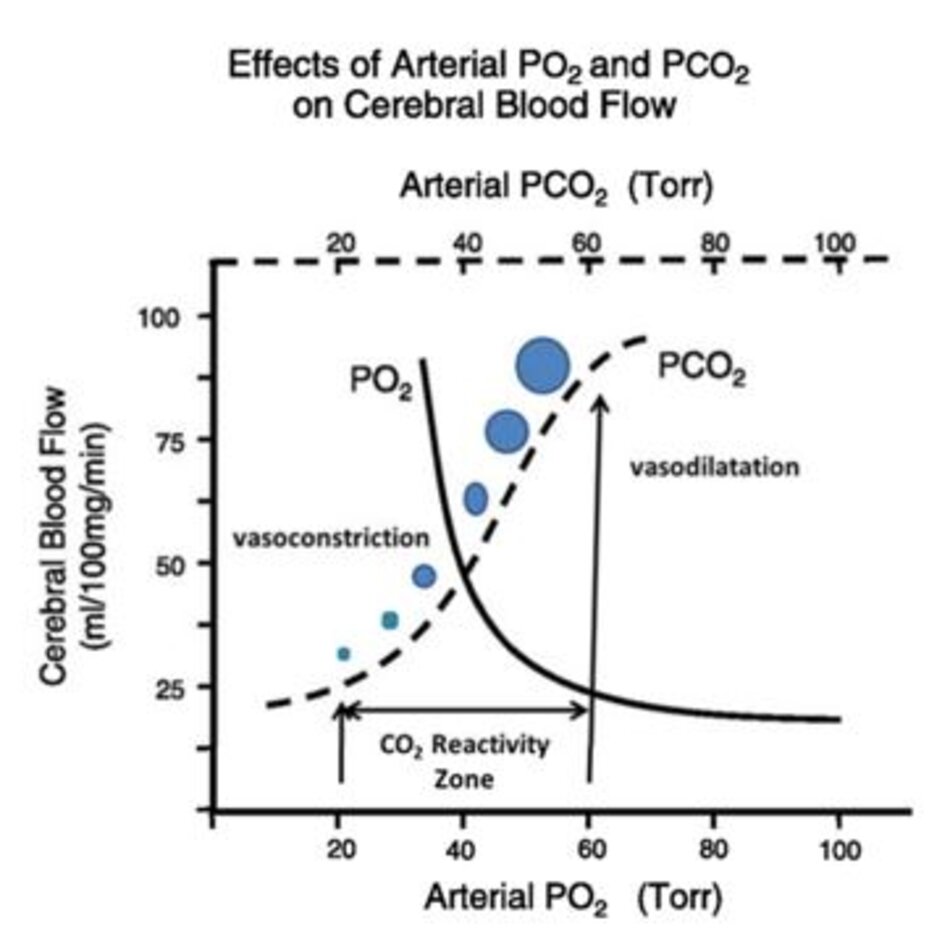
“Khả năng đáp ứng CO2” là khả năng mà các tiểu động mạch cản trở não có thể giãn ra hoặc co lại để đáp ứng với những thay đổi về áp suất riêng phần của CO2 trong động mạch. Sự giãn nở xảy ra khi áp suất riêng phần của CO2 trong động mạch tăng lên (PaCO2> 44 mmHg chứng tỏ tăng CO2 máu); các mạch co lại nếu mức PaCO2 giảm (PaCO2 <35 mmHg cho thấy giảm CO2 máu) (3–5, 10, 11). Tuy nhiên, hoạt động mạch máu này chỉ xảy ra trong khoảng 20–60 mmHg của PaCO2 (24). Đường kính của các bình sẽ không thay đổi nếu mức PaCO2 tăng lên trên hoặc giảm xuống dưới phạm vi cụ thể đó. Do những hạn chế này, khi nó được vẽ trên đồ thị, đường cong tự điều chỉnh mô tả CBF theo sự dịch chuyển PaCO2 giống với một hàm sigmoid (Hình 2) (4, 25).
Những thay đổi về đường kính mạch do giảm CO2 so với những thay đổi do tăng CO2 không tỷ lệ thuận (5). Nếu PaCO2 tăng đến 80 mmHg, sự giãn mạch sẽ làm tăng CBF lên 100- 200%, gây giải phóng catecholamine và tăng hoạt động trao đổi chất. Mặt khác, cứ một milimét thủy ngân mà PaCO2 giảm thì CBF sẽ giảm 3%; do đó, mức PaCO2 từ 20 đến 25 mmHg có liên quan đến việc giảm CBF từ 40–50% (5, 24).
Các tiểu động mạch hình tròn chịu trách nhiệm về các trường hợp giãn ra và co lại này có đường kính nhỏ hơn 50 µm. Nội mạc mạch máu phản ứng với những thay đổi về độ pH xảy ra trong khoảng quanh mạch bằng cách giải phóng các chất trung gian điều hòa nội mạc và cơ trơn mạch máu (5, 26). Các yếu tố hoạt động mạch này được cho là bao gồm oxit nitric, prostaglandin, nucleotide mạch vòng, kali và canxi (5).
Lưu lượng máu não bình thường không đồng nhất; nó thay đổi tùy theo tốc độ trao đổi chất và hoạt động của từng vùng (27). Phản ứng của mạch máu não với CO2 cũng có thể khác nhau, tùy thuộc vào vị trí hoặc hoàn cảnh (28). Trong quá trình sTBI, đặc biệt là trong vài giờ đầu, phản ứng CO2 trở nên trầm trọng hơn, đặc biệt là ở những vùng lân cận với các vết tụ máu hoặc máu tụ dưới màng cứng (29-32). Vì những lý do này, những thay đổi trong mức bình thường của CO2 là tổn thương thứ cấp tiềm ẩn nguy hiểm có thể tác động mạnh đến sinh lý não (11).
Thể tích máu não
Ở người trưởng thành, CBV bình thường là 3–4 ml trên 100 g mô nhu mô (5). Mặc dù những thay đổi về đường kính của mạch máu não có thể làm thay đổi tổng số CBV, 70% tổng lượng máu chứa trong não tương ứng với hệ thống tĩnh mạch (33, 34). Bởi vì các tĩnh mạch và mao mạch không đáp ứng với sự dao động của PaCO2, bất kỳ thay đổi nào trong CBV sau các sự cố tăng hoặc giảm CO2 máu chỉ có thể là do thay đổi thể tích máu động mạch (33, 34). Người ta ước tính rằng HV làm giảm CBV khoảng 0,049 ml/100 g trên milimét thủy ngân giảm CO2 (5). Nếu chỉ có 30% trong tổng số CBV nằm trong động mạch và chỉ có các mạch pial đáp ứng với những thay đổi trong PaCO2, thì CBF do thiếu CO2 giảm 30% sẽ chỉ dẫn đến CBV giảm 7% (35). Theo cách này, sự giảm CO2 rõ rệt có thể tạo ra sự giảm đáng kể trong CBF, nhưng ít ảnh hưởng đến CBV và ICP tương ứng (35). Có ý kiến cho rằng phản ứng của CBV đối với tình trạng giảm CO2 sẽ giảm hơn nữa trong quá trình hạ huyết áp động mạch, cụ thể là khi phạm vi huyết áp động mạch trung bình (MABP) giảm từ 154 đến 114 Hg (5).
Áp lực nội sọ
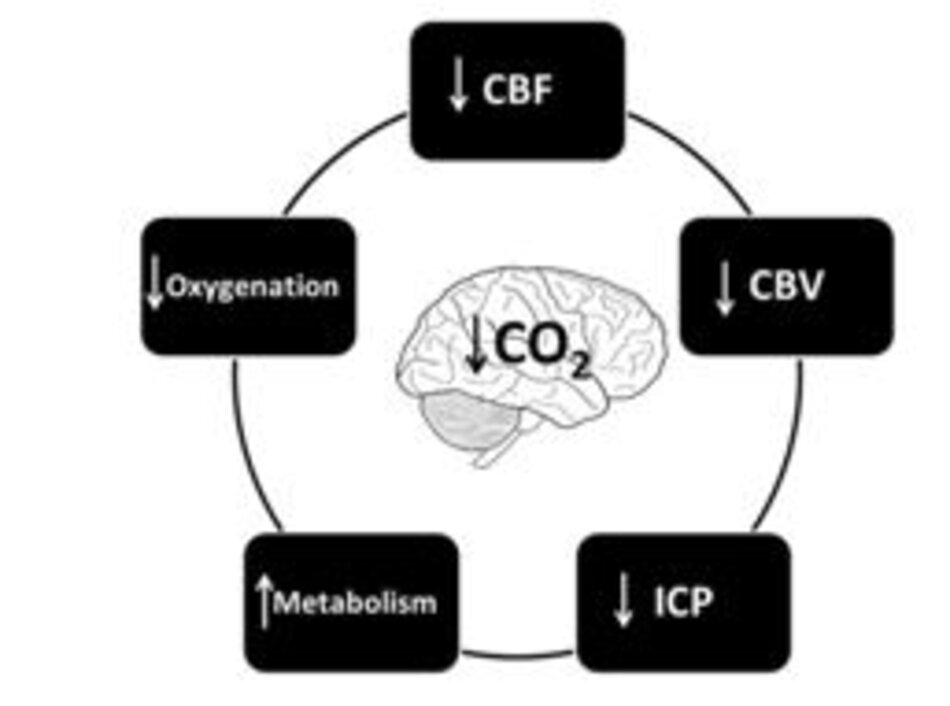
Phù hợp với giả thuyết Monro-Kellie, những thay đổi trong CBV sẽ chỉ tạo ra những thay đổi ICP sau khi các cơ chế bù đắp khoảng đã cạn kiệt (10, 11, 14). Các cơ chế bù trừ này bao gồm những thay đổi trong dịch não tủy (CSF, cerebrospinal fluid) và thể tích máu chủ yếu thông qua việc tăng cường tĩnh mạch trở về tim và độ lệch của dịch não tủy đến kênh tủy sống. Tăng CO2 máu gây giãn mạch, dẫn đến tăng CBV và tăng ICP sau đó; giảm CO2 gây ra co mạch, dẫn đến giảm CBV và giảm ICP sau đó (10, 11, 14). HV là một liệu pháp sử dụng các tình trạng giảm CO2 máu để kích hoạt sự co mạch trong các tiểu động mạch cản trở trong nhu mô não nhằm giảm ICP. Việc làm này sẽ sửa đổi giá trị tuyệt đối và hình thái của sóng xung ICP bằng cách giảm thành phần P2 (sóng khí lưu thông) (36).
Chuyển hóa não
Giảm CO2 máu làm tăng hoạt động chuyển hóa ở não thông qua nhiều cơ chế khác nhau. Nó gây ra sự giải phóng các axit amin kích thích (N- Methyl-d-aspartate và glutamate) và làm tăng khả năng hưng phấn của tế bào thần kinh, tiêu thụ glucose và tốc độ trao đổi chất của O2 (CMRO2) (11, 14). Nó cũng làm tăng và kéo dài hoạt động co giật (11, 14).
Oxy hóa não
Tình trạng thiếu oxy xảy ra khi cơ thể hoặc một vùng cụ thể của cơ thể không nhận được hoặc không thể xử lý đủ lượng oxy để đáp ứng nhu cầu trao đổi chất của nó (37–39). Tình trạng thiếu oxy ở mô có thể là cục bộ hoặc toàn thể, nhưng cả hai biến thể đều có thể được phát hiện bằng cách sử dụng theo dõi não tại giường để đo áp suất O2 (ptiO2) hoặc độ bão hòa O2 tĩnh mạch trong bóng của tĩnh mạch cảnh (SvjO2) (40). Có bốn con đường khác nhau mà qua đó tình trạng thiếu CO2 có thể gây ra hoặc góp phần vào tình trạng thiếu oxy ở cơ thể (37–39):
- Sự co mạch do giảm CO2 có thể gây ra giảm CBF, dẫn đến “thiếu oxy do thiếu máu cục bộ” (3, 5, 10, 11, 14).
- Việc giảm mức carbon dioxide có thể làm giảm sự trao đổi khí ở phổi, gây ra “tình trạng thiếu oxy máu” (10, 11).
- Đường cong phân ly oxy-hemoglobin (Hgb) có thể dịch chuyển sang trái do thiếu CO2, làm tăng ái lực của Hgb với O2 và cản trở việc giải phóng O2 vào tế bào, còn được gọi là “thiếu oxy ái lực cao” (10, 11).
- Kích thích tế bào thần kinh tăng và chuyển hóa não do thiếu canxi làm tăng nhu cầu chuyển hóa, dẫn đến thiếu ôxy máu (11, 14).
Những thay đổi khác nhau mà tình trạng giảm CO2 gây ra liên quan đến sinh lý não được mô tả trong Hình 3.
Các tác động toàn thân của giảm CO2
Tình trạng giảm CO2 gây ra ảnh hưởng đến tất cả các hệ thống cơ quan (10, 11, 14). Khi đánh giá tình trạng giảm CO2 máu cho các mục đích có khả năng sử dụng HV điều trị, người ta cũng nên tính đến ảnh hưởng của thở máy (10, 11, 41, 42). Bởi vì bệnh nhân bị sTBI có thể đồng thời xuất hiện các tổn thương đụng dập trong nhu mô phổi, vi hít dịch dạ dày hoặc hội chứng suy hô hấp cấp tính (ARDS), họ có thể yêu cầu thông khí bảo vệ với VT thấp và mức áp lực dương cuối thì thở ra (PEEP) cao (10, 11, 41, 42). Điều trị HV đạt được bằng cách tăng RR hoặc VT. Tăng VT có thể gây bất lợi vì stress mà nó đặt lên cơ thể; nó gây căng giãn phế nang, gây ra sự giải phóng cytokine và gây viêm cả tại chỗ và toàn thân (10, 11, 41–43).
Giảm CO2 làm giảm tưới máu đến mô thận, mô tiêu hóa, da và mô cơ xương; nó cũng làm tăng độ kết dính và kết tập tiểu cầu (10, 11, 14). Mức PaCO2 thấp kích thích co thắt phế quản, làm giảm co mạch phổi do thiếu oxy, ức chế sản xuất chất hoạt động bề mặt, và tăng tính thấm của màng phế nang-mao mạch và đường hô hấp trên (11, 14). Một số biến số có thể ảnh hưởng đến sự trao đổi khí và làm tăng tính nhạy cảm của bệnh nhân với các bệnh nhiễm trùng. Chúng bao gồm: xẹp phổi, phù nề, giảm độ giãn nở, thay đổi cơ chế bảo vệ phổi, thay đổi tỷ lệ thông khí – tưới máu, và thay đổi tỷ lệ shunt (11, 14). Nhiễm kiềm hô hấp (rối loạn cân bằng axit/bazơ liên quan đến giảm nồng độ kali, canxi và photphat trong huyết tương) làm phức tạp quá trình oxy hóa mô bằng cách dịch chuyển đường cong phân ly O2/Hgb sang trái (10, 11).
Sự co mạch do giảm CO2 làm giảm lưu lượng máu đến mạch vành và làm tăng nguy cơ co thắt mạch vành. Nó cũng làm tăng nhu cầu trao đổi chất của cơ tim, có thể làm tăng nguy cơ thiếu máu cục bộ cơ tim của bệnh nhân. Điều này đặc biệt đúng nếu bệnh nhân có các yếu tố khuynh hướng hoặc tiền sử bệnh tim (10, 11, 14). Giảm CO2 cũng thúc đẩy tổn thương tái tưới máu và khuyến khích sự phát triển của rối loạn nhịp tim, cụ thể là rung nhĩ (11).
Giảm CO2 và độc tính thần kinh
Mức độ thấp của PaCO2 tạo ra tác dụng độc thần kinh bằng cách giải phóng các axit amin kích thích gây độc tế bào, tăng mức dopamine trong hạch cơ bản và thúc đẩy sự kết hợp choline vào phospholipid của màng tế bào (44-46).
Tăng thông khí và các hạn chế về thời gian
Phản ứng của tiểu động mạch não với CO2 phụ thuộc vào sự thay đổi pH quanh mạch (26). HV gây ra tình trạng nhiễm kiềm giảm carbonic, nhanh chóng kích hoạt các cơ chế đệm cố gắng bình thường hóa những thay đổi được thực hiện đối với khoảng ngoại bào và nồng độ (CSF) (10, 11). Trong thời gian này, có một dòng chảy tế bào nhanh chóng của các ion hydro (H+) liên kết với bicacbonat (HCO-3) và tạo ra axit cacbonic (H2CO3), phân ly trong nước (H2O) và CO2 (10, 11). Đồng thời, bicarbonate ngoại bào được trao đổi với clorua từ khoảng nội bào (10, 11). Các cơ chế đệm này không hiệu quả vì chúng nhanh chóng cạn kiệt; nếu tình trạng giảm CO2 vẫn còn, tình trạng nhiễm kiềm sẽ kéo dài.
Một chất đệm chậm hơn nhưng hiệu quả hơn xảy ra ở cấp độ ống thận gần, nơi sự tái hấp thu HCO-3 bị ức chế đồng thời sự bài tiết H+ được kích thích (10, 11). Những phản ứng này bắt đầu vài phút sau khi bắt đầu nhiễm kiềm giảm carbonic và được duy trì trong nhiều giờ hoặc thậm chí vài ngày, cho phép dịch não tủy và pH quanh mạch bình thường hóa 6 giờ sau khi bắt đầu giảm CO2; HV đương nhiên trở nên kém hiệu quả hơn sau khi con đường đệm này được kích hoạt (10, 11). Các nghiên cứu lâm sàng đã chứng minh CBF giảm 40% khi mức PaCO2 là 20 mmHg; nhưng, sau 4 giờ HV, CBF bắt đầu bình thường hóa (47). Mức CO2 sau liệu pháp HV cũng cần thời gian để bình thường hóa; nếu PaCO2 tăng nhanh, pH quanh mạch (được bình thường hóa bởi hệ thống đệm) sẽ giảm, gây nhiễm toan cục bộ, giãn mạch và tăng CBV và ICP (còn được gọi là “sung huyết hồi phục”, rebound hyperemia) (11, 48).
Bằng chứng lâm sàng về liệu pháp tăng thông khí trong quản lý sTBI
Trong nhiều năm, HV là liệu pháp quan trọng trong việc kiểm soát và phòng ngừa ICH sau chấn thương (6–8, 49–51). Oertel và cộng sự báo cáo rằng HV là một công cụ mạnh mẽ và hiệu quả hơn để giảm mức ICP tăng cao khi so sánh với tăng áp lực động mạch trung bình (MABP) hoặc giảm chuyển hóa não với propofol (52). Nhiều nghiên cứu chỉ ra rằng cơ chế HV làm giảm ICP là co mạch và giảm CBF (3–5, 10, 11). Khi CBF giảm, nguy cơ thiếu máu cục bộ là một mối nguy hiểm tiềm ẩn (8, 10–12). Đây là một vấn đề gây tranh cãi còn nhiều tranh luận.
Ngay sau chấn thương, CBF giảm xuống còn khoảng 40% và CMRO2 cũng có thể giảm (53–56). Sau ít nhất 48 giờ, giai đoạn này được theo sau bởi hai giai đoạn liên tiếp của “tăng sung huyết tương đối” (trong đó CBF tăng cao hơn nhu cầu trao đổi chất) và co thắt mạch (57). Não sau chấn thương rất dễ bị tổn thương do thiếu máu cục bộ (58–61). Trong gần một nửa số trường hợp sTBI được báo cáo, cơ chế áp suất tự điều chỉnh bị tổn thương; do đó, CBF trở thành “phụ thuộc vào áp suất” (58–61). Trong các trường hợp khác nhau, đường cong áp suất tự điều tiết có thể dịch chuyển sang phải, điều này sẽ làm tăng giới hạn áp lực tưới máu não (CPP) để giúp ngăn ngừa thiếu máu cục bộ (58–61). Vì não cần đạt được CPP cao hơn trong giai đoạn cấp tính của sTBI, nên tránh hạ huyết áp trong giai đoạn này.
Giống như CBF, khả năng giãn mạch của tiểu động mạch đối với CO2 có thể thay đổi tùy theo khu vực. Đáp ứng CO2 được duy trì theo thói quen và trầm trọng hơn trong giai đoạn đầu của chấn thương, đặc biệt là ở những vùng lân cận với các vết thương hoặc tụ máu dưới màng cứng; gần các khu vực này làm tăng khả năng thiếu máu cục bộ xảy ra ở các khu vực đó (Hình 4) (31, 33, 62). Nếu khả năng đáp ứng của CO2 bị tổn hại, nó thường là do một sự kiện cuối cùng liên quan đến kết quả kém (53, 62–64). Vì những lý do này, điều quan trọng ở giai đoạn này là duy trì CBF trong giới hạn bình thường để cung cấp đủ CPP (CPP = MABP – ICP) và độ nhớt của máu trong khi tránh co thắt mạch kháng (12, 58–61).
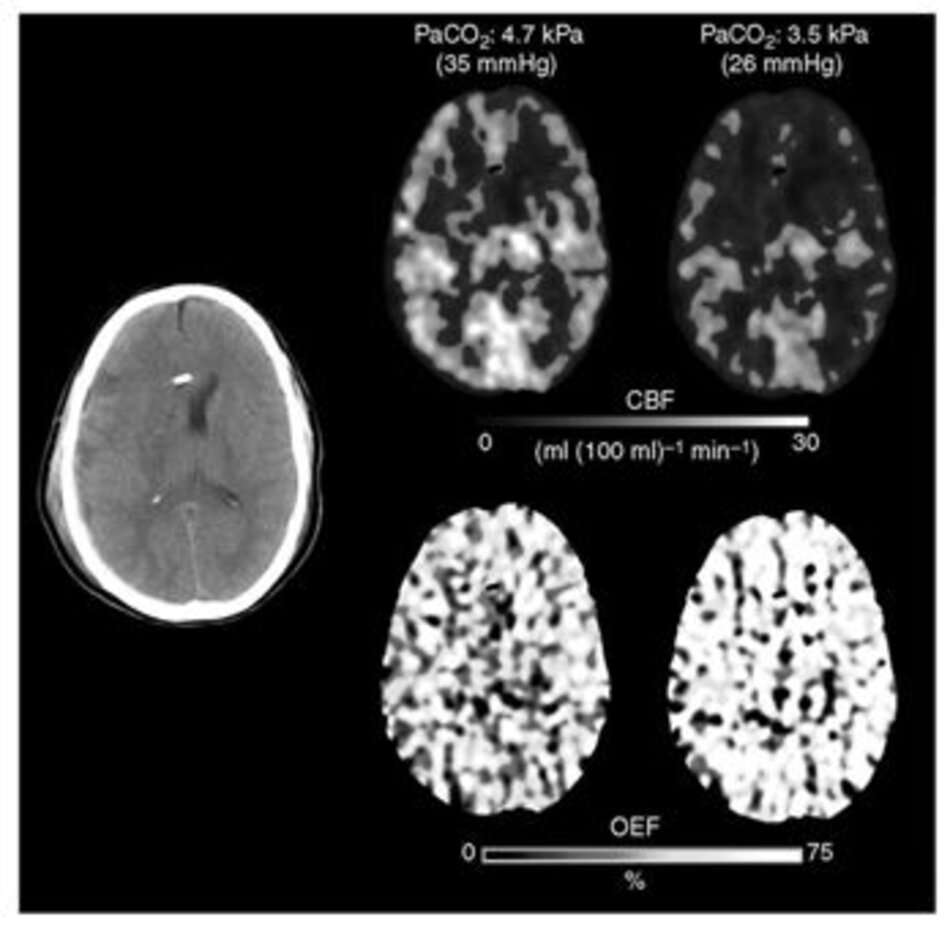
Tăng thông khí và thiếu máu cục bộ não
Davis là người đầu tiên quan sát thấy sự chậm lại của sóng điện não sau HV và cho rằng hành vi này là do thiếu máu cục bộ (65). CBF khu vực được đánh giá lạnh (rCBF) bằng kỹ thuật Xenon (Xe-CT) trước và sau HV giữa ngày đầu tiên nhập viện và 3 tuần sau sTBI (66). Trong những điều kiện này, ICP trung bình được báo cáo là 19 mmHg và mức PaCO2 thay đổi từ 36 đến 26 mmHg. Nhóm tăng thông khí cho thấy số vùng kém tưới máu (oligemic) nhiều gấp ba lần (được xác định bởi CBF <20 ml/100 g/phút), và các vùng giảm CBF nghiêm trọng (<15 ml/100 g/m) của họ tăng từ 0,1 đến 3%. Những quan sát này rõ ràng hơn ở bán cầu đại não có CBF nền thấp hơn. Cũng có mối tương quan chặt chẽ giữa HV, giảm rCBF và kết cục bệnh nhân kém (66).
Nhiều nghiên cứu lâm sàng kiểm tra sTBI đã xác nhận rằng HV làm giảm đáng kể CBF (67– 69). Nhưng quan sát sự giảm CBF là không đủ để chẩn đoán chính xác thiếu máu cục bộ. Để xác định chẩn đoán hợp lệ, tình trạng thiếu oxy mô phải liên quan đến bất kỳ sự giảm CBF (37–40) nào quan sát được. Mặc dù chúng không có sẵn trong thời gian thực tại giường bệnh, điều quan trọng vẫn là thực hiện các nghiên cứu về chuyển hóa, chẳng hạn như chụp cắt lớp phát xạ positron (PET) (70).
Một nhóm từ Cambridge đã tiến hành một loạt các nghiên cứu, trong đó họ phân tích ảnh hưởng của HV ở bệnh nhân sTBI sử dụng PET (71–73). Một mẫu số chung giữa các bệnh nhân là không có ICH (71–73). Trong nghiên cứu đầu tiên của nhóm, 33 bệnh nhân đã được kiểm tra trong vòng tuần đầu tiên sau chấn thương và bốn bệnh nhân được đánh giá trong vòng 24 giờ đầu tiên sau khi nhập viện (71). Các nhà nghiên cứu
đã giảm mức PaCO2 từ mức cơ bản là 36–29 mmHg. HV tăng CPP và giảm ICP và CBF, làm tăng số lượng và thể tích các vùng đạt đến phạm vi giảm tưới máu. Tuy nhiên, những thay đổi này không liên quan đến thiếu máu cục bộ toàn thể vì SvjO2 và chênh lệch O2 động mạch – tĩnh mạch (AVDO2) vẫn trong giới hạn bình thường (71).
Trong một nghiên cứu tiếp theo, 13 bệnh nhân được phân tích trong cùng giai đoạn sau chấn thương để kiểm tra giả thuyết rằng sự thay đổi khuếch tán trong vi tuần hoàn góp phần vào tình trạng thiếu oxy mô (72). Các bệnh nhân được theo dõi bằng PET, phân đoạn chiết xuất O2 (OEF), ptiO2 và pvO2 (72). Một lần nữa, sau khi tạo ra HV ở 29 mmHg của PaCO2, CBF giảm. Các vùng trong phạm vi giảm tưới máu và thiếu oxy (ptiO2 <10 mmHg) cho thấy khả năng dự trữ để tách O2 ít hơn, làm tăng nguy cơ tổn thương do thiếu máu cục bộ ở những vùng này (72).
Sử dụng kỹ thuật PET sửa đổi [O2 (15)], Coles et al. đã đánh giá CBF, CMRO2, CBV và OEF ở 30 bệnh nhân sTBI trong vòng 10 ngày sau chấn thương (73). Giảm CO2 (PaCO2 = 29 mmHg) làm giảm CBF, tăng thể tích vùng thiếu máu cục bộ và tăng OEF. CMRO2 tăng lên, nhưng phản ứng không đồng nhất. Hai mươi tám phần trăm những người được tăng thông khí cho thấy CMRO2 giảm rõ rệt. CMRO2 tương quan với các phát hiện theo dõi sinh lý thần kinh (73).
Trong một loạt bệnh nhân sTBI khác có giá trị ICP bình thường, tác động của HV và mannitol lên CBF và các biến chuyển hóa được đo bằng thiết bị siêu âm Doppler và mẫu máu được lấy từ một ống thông tĩnh mạch cảnh (74). Thời gian của nghiên cứu không được chỉ định. Các tác giả báo cáo rằng, khi so sánh với nhóm 20% (0,5 g/kg) mannitol, nhóm tăng thông khí ở PaCO2 mục tiêu là 32 mmHg có CBF và CMRO2 thấp hơn; sử dụng glucose (CMRGlu) và sản xuất lactate (CMRL) cũng tăng trong nhóm này, được các tác giả giải thích là dấu hiệu của tăng đường phân kỵ khí (74).
Sử dụng Xe-CT, Stringer đã phân tích rCBF ở 12 cá nhân với nhiều căn nguyên khác nhau, 4 trong số đó là bệnh nhân TBI (75). HV được tạo ra không đồng nhất với các giá trị CO2 cuối triều (ETCO2) khác nhau, ba trong số đó thấp hơn 20 mmHg. Nghiên cứu cho thấy sự giảm rCBF. Không có thông số chuyển hóa nào được đo (75).
Sử dụng phương pháp khuếch tán nhiệt và vi thẩm tách (thermodiffusion and microdialysis), Marion đã phân tích rCBF và các dấu hiệu thiếu oxy mô trong dịch ngoại bào của 20 cá nhân có sTBI trước và sau HV với mục tiêu là 24,6 mmHg (76). Bệnh nhân duy trì giá trị ICP bình thường. Các tác giả đã phân tích “những vùng có vẻ khỏe mạnh” liền kề với các vết thương hoặc tụ máu dưới màng cứng trong khoảng thời gian hai khoảng thời gian: 24–36 giờ và 3–4 ngày sau chấn thương (76). Sau HV, sự gia tăng glutamate, lactate và mối quan hệ lactate/pyruvate (L/P) được quan sát thấy là 10% so với giá trị cơ bản. CBF giảm với tỷ trọng tương tự. Những thay đổi này được nhìn thấy trong cả hai khoảng thời gian, nhưng chúng được quan sát thấy thường xuyên hơn trong giai đoạn đầu sau TBI (76).
Sử dụng PET, Diringer đã kiểm tra hành vi của CBF, CBV, CMRO2, OEF và CvO2 sau HV dưới mức PaCO2 mục tiêu được chỉ định trước là 30 mmHg. Bệnh nhân được phân tích trung bình 11 giờ sau sTBI. Trong số chín người được nghiên cứu, chỉ có năm người có ICP lớn hơn 20 mmHg (77). Giảm CBV, CBF và CvO2 đã được quan sát thấy. Không có thiếu máu cục bộ rõ ràng hoặc rối loạn chức năng năng lượng vì CMRO2 không thay đổi với chi phí tăng OEF (77). Hai năm sau, cùng một nhóm đã sử dụng cùng một phương pháp để so sánh tác động của HV trên bệnh nhân có và không có ICH vào ngày 1 và 5 sau chấn thương (78). Kết quả họ thu được và kết luận họ đạt được không khác gì những kết quả được báo cáo trong nghiên cứu trước đó (78).
Tăng thông khí và oxy hóa não
PaCO2 ảnh hưởng đến các phép đo được thực hiện bởi cả phương pháp theo dõi ôxy toàn cục (SvjO2) và khu vực (ptiO2). HV làm giảm mức ICP, và các nghiên cứu lâm sàng đã chứng minh sự giảm đồng thời giá trị SvjO2 (79–81). Khi phân tích tác động của mức ETCO2 đối với CBF và ptiO2, mối quan hệ trực tiếp đã được quan sát thấy giữa các biến này, đặc biệt là trong khoảng ETCO2 từ 20 đến 60 mmHg (82). Khi HV cường độ cao hơn và mức ETCO2 thấp hơn, khả năng phát hiện tình trạng thiếu oxy mô bằng cách theo dõi ptiO2 tăng lên (83). Hạ CO2 là một trong những nguyên nhân phụ có khả năng gây ra tình trạng thiếu oxy ở mô (84). Tác động của HV đối với quá trình oxy hóa mô trở nên mạnh mẽ hơn khi thời gian trôi qua; nó có tác động mạnh nhất vào khoảng 5 ngày sau chấn thương (85, 86). Hiện tượng này có liên quan đến kết quả kém (86–88). Nhiều nghiên cứu lâm sàng đã xác định ảnh hưởng có hại của HV đối với mức ptiO2. Trong sTBI, ptiO2 thấp hơn rõ ràng đã trở thành một yếu tố dự báo độc lập về tỷ lệ tử vong và kết cục bệnh nhân xấu (86–89).
Tăng thông khí và kết quả sTBI
Chỉ một số nghiên cứu đã thiết lập mối tương quan giữa kết quả của bệnh nhân và HV. Hai nghiên cứu nhỏ kết luận rằng tử vong và kết quả chức năng kém có liên quan đến HV khi tăng thể tích vùng có CBF thấp vào vùng thiếu máu cục bộ (66) hoặc khi mức ptiO2 giảm cùng với tăng phản ứng CO2 5 ngày sau chấn thương (86).
Gordon đã báo cáo một loạt bệnh nhân hồi cứu lớn được điều trị bằng giảm thông khí kéo dài (90). 251 bệnh nhân bị sTBI đã được nghiên cứu, 51 người trong số họ bị tăng thông khí (PaCO2 từ 25 đến 30 mmHg). Khoảng thời gian của HV dao động trong khoảng từ 6 giờ đến 41 ngày (trung bình là 10 ngày). Nhóm HV có tỷ lệ tử vong thấp hơn (9,8 so với 32,8%); tuy nhiên, số người sống sót với các di chứng thần kinh nghiêm trọng đã tăng lên đáng kể. Các bệnh nhân hồi phục hoàn toàn không có sự khác biệt giữa các nhóm (90). Các tác giả của bài báo đã đưa ra một số chi tiết về phương pháp luận của họ; dữ liệu lâm sàng được báo cáo của họ cũng không đầy đủ.
Chỉ có một nghiên cứu tiền cứu, đối chứng và ngẫu nhiên đánh giá kết quả cuối cùng của bệnh nhân sTBI được điều trị với HV sâu và kéo dài (5 ngày) (91). Ba nhóm được đánh giá trong nghiên cứu này: bệnh nhân được thông khí bằng khí quyển (PaCO2 35 mmHg), bệnh nhân nhận được HV với PaCO2 là 25 mmHg, và bệnh nhân được điều trị bằng HV và THAM (tromethamine). THAM hoạt động giống như một chất đệm, ngăn chặn sự thay đổi pH trong dịch não ngoại bào và dịch não tủy để kéo dài thời gian HV có hiệu quả. Trước khi phân nhóm ngẫu nhiên, bệnh nhân được phân thành hai nhóm theo thành phần vận động của Thang điểm hôn mê Glasgow (GCS): ≤3 hoặc> 3 điểm. Kết quả thuận lợi tại thời điểm 3 và 6 tháng của sự kiện thấp hơn đáng kể ở nhóm HV, đặc biệt là đối với những bệnh nhân có tình trạng lâm sàng tốt hơn tại thời điểm nhập viện (GCS vận động 4–6). Sau một năm trôi qua kể từ ngày chấn thương, sự khác biệt giữa các nhóm không còn đáng kể. Khi đánh giá CBF (Xe133) và AVDO2, không có bằng chứng về thiếu máu cục bộ ở bất kỳ nhóm nào trong ba nhóm (91).
Các kết luận của nghiên cứu nên được diễn giải một cách thận trọng. Ngay từ đầu, các đặc điểm lâm sàng và chụp cắt lớp của bệnh nhân không cân bằng giữa các nhóm. Số lượng bệnh nhân mỗi nhóm cũng ít, do đó có thể có sai số thống kê kiểu α (dương tính giả). Nhóm chứng cũng được thông khí cao hơn với PaCO2 trung bình là 31 mmHg. Thứ ba, rõ ràng là HV được sử dụng dự phòng vì chỉ có 14% cá nhân trong nhóm chứng và nhóm HV và 5% nhóm HV và THAM có giá trị ICP cao. Cuối cùng, khi phân tích kết quả ở 12 tháng sau chấn thương, kết quả tốt nhất tương ứng với nhóm HV + THAM.
Nhắm mục tiêu PaCO2 trong xử trí sTBI
Cochrane kết luận rằng không có đủ bằng chứng để xác định rõ ràng liệu liệu pháp tăng thông khí trong quản lý sTBI là có lợi hay có hại (92). Trong các tình huống y tế khẩn cấp, các hướng dẫn của Tổ chức Chấn thương Não (BTF) khuyến nghị một thời gian ngắn tăng thông khí (HV) (15–30 phút để đạt mục tiêu PaCO2 30–35 mmHg) để điều trị suy giảm thần kinh cấp tính phản ánh tăng ICP (12). Tuy nhiên, ở những bệnh nhân bị TBI, PaCO2 mục tiêu của thông khí bình thường là 35–40 mmHg với đo SpO2 95% trở lên và/hoặc PaO2 từ 80 mmHg trở lên (12). Nếu bệnh nhân không đáp ứng tất cả các phương pháp điều trị khác, bao gồm nước muối ưu trương, thuốc an thần và thuốc liệt, thì có thể cần phải kéo dài thời gian điều trị bằng HV kèm theo dõi oxy não để làm giảm ICH (12).
Các quy tắc cần tính đến trước khi tăng thông khí cho bệnh nhân sTBI
Tăng thông khí có một vị trí trong việc quản lý ICP. Để các bác sĩ xác định xem có chỉ định điều trị đúng và đủ với nguy cơ thấp nhất có thể xảy ra cho bệnh nhân hay không, cần phải thực hiện một cách tiếp cận có hệ thống dựa trên các bằng chứng khoa học hiện hành. Các tác giả khuyến nghị các hướng dẫn sau Hình 5:
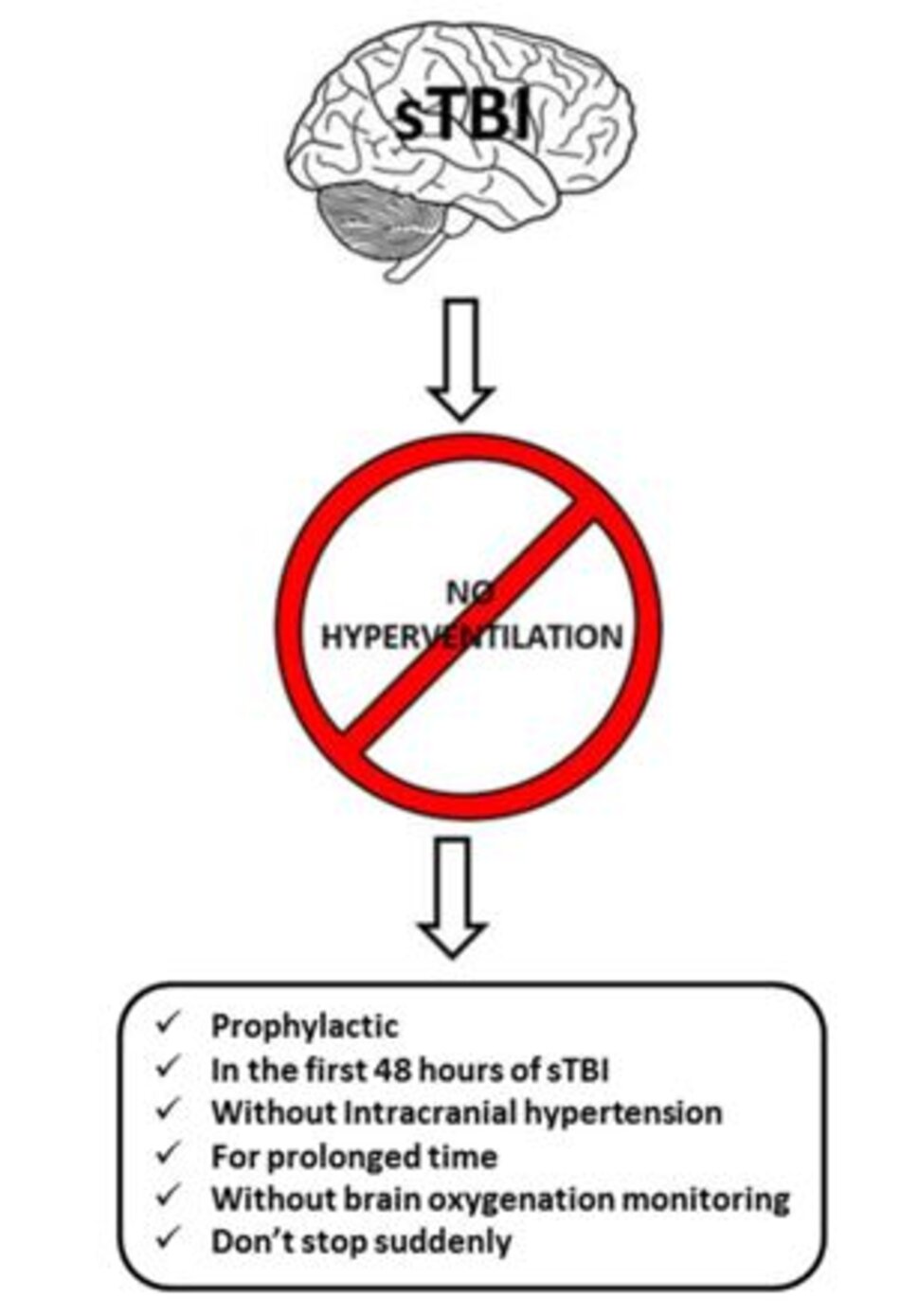
- KHÔNG làm tăng thông khí dự phòng. HV sẽ không ngăn cản sự gia tăng ICP, cũng như không cải thiện kết quả cuối cùng.
- KHÔNG tăng thông khí khi không có ICH.
- KHÔNG tăng thông khí trong thời gian dài. Ở 4–6 giờ, hệ thống đệm bình thường hóa độ pH của khoảng quanh mạch, do đó loại bỏ tác động của tình trạng giảm CO2 trên mạch máu não.
- KHÔNG tăng thông khí trong vòng 24 giờ đầu tiên của sTBI, khi nguy cơ thiếu máu cục bộ là cao nhất.
- KHÔNG tăng thông khí mà không theo dõi oxygen hóa. Cân nhắc sử dụng Doppler xuyên sọ và đo mức CO2 thông qua việc xác định mức ETCO2 hoặc khí máu động mạch. Vì thiếu oxy máu do thiếu máu cục bộ là một nguy cơ tiềm ẩn và nguy hiểm, nên theo dõi tình trạng oxy hóa não trên toàn cục (SvjO2), cục bộ (ptiO2), hoặc cả hai mặc dù mức độ thấp của bằng chứng về khuyến cáo này.
- KHÔNG đột ngột dừng HV. Việc ngừng đột ngột sẽ làm tăng nguy cơ ICP tăng trở lại.
Điều kiện lý tưởng để tăng thông khí
Cơ chế tự điều hòa của não bị tổn thương trong hơn một nửa số trường hợp sTBI được báo cáo, nhưng HV có thể giúp cải thiện những trường hợp đó (93, 94). Tuy nhiên, những lợi ích thu được từ HV chỉ là thoáng qua và chỉ có thể đạt được thông qua HV vừa phải. Một nghiên cứu Doppler kiểm tra 10 bệnh nhân bị sTBI đã chứng minh rằng HV ở mức PaCO2 là 28 mmHg đã cải thiện đáng kể quá trình tự điều tiết của não, nhưng lợi ích bị mất khi HV giảm xuống PaCO2 là 23 mmHg (95). Một nhóm khác bao gồm 30 cá nhân sTBI có giá trị ICP bình thường đã chứng minh sự cải thiện trong quá trình tự điều chỉnh khi mức PaCO2 tạm thời giảm từ 38 xuống 33 mmHg (96).
Tăng thông khí được khuyến nghị là một biện pháp tạm thời để giảm mức ICP cao trong các trường hợp sau:
- Các hội chứng thoát vị. Đây là những hội chứng liên quan đến sự suy giảm tình trạng thần kinh (giãn đồng tử, tư thế vận động bất thường) thứ phát sau tổn thương lan rộng (máu tụ ngoài màng cứng, dưới màng cứng, v.v.) làm cầu nối để giải quyết phẫu thuật (12).
- Mức độ ICP đe dọa tính mạng. Ví dụ: sóng cao nguyên loại A, trong khi điều tra các yếu tố kích hoạt và mong đợi hiệu quả của liệu pháp thẩm thấu (12).
ICH kháng trị. HV được sử dụng cùng với các biện pháp cấp độ hai, chẳng hạn như phẫu thuật cắt bỏ xương sọ giải áp, hạ thân nhiệt, hoặc liều cao barbiturat (12). - ICH thứ phát sau “tăng sung huyết”.
Trong khoảng 20% trường hợp sTBI, tăng ICP tương quan với lượng CBF cao vượt quá nhu cầu trao đổi chất, chủ yếu ở những người trẻ tuổi (53, 97, 98). Trong những tình huống này, dựa trên nguyên tắc kết hợp giữa CBF và CMRO2, khái niệm “HV tối ưu hóa” xuất hiện để giảm CBF và do đó, ICP mà không cần sửa đổi CMRO2 (99– 102). Bằng cách thực hiện phương pháp này cùng với việc theo dõi ôxy não thông qua SvjO2 và các biến liên quan, Cruz et al. hiệu chỉnh HV thành PaCO2 mục tiêu thay đổi từ 18 đến 30 mmHg. Kết quả là ICP giảm mà không cần sửa đổi trong CMRO2 trong khi OEF tăng (98–102). Trong một loạt bệnh nhân sTBI khác, người ta báo cáo rằng HV đã góp phần vào việc ổn định và cải thiện sự hấp thu glucose ở não (101).
Tối ưu hóa tăng thông khí có những hạn chế của nó. Nó dựa trên sự giám sát toàn cục không tính đến sự khác biệt giữa các khu vực về CBF, chuyển hóa hoặc đáp ứng CO2. Tương tự như vậy, sự phân vùng ICP và loại tổn thương (khu trú hoặc lan tỏa) đều bị bỏ qua. Không tồn tại một định nghĩa nhất quán về “tăng sung huyết”, đặc biệt là về các phương pháp theo dõi có sẵn tại giường bệnh. Bản thân phương pháp theo dõi oxy cũng có nhiều hạn chế, điều này có thể gây khó khăn cho việc giải thích dữ liệu thu được từ quá trình giám sát nói trên.
Kỹ thuật tăng thông khí
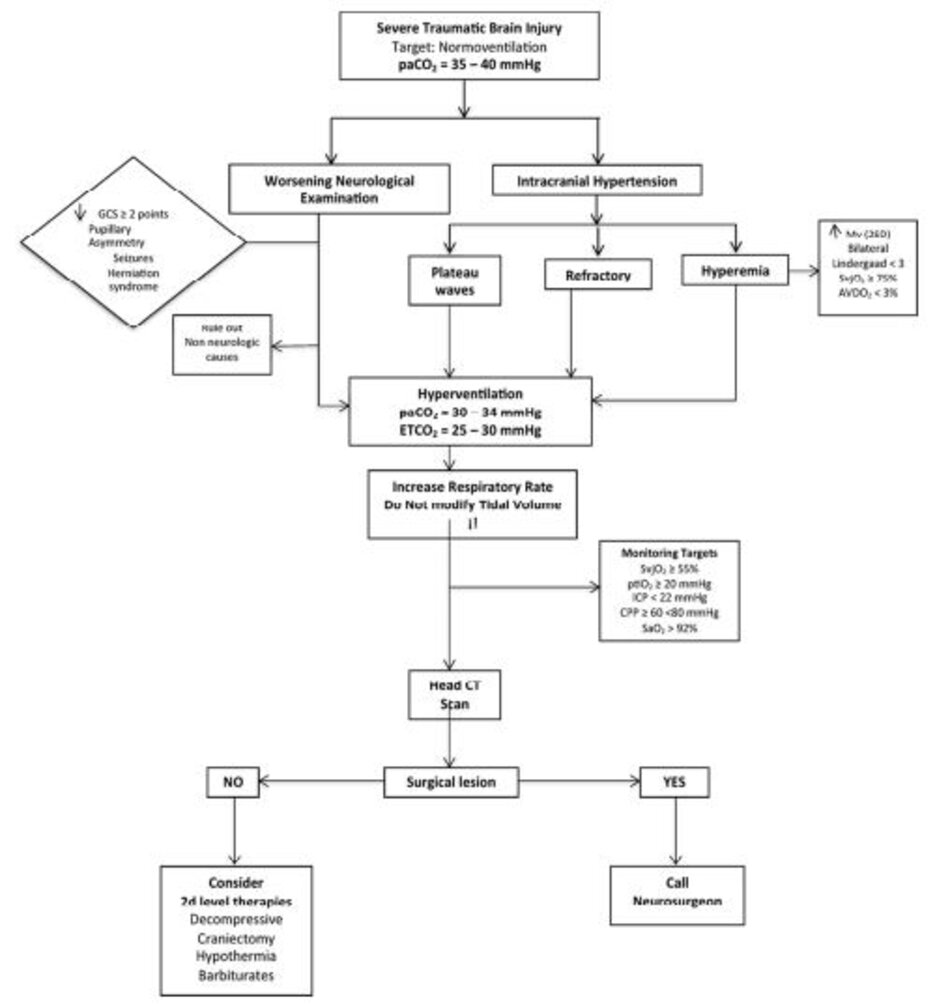
Trong Hình 6, chúng tôi phác thảo một thuật toán thực tế tóm tắt các khái niệm mà người ta nên xem xét khi tăng thông khí cho bệnh nhân.
Kết luận
Bệnh nhân có ICP tăng cao cần được can thiệp khẩn cấp để ngăn ngừa hậu quả có hại. Trong một số điều kiện nhất định, khi đáp ứng CO2 trong mạch máu não còn nguyên vẹn, HV có thể được sử dụng tạm thời để gây giảm CO2 máu để gây co mạch các tiểu động mạch với mục đích làm giảm CBF và cuối cùng là ICP. Các tác động não của tình trạng giảm CO2 chỉ là thoáng qua. Vì HV sâu và kéo dài có nguy cơ thiếu máu cục bộ, điều quan trọng là liệu pháp phải được theo dõi chặt chẽ để ngăn ngừa bất kỳ tác dụng phụ nào trên não.
Tăng thông khí có hậu quả toàn thân nghiêm trọng. Nó không nên được thực hiện trong 24 giờ đầu tiên của chấn thương khi CBF giảm rõ rệt. HV hoặc HV dự phòng mà không có dấu hiệu của ICP tăng cao sẽ không mang lại bất kỳ lợi ích nào. Các khuyến nghị hiện tại cho thấy rằng một thời gian ngắn HV (15–30 phút) với mục tiêu PaCO2 là 30–35 mmHg và mục tiêu CPP là 60–70 mmHg kết hợp với theo dõi oxygen hóa thần kinh gần là một phương pháp hiệu quả để kiểm soát ICH trong giai đoạn cấp tính của sTBI.
Xem thêm:
Các nguyên nhân tổn thương phổi do máy thở tổn thương cơ học