Bệnh hô hấp
Áp lực đẩy để thông khí cho bệnh nhân mắc hội chứng nguy kịch hô hấp cấp tính
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Để tải file pdf bài viết Áp lực đẩy để thông khí cho bệnh nhân mắc hội chứng nguy kịch hô hấp cấp tính hãy click ở đây.
Anesthesiology. 2020 Jun; 132(6): 1569–1576. Dịch bài: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Thở máy xâm lấn là một tiến bộ đáng chú ý, nhưng vẫn tồn tại khả năng tổn thương phổi do máy thở, đặc biệt nếu cài đặt máy thở không được tối ưu hóa. Các phương pháp tốt nhất để tránh tổn thương phổi trong quá trình thở máy, hoặc trong quá trình thông khí cho phổi khỏe mạnh trong phòng mổ hoặc trong quá trình thông khí hỗ trợ khi bệnh nặng, là chủ đề tranh luận. Trong bài đánh giá này, chúng tôi tóm tắt các bằng chứng hiện tại và xem xét một khái niệm tương đối mới để ngăn ngừa tổn thương phổi: nhắm mục tiêu áp lực đẩy được xác định bằng áp lực bình nguyên trừ đi áp lực dương cuối thì thở ra (PEEP; xem Bảng 1) khi cài đặt và điều chỉnh thông khí cơ học.
Tổn thương phổi
Tổn thương phổi do áp lực xuyên phổi (transpulmonary pressure) quá mức (áp lực lên phổi), kéo căng phổi (lung stretch) và chấn thương do xẹp phổi (atelectrauma, tổn thương phổi do xẹp phế nang lặp đi lặp lại).1 Áp lực xuyên phổi được đo bằng áp lực cửa đường thở (nghĩa là được đo trên máy thở) trừ đi áp lực màng phổi (được ước tính bằng phép đo áp lực thực quản).2 Một nguyên nhân gây ra áp lực xuyên phổi cao (áp lực bên trong trừ áp lực bên ngoài) là việc cung cấp thể tích khí lưu thông lớn (VT).3 Tình trạng này có thể dẫn đến stress phổi cao, gây tổn thương và viêm phổi, và có liên quan đến kết quả xấu, đặc biệt là trong hội chứng nguy kịch hô hấp cấp tính (ARDS). Ngoài stress phổi do bơm phồng theo nhịp thở, chấn thương do xẹp phổi là tổn thương gây ra bởi sự xẹp phổi lặp đi lặp lại ở cuối kỳ thở ra và cài đặt PEEP thấp có thể góp phần vào sinh lý bệnh học này.
Tầm quan trọng của việc bảo vệ phổi được nhấn mạnh bởi các hậu quả toàn thân của tổn thương phổi: thuật ngữ chấn thương sinh học đã được đặt ra để mô tả khái niệm rằng tổn thương phổi có thể góp phần gây tổn thương cơ quan từ xa và suy đa cơ quan thông qua việc giải phóng các yếu tố gây viêm và các chất trung gian khác. Do đó, việc tối ưu hóa cài đặt thông khí cơ học có thể mang lại lợi ích ngoài việc bảo vệ phổi và có thể bảo vệ chức năng cơ quan toàn thân.
Làm thế nào để bảo vệ phổi?
Các chiến lược khác nhau hướng dẫn cài đặt máy thở tối ưu và có thể giảm thiểu tác động có hại của thở máy và áp lực xuyên phổi cao.
Thể tích khí lưu thông thấp
Thở máy có VT thấp là một phương pháp đã được thiết lập tốt để hạn chế tổn thương phổi do máy thở và đã được chứng minh là cải thiện tỷ lệ tử vong trong các thử nghiệm lâm sàng. Một nghiên cứu ban đầu của Mạng ARDS xuất bản năm 2000 đã so sánh chiến lược VT thấp so với cao và chứng minh lợi ích rõ ràng về tỷ lệ tử vong với phương pháp tiếp cận VT thấp (6 ml/kg trọng lượng cơ thể lý tưởng) so với VT cao hơn (12 ml/ kg trọng lượng cơ thể lý tưởng).
Bảng 1. Thuật ngữ thông khí cơ học
| Áp lực bình nguyên (Pplat) | Được đo trong thời gian tạm dừng hít vào trên máy thở, nó phản ánh áp lực trung bình trong phế nang và đường dẫn khí nhỏ. |
| Độ giãn nở hệ thống hô hấp (CRS) | Crs = VT/(Pplat – PEEP) |
| Tổn thương phổi do thở máy (VILI) | Thuật ngữ này được đặt ra để nhấn mạnh rằng mặc dù máy thở có thể cứu mạng nhưng nó cũng có thể gây thương tích tùy thuộc vào cách cài đặt. VILI đề cập đến chức năng phổi xấu đi do áp dụng thở máy cho phổi dễ mắc bệnh. |
| Độ đàn hồi (E) | Độ đàn hồi (độ cứng): thay đổi áp lực đối với một thay đổi nhất định về thể tích (E = ΔP/ΔV). Độ đàn hồi là nghịch đảo của độ giãn nở (E = 1/Độ giãn nở) |
| Áp lực xuyên phổi (PTP) | Áp lực đường thở – áp lực màng phổi hay chênh lệch áp lực bên trong so với bên ngoài phổi (PTP = Pairway – Ppleural). Đây là áp lực căng phồng thích hợp của phổi. |
| Áp lực màng phổi (PPI) | Áp lực trong khoang màng phổi xung quanh phổi đôi khi được ước tính bằng phép đo áp lực thực quản. |
| Chấn thương xẹp phổi | Tổn thương phổi do lực cắt cao từ việc mở và xẹp theo chu kỳ của các đơn vị phổi bị xẹp nhưng có thể huy động được. |
| Chấn thương sinh học | Tổn thương cơ quan ngoài phổi do tiền viêm và các chất trung gian tuần hoàn khác được giải phóng một cách có hệ thống trong quá trình thông khí gây thương tích. |
Áp lực dương cuối kỳ thở ra
Một nghiên cứu đơn trung tâm đầy hứa hẹn đã xem xét việc điều chỉnh cài đặt PEEP dựa trên việc đo áp lực xuyên phổi.2 Các tác giả đã sử dụng áp kế bóng thực quản để ước tính áp lực màng phổi ở bệnh nhân ARDS. Kết quả gợi ý sự cải thiện trao đổi khí và độ giãn nở hô hấp bằng cách sử dụng chiến lược này. Tuy nhiên, gần đây, Beitler và cộng sự đã công bố kết quả của một nghiên cứu khác sử dụng chiến lược theo dõi áp lực thực quản tương tự để ước tính áp lực xuyên phổi và chuẩn độ đến mức PEEP tối ưu.10 Trong nghiên cứu sau này, nhóm kiểm soát đã sử dụng thang chuẩn độ PEEP/FiO2 cao hơn so với nghiên cứu trước đây. Họ tuyển chọn 200 bệnh nhân mắc ARDS từ trung bình đến nặng (PaO2:FiO2 ≤ 200 mmHg). Khi so sánh với các bệnh nhân đối chứng, không có sự khác biệt về tiêu chí tổng hợp về tử vong và số ngày không thở máy giữa các nhóm. Nghĩa là, điều chỉnh cài đặt máy thở đến áp lực xuyên phổi tối ưu dựa trên đo áp lực thực quản không hiệu quả hơn so với điều chỉnh PEEP đơn giản dựa trên FiO2. Thật thú vị, áp lực đẩy đường thở không khác nhau giữa hai nhóm lúc ban đầu hoặc khi điều trị, cho thấy rằng cả hai chiến lược đều có tác dụng cơ học tương tự nhau. Mặc dù cần nghiên cứu thêm,11–13 việc sử dụng đo áp lực thực quản thường quy trong thực hành lâm sàng nói chung là không cần thiết.14,15
Áp lực đẩy
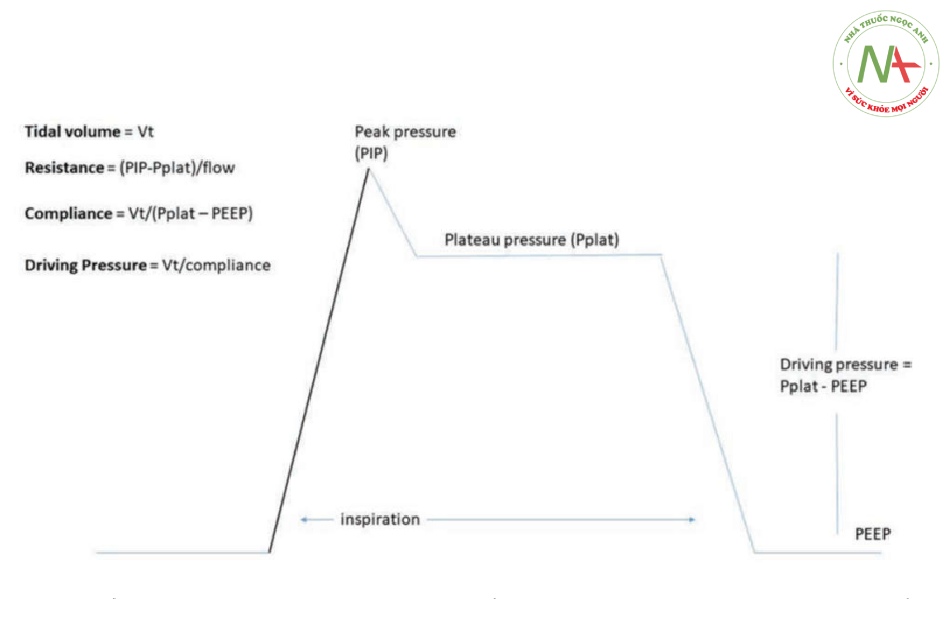
Gần đây, việc điều chỉnh cài đặt bằng cách sử dụng áp lực đẩy được nhắm mục tiêu đã được nâng cao như một phương pháp có thể giảm thiểu tổn thương phổi sau đó và có nhiều tính năng hấp dẫn. Áp lực đẩy được xác định bằng áp lực bình nguyên (áp lực giữ ở cuối thì hít vào) trừ đi PEEP và do đó là yếu tố quyết định chính trong VT được phân phối (Hình 1). Sự khác biệt giữa áp lực đẩy và áp lực xuyên phổi là một điều quan trọng vì cái trước phản ánh sự chênh lệch áp lực trong hơi thở trái ngược với cái sau phản ánh sự chênh lệch áp lực trên phổi. Cả hai giá trị được cho là có liên quan đến stress phổi, mặc dù áp lực xuyên phổi truyền đạt trực tiếp hơn khái niệm này dựa trên các nguyên tắc của Newton. Áp lực đẩy, mặc dù được đo trực tiếp từ máy thở, tùy thuộc vào cả VT và độ giãn nở của hệ hô hấp (áp lực đẩy = VT/độ giãn nở). Cả hai tăng VT và giảm độ giãn nở của hệ hô hấp (phổi, thành ngực) có thể làm tăng áp lực đẩy. Tương tự, áp lực đẩy tăng lên khi áp lực bình nguyên cao hơn cũng như với PEEP thấp hơn, khi tất cả những thứ khác đều như nhau. Do đó, các bác sĩ lâm sàng đang hành nghề nên nhận thức được các thành phần của áp lực đẩy và xem xét các cơ chế cơ bản hơn là điều trị riêng lẻ một biến số.
Năm 2015 Amato và cộng sự16 đã chứng minh rằng áp lực đẩy có thể là yếu tố quan trọng nhất trong việc xác định tổn thương phổi trong quá trình thở máy: Trong một phân tích tổng hợp bệnh nhân riêng lẻ, tổng hợp 3.562 bệnh nhân mắc ARDS trước đây đã tham gia vào chín thử nghiệm ngẫu nhiên riêng biệt đã được phân tích để xác định các yếu tố dự đoán khả năng sống sót. Trong số các cài đặt máy thở, tỷ lệ sống sót có liên quan chặt chẽ nhất với áp lực đẩy, trong khi áp lực bình nguyên, PEEP và VT không dự đoán độc lập tỷ lệ sống sót khi áp lực đẩy đã là đồng biến. Trong các phân tích biến trung gian (mediation analysis) của họ, áp lực đẩy cao hơn dự đoán khả năng sống sót thấp hơn trong khi tăng PEEP hoặc giảm VT chỉ có lợi khi chúng có liên quan đến việc giảm áp lực đẩy. Mặc dù phân tích biến trung gian như vậy không thể thiết lập quan hệ nhân quả, nhưng tác giả kết luận rằng, dựa trên nghiên cứu của họ, áp lực đẩy là biến thông khí dự đoán khả năng sống sót tốt nhất.
Hình 1. Một sơ đồ của dạng sóng hít vào được phân phối trong quá trình thông khí theo chu kỳ thể tích điển hình. Pplat dựa trên thủ thuật giữ cuối thì hít vào. Áp lực đẩy có thể được coi là sự khác biệt giữa Pplat và PEEP, nhưng cũng có thể được tính bằng tỷ lệ của VT với độ giãn nở của hệ hô hấp. PEEP, áp lực dương cuối thì thở ra; PIP, áp lực hít vào đỉnh; Pplat, áp lực bình nguyên; VT, thể tích khí lưu thông.
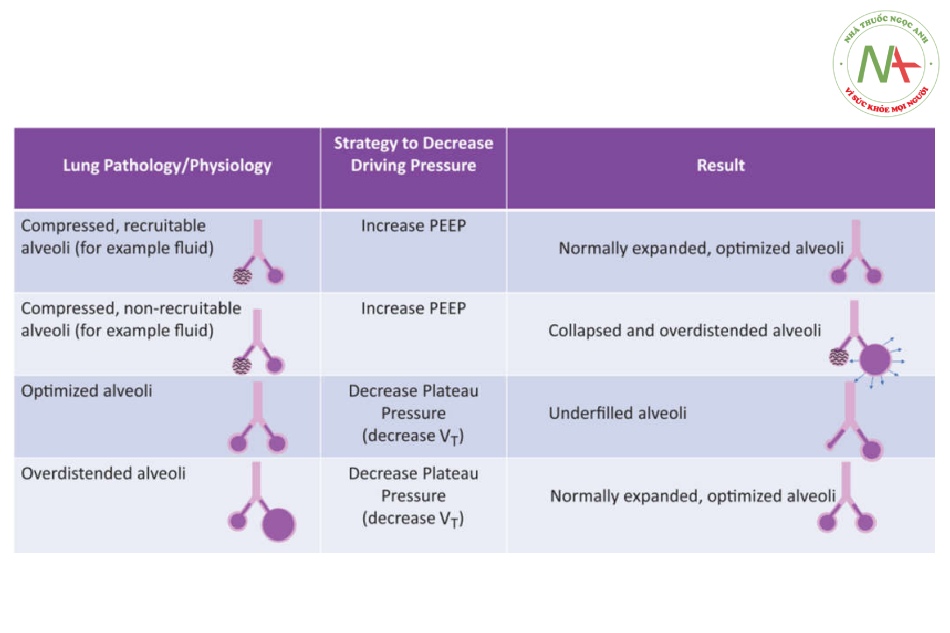
Hình 2. Tác động của việc giảm áp lực đẩy phụ thuộc rất nhiều vào cách đạt được nó và vào đặc tính sinh học cơ bản của phổi. Hình minh họa các kết quả khác nhau có thể xảy ra khi giảm áp lực đẩy, nhấn mạnh sự cần thiết phải tránh đánh giá các biến số một cách riêng rẽ và đánh giá từng bệnh nhân tại giường sau khi thay đổi máy thở cơ học. PEEP, áp lực dương cuối thì thở ra; VT, thể tích khí lưu thông.
Những người khác đã chỉ ra những hạn chế quan trọng của nghiên cứu này.17 Đầu tiên, áp lực đẩy có thể được xác định chính xác nhất ở bệnh nhân thở máy thụ động, nhưng ít rõ ràng hơn khi thở tự nhiên.18 Thứ hai, nhìn chung có thể đạt được việc giảm áp lực đẩy bằng cách giảm VT hoặc tăng PEEP (hoặc kết hợp cả hai), dẫn đến các kịch bản lâm sàng có khả năng rất khác nhau (ví dụ: từ quan điểm huyết động học và/hoặc chấn thương do xẹp phổi). Đáng chú ý, áp lực đẩy có thể được giảm bớt bằng các chiến lược khác nhau (Hình 2) và việc giảm áp lực đẩy đơn thuần, tùy thuộc vào chiến lược nào được sử dụng, có thể không tối ưu hóa đầy đủ cơ học phổi. Một hạn chế khác của các phân tích Amato là các nghiên cứu ban đầu thường được thiết kế với VT tương đối thấp và cố định trong phạm vi hẹp, khiến giá trị tiên đoán của nó khá yếu trên cơ sở thống kê. Do đó, như đã nêu, áp lực đẩy là một biến số quan trọng nhưng có khả năng gây khó khăn trong việc hướng dẫn quản lý bệnh nhân khi sử dụng riêng lẻ.
Sau khi Amato và cộng sự phân tích, nghiên cứu thuần tập quan sát lớn để hiểu tác động toàn cầu của nguy kịch hô hấp cấp tính nghiêm trọng (LUNG SAFE)20 là một cuộc điều tra kéo dài 4 tuần (tiến hành vào mùa đông năm 2014) đối với 459 đơn vị chăm sóc đặc biệt (ICU) từ 50 quốc gia trên khắp năm châu lục và được thiết kế để đánh giá tỷ lệ mắc và kết quả của ARDS trong ICU. Mặc dù kết quả chính của các tác giả là tỷ lệ mắc ARDS trong ICU được nghiên cứu, nhưng các kết quả khác, chẳng hạn như sự công nhận của bác sĩ lâm sàng về ARDS, quản lý máy thở, sử dụng các liệu pháp bổ trợ và kết quả lâm sàng cũng được đưa vào. Kết quả có thể gây ngạc nhiên cho một số người: các tác giả nhận thấy ARDS là một hội chứng chưa được công nhận. Tỷ lệ mắc bệnh là 10,4% trong số tất cả các bệnh nhân nhập viện và 23,4% số ca nhập viện ICU thở máy (xâm lấn hoặc không xâm lấn) được nghiên cứu (29.144 bệnh nhân nhập viện 13.566 bệnh nhân được thở máy và đăng ký). Công nhận của bác sĩ lâm sàng về ARDS tại thời điểm đáp ứng các tiêu chí ARDS chỉ là 34,0% và ARDS cuối cùng chỉ được chẩn đoán ở 60,2% bệnh nhân đáp ứng tiêu chuẩn định nghĩa Berlin.21 Ngoài ra, việc công nhận ARDS có tác dụng hạn chế đối với các chiến lược thông khí. Mặc dù việc công nhận ARDS không ảnh hưởng đáng kể đến VT hoặc áp lực bình nguyên, chẩn đoán ARDS có liên quan đến mức PEEP cao hơn và tăng cường sử dụng các liệu pháp bổ trợ (ví dụ: nằm sấp hoặc phong bế thần kinh cơ), so với không chẩn đoán ARDS. Tuy nhiên, PEEP và việc sử dụng các biện pháp hỗ trợ vẫn thấp hơn dự kiến trong nhóm này.22 Do ARDS có liên quan đến tỷ lệ tử vong cao (tỷ lệ tử vong ở ICU không được điều chỉnh do ARDS là 35,5%; tỷ lệ tử vong tại bệnh viện là 40,0%) và sự công nhận của bác sĩ lâm sàng không dẫn đến những thay đổi nhất quán trong chiến lược máy thở, các tác giả chỉ ra khả năng cải thiện lớn trong việc công nhận và xử trí ARDS. Do sự thay đổi trong việc nhận biết ARDS, một số người đã tranh luận về việc sử dụng các chiến lược bảo vệ phổi thường xuyên hơn (chẳng hạn như VT thấp và/hoặc áp lực đẩy thấp), để tránh thông khí vô tình làm tổn thương phổi ở những bệnh nhân có tình trạng trao đổi khí xấu đi. Phân tích bổ sung của nghiên cứu LUNG SAFE tập trung vào các yếu tố nguy cơ có thể thay đổi được đối với tỷ lệ tử vong trong ARDS. Dữ liệu từ 2.377 bệnh nhân ban đầu tham gia thử nghiệm LUNG SAFE đã được phân tích. Bệnh nhân được đưa vào nếu họ đáp ứng các tiêu chí ARDS vào ngày 1 hoặc 2 sau khi bắt đầu thở máy. Phân tích đa biến cho thấy PEEP thấp hơn, áp lực hít vào đỉnh cao hơn, áp lực bình nguyên cao hơn và áp lực đẩy cao hơn, cũng như nhịp thở tăng, có liên quan đến tỷ lệ tử vong ARDS cao hơn. VT không khác biệt giữa những bệnh nhân sống sót sau ARDS và những người không mắc bệnh. Ở những bệnh nhân mắc ARDS vừa và nặng, áp lực đẩy thấp hơn có liên quan đến tỷ lệ tử vong tại bệnh viện thấp hơn. Tổng hợp lại, những dữ liệu này khi kết hợp với những phát hiện trước đó của Amato và cộng sự đề xuất rằng việc nhắm mục tiêu áp lực đẩy thấp hơn ở bệnh nhân mắc ARDS có thể cải thiện kết quả.
Blondonnet và cộng sự25 gần đây đã xuất bản một nghiên cứu quan sát tiền cứu về những bệnh nhân có nguy cơ phát triển ARDS bằng cách phân tích áp lực đẩy lúc ban đầu và sau 24 giờ. Thật thú vị, toàn bộ nhóm thuần tập có tỷ lệ PaO2:FiO2 cơ bản là 269 ± 88 mmHg, cho thấy một số người đã mắc ARDS dựa trên các định nghĩa đồng thuận hiện tại. Hai trăm hai mươi mốt bệnh nhân đã được ghi danh và 34 (15%) được chẩn đoán mắc ARDS vào ngày thứ 7. Không có sự khác biệt thống kê giữa VT ban đầu (7,7 ± 1,2 ml/kg [không có ARDS] so với 7,4 ± 1,4 ml/kg [ARDS]; P = 0,4) hoặc áp lực bình nguyên ban đầu (cao hơn không đáng kể trong ARDS so với nhóm không có ARDS). Cả áp lực đẩy cơ bản (baseline driving pressure) và nhịp thở đều thấp hơn về mặt thống kê ở nhóm không có ARDS. Các phân tích tiếp theo cho thấy rằng áp lực đẩy cơ bản lớn hơn 16,5 cm H2O có thể dự đoán được sự phát triển của ARDS với độ đặc hiệu là 90%. Tương tự, áp lực đẩy cơ bản nhỏ hơn 7,5 cm H2O rất nhạy cảm trong việc dự đoán những người sẽ không phát triển ARDS. Mặc dù cài đặt máy thở không được điều chỉnh theo áp lực đẩy đặc hiệu (specifc driving pressure), nhưng nghiên cứu này cho thấy rằng áp lực đẩy cao có thể là dấu hiệu cho nguy cơ tổn thương phổi sau này. Giá trị tiên đoán của các giá trị áp lực đẩy trung gian (7,5 đến 16,5 cm H2O) ít rõ ràng hơn, nhưng nói chung, chúng tôi nhắm mục tiêu đến áp lực đẩy thấp, thừa nhận rằng các yếu tố lâm sàng khác (bao gồm huyết động học và trao đổi khí) có thể góp phần vào các quyết định này.
Mặc dù các khái niệm cơ bản về việc sử dụng áp lực đẩy đã được hình thành cho những bệnh nhân thở máy thụ động, một số người đã tranh luận về lợi ích của áp lực đẩy trong quá trình thở tự nhiên. Áp lực đẩy có thể được cơ thể con người kiểm soát trong quá trình thở tự nhiên như một cơ chế bảo vệ: một đánh giá hồi cứu đã kiểm tra xem bệnh nhân có thể có khả năng kiểm soát đối với áp lực đẩy hay không. Georgepoulos và cộng sự phát hiện ra rằng khi các bệnh nhân thở máy bị bệnh nặng được chuyển từ thở máy có kiểm soát (với cài đặt VT) với thông khí hỗ trợ theo tỷ lệ (proportional assist ventilation) (một chế độ điều chỉnh áp lực dựa trên nỗ lực hô hấp), bệnh nhân kiểm soát áp lực đẩy của họ (với áp lực bình nguyên được đo theo cách đã sửa đổi để giải thích cho nỗ lực hít vào của bệnh nhân như đã mô tả trước đây27) trong một khoảng thời gian “an toàn” hẹp (ví dụ: đối với những người có áp lực đẩy lớn hơn hoặc bằng 15 cm H2O khi thở máy có kiểm soát với VT thấp; khi chuyển sang thông khí hỗ trợ theo tỷ lệ, bệnh nhân kiểm soát áp lực đẩy mà không hạn chế VT), cho thấy cơ chế kiểm soát thần kinh hạn chế độ căng của phổi. Do đó, về lý thuyết, có thể có một vòng phản hồi thần kinh giúp giảm nỗ lực hô hấp bằng cách hạn chế áp lực xuyên phổi tối đa. Các tác giả kết luận rằng thở máy bảo vệ phổi có thể được thực hiện mà không cần hạn chế VT. Những phát hiện này mang lại sự tin cậy cho việc sử dụng các mục tiêu áp lực đẩy ở những bệnh nhân đang thở tự nhiên. Hơn nữa, công việc của Bellani và cộng sự đã hỗ trợ các nỗ lực giải thích áp lực đẩy và áp lực đường thở bình nguyên khi đối mặt với nhịp thở tự nhiên.18,28 Nói chung, áp lực bình nguyên vẫn có thể được diễn giải và đo lường trong quá trình thở tự nhiên bằng cách phân tích các dạng sóng, vì có thể xác định được tác động của nỗ lực hô hấp. Đáng chú ý, liên quan đến tự thở, các nghiên cứu gần đây đã đặt câu hỏi về việc sử dụng thuốc ức chế thần kinh cơ trong việc quản lý bệnh nhân mắc ARDS. Papazian và cộng sự trước đây đã cho thấy lợi ích của liệu pháp giãn cơ trong 48 giờ ở bệnh nhân mắc ARDS; tuy nhiên, một nghiên cứu gần đây hơn cho thấy phương pháp tương tự không mang lại lợi ích gì. Do đó, xu hướng hiện tại trong ARDS là tránh dùng thuốc an thần nặng (được định nghĩa là bệnh nhân không đáp ứng, ví dụ: Mức độ Kích động và An thần Richmond -4 hoặc -5) và phong bế thần kinh cơ; kết quả là sự gia tăng bệnh nhân ARDS thở tự nhiên sẽ có khả năng làm phức tạp việc giải thích áp lực đẩy. Tuy nhiên, cho đến khi có thêm dữ liệu, việc hạn chế sử dụng áp lực đẩy đối với những bệnh nhân được thở máy thụ động có vẻ hợp lý.
Áp lực đẩy cũng đã được nghiên cứu ở bệnh nhân phẫu thuật. Park và cộng sự đã chọn ngẫu nhiên 291 bệnh nhân được lên lịch phẫu thuật lồng ngực theo chương trình cần thông khí một phổi cho hai chiến lược quản lý thông khí khác nhau: một nhóm được thông khí với VT tiêu chuẩn thấp (6 ml/kg trọng lượng cơ thể lý tưởng), PEEP là 5 cm H2O và các thao tác huy động khi cần thiết, trong khi nhóm còn lại sử dụng VT thấp, nhưng điều chỉnh PEEP dựa trên áp lực đẩy mục tiêu. Cả hai biến chứng phổi sau phẫu thuật (12,2% trong điều trị thông thường so với 5,5% trong nhóm áp lực đẩy) và ARDS vào ngày hậu phẫu thứ 3 (năm bệnh nhân trong nhóm thông thường; không có bệnh nhân nào trong nhóm áp lực đẩy) đã được ghi nhận; tuy nhiên, không có sự khác biệt về ARDS vào ngày thứ 7 hoặc thời gian nằm ICU hoặc thời gian nằm viện. Đáng chú ý, sự khác biệt trung bình về áp lực đẩy giữa hai nhóm chỉ là 1 cm H2O và PEEP tối ưu trung bình trong nhóm áp lực đẩy chỉ là 3 cm H2O (so với PEEP đã đặt trong chiến lược bảo vệ phổi là 5 cmH2O). Các tác giả lập luận rằng thông khí cá nhân, không phải áp lực đẩy, là chìa khóa cho những phát hiện của họ. Mặc dù những dữ liệu này cho thấy lợi ích có thể có trong nhóm mục tiêu áp lực đẩy, nhưng sự khác biệt nhỏ về mức độ phơi nhiễm và thiếu sự khác biệt đáng kể về kết quả khiến tác động lâm sàng lớn khó xảy ra và do đó, không thay đổi thực hành lâm sàng cho đến nay. Do đó, áp lực đẩy có thể được theo dõi trong phòng mổ, nhưng một lần nữa, dữ liệu không hỗ trợ việc sử dụng nó một cách cô lập để hướng dẫn thông khí cơ học.
Nhắm mục tiêu áp lực đẩy cũng có thể hữu ích ở những bệnh nhân sử dụng oxygen hóa qua màng ngoài cơ thể: mặc dù các nghiên cứu toàn diện trên người còn ít cho đến nay, nhưng các nghiên cứu sử dụng mô hình lợn có thể chỉ ra tính hữu ích của việc hạn chế áp lực đẩy trong môi trường như vậy. Araos và cộng sự33 gây ra tổn thương phổi ở một mô hình lợn, đặt chúng trên oxygen hóa qua màng ngoài cơ thể tĩnh mạch-tĩnh mạch và ngẫu nhiên hóa chúng theo một trong ba chiến lược thở máy một nhóm với áp lực đẩy mục tiêu là 10 cm H2O và RR và VT thấp, và hai nhóm kia với các mức PEEP khác nhau, RR và VT cao hơn, và không có mục tiêu áp lực đẩy. Trao đổi khí được quản lý bởi mạch oxygen hóa màng ngoài cơ thể, nhưng áp lực đẩy cao hơn đáng kể ở hai nhóm sau (14 đến 15 cm H2O trong nhóm 6 ml/kg và 21 đến 24 cm H2O trong nhóm 10 ml/kg). Điểm tổn thương phổi mô học thấp nhất trong nhóm được thở máy với chiến lược áp lực thấp. Các nghiên cứu tiền cứu ở người về oxygen hóa màng ngoài cơ thể sử dụng áp lực đẩy so với tiêu chuẩn hiện tại về nhịp thở thấp, VT tối thiểu và PEEP vừa phải được đảm bảo. Tuy nhiên, mục tiêu áp lực đẩy thấp có vẻ hợp lý đối với bệnh nhân suy hô hấp đang được cung cấp oxygen hóa qua màng ngoài cơ thể cho đến khi có thêm dữ liệu.
Định hướng tương lai
Mặc dù khái niệm về áp lực đẩy đã đạt được sức hút trong những năm gần đây, vẫn còn những câu hỏi về cách tốt nhất để thực hiện các chiến lược được hướng dẫn bởi phương pháp này trong phòng mổ và ICU. Một số vấn đề có thể được giải quyết trong tương lai bởi các bác sĩ lâm sàng và các nhà nghiên cứu.
- Mặc dù một số dữ liệu ủng hộ việc hạn chế áp lực đẩy trong trường hợp bệnh nhân có nguy cơ mắc ARDS, nhưng hiện tại không có đủ dữ liệu để hỗ trợ chiến lược này ở bệnh nhân trong phòng mổ. Do đó, một hướng trong tương lai có thể là nghiên cứu các phương pháp tiếp cận dựa trên áp lực đẩy trong phòng mổ (đối với các loại phẫu thuật khác nhau) để kiểm tra xem liệu phương pháp này có giúp cải thiện nguy cơ suy hô hấp sau phẫu thuật, thời gian thở máy hoặc tỷ lệ mắc ARDS hay không.
- Chiến lược thở máy sử dụng phương pháp dựa trên áp lực đẩy có thể mang lại kết quả tốt hơn so với phương pháp truyền thống theo khuyến nghị của Mạng ARDS ở những bệnh nhân mắc hoặc có nguy cơ mắc ARDS không? Việc cô lập một biến cụ thể chẳng hạn như áp lực đẩy sẽ khó đạt được sự độc lập của VT và PaCO2, nhưng các lộ trình thửnghiệm có thể được phát triển tùy thuộc vào biến độc lập nào sẽ được ưu tiên. Trong bối cảnh nghiên cứu, các nghiên cứu trong quá trình hỗ trợ ngoài cơ thể có thể được sử dụng để cách ly một biến số trong quá trình thở máy vì quá trình trao đổi khí có thể được kiểm soát độc lập.
-
- Từ quan điểm thực hiện, liệu một chiến lược dựa trên áp lực đẩy có vượt trội hơn so với cách tiếp cận truyền thống có thể yêu cầu điều chỉnh PEEP, áp lực bình nguyên và VT không?34 Thao tác máy thở cơ học để nhắm mục tiêu áp lực đẩy thấp có thể dễ dàng tự động hóa và giảng dạy hơn. Việc tuân thủ một giao thức cụ thể có thể là một kết quả đáng quan tâm vì cách tiếp cận dựa trên áp lực đẩy có thể dễ dàng thực hiện hơn ở đầu giường.
- Nghiên cứu sinh lý sử dụng các phương thức hình ảnh như chụp cắt lớp trở kháng điện có thể được sử dụng để đánh giá tác động của các thao tác khác nhau đối với áp lực đẩy.35Bởi vì tăng PEEP hoặc giảm áp lực bình nguyên tác động đến áp lực đẩy, kết quả là sự khác biệt về phân bố tổn thương phổi/xẹp phổi có thể rất quan trọng để đánh giá,36 nhưng cũng có thể khác nhau tùy thuộc vào lượng phổi có sẵn để trao đổi khí dựa trên hình ảnh của thể tích phổi có thể huy động được.
- Các nghiên cứu cơ bản về kéo căng tế bào và biến dạng của phổi đang được tiến hành nhưng có thể được sử dụng để xác định lực nào có thể có tác động lớn nhất đối với tổn thương và quá trình sửa chữa. Những hiểu biết sâu hơn về stress và strain của tế bào có thể được sử dụng để hướng dẫn các chiến lược nhằm tối ưu hóa việc bảo vệ phổi.
Tóm lược
Bất chấp những câu hỏi kéo dài, dữ liệu hiện có cung cấp một số đảm bảo rằng áp lực đẩy là một bổ sung hữu ích cho kho vũ khí của chúng tôi (Bảng 2), nhưng không nên được sử dụng riêng lẻ do có vô số yếu tố ảnh hưởng đến giá trị, cách diễn giải và những thay đổi của nó theo thời gian. Nói chung, cài đặt máy thở nên được cá nhân hóa dựa trên bản chất của bệnh phổi, huyết động học của bệnh nhân, trao đổi khí, thể trạng cơ thể và các yếu tố khác. Cho đến khi có nhiều dữ liệu chính xác hơn, việc nhắm mục tiêu tăng áp lực trong ARDS nên được xem xét trong bối cảnh các biến thông khí cơ học khác và các yếu tố lâm sàng, bao gồm cả huyết động, cũng như trao đổi khí.
Khuyến nghị lâm sàng về áp lực đẩy và ARDS
- Áp lực đẩy không nên được sử dụng một cách độc lập mà nên được giải thích trong bối cảnh PEEP, VT
và cơ học phổi. - Tăng áp lực đẩy nên nhắc nhở đánh giá tại giường về cách tốt nhất để thay đổi cài đặt và giảm áp lực
đẩy, ví dụ: giảm VT, lợi tiểu hoặc an thần. - Trong phạm vi có thể, nên giảm áp lực đẩy theo thời gian, thừa nhận rằng tăng CO2 máu, khó thở và
mất đồng bộ bệnh nhân/máy thở có thể xảy ra khi thông khí phút thấp. - Ở những bệnh nhân có nguy cơ mắc ARDS, việc giảm thiểu áp lực đẩy có thể liên quan đến việc giảm
nguy cơ mắc ARDS. Dữ liệu liên quan đến lợi ích lâm sàng ít hấp dẫn hơn so với ARDS đã được thiết
lập.
References
- Brower RG, Hubmayr RD, Slutsky AS: Lung stress and strain in acute respiratory distress syndrome: Good ideas for clinical management? Am J Respir Crit Care Med 2008; 178:323–4 [PubMed] [Google Scholar]
- Talmor D, Sarge T, Malhotra A, O’Donnell CR, Ritz R, Lisbon A, Novack V, Loring SH: Mechanical ventilation guided by esophageal pressure in acute lung N Engl J Med 2008; 359:2095–104 [PMC free article] [PubMed] [Google Scholar]
- Malhotra A: Low-tidal-volume ventilation in the acute respiratory distress syndrome. N Engl J Med 2007; 357:1113–20 [PMC free article] [PubMed] [Google Scholar]
- Kneyber MC, Zhang H, Slutsky AS: Ventilator-induced lung injury. Similarity and differences between children and Am J Respir Crit Care Med 2014; 190:258–65 [PMC free article] [PubMed] [Google Scholar]
- Hepokoski M, Englert JA, Baron RM, Crotty- Alexander LE, Fuster MM, Beitler JR, Malhotra A, Singh P: Ventilator- induced lung injury increases expression of endothelial inflammatory mediators in the kidney. Am J Physiol Renal Physiol 2017; 312:F654–60 [PMC free article] [PubMed] [Google Scholar]
- Imai Y, Parodo J, Kajikawa O, de Perrot M, Fischer S, Edwards V, Cutz E, Liu M, Keshavjee S, Martin TR, Marshall JC, Ranieri VM, Slutsky AS: Injurious mechanical ventilation and end-organ epithelial cell apoptosis and organ dysfunction in an experimental model of acute respiratory distress syndrome. JAMA 2003; 289:2104–12 [PubMed] [Google Scholar]
- Ranieri VM, Giunta F, Suter PM, Slutsky AS: Mechanical ventilation as a mediator of multisystem organ failure in acute respiratory distress JAMA 2000; 284:43–4 [PubMed] [Google Scholar]
- Talmor D, Sarge T, O’Donnell CR, Ritz R, Malhotra A, Lisbon A, Loring SH: Esophageal and transpulmonary pressures in acute respiratory failure. Crit Care Med 2006; 34:1389–94 [PMC free article] [PubMed] [Google Scholar]
- Brower RG, Matthay MA, Morris A, Schoenfeld D, Thompson BT, Wheeler A; Acute Respiratory Distress Syndrome Network: Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress N Engl J Med 2000; 342:1301–8 [PubMed] [Google Scholar]
- Beitler JR, Sarge T, Banner-Goodspeed VM, Gong MN, Cook D, Novack V, Loring SH, Talmor D, Group EP-S : Effect of titrating positive end-expiratory pressure (PEEP) with an esophageal pressure-guided strategy vs an empirical high PEEP-Fio2 strategy on death and days free from mechanical ventilation among patients with acute respiratory distress syndrome: a randomized clinical trial. JAMA 2019 [PMC free article] [PubMed] [Google Scholar]
- Baedorf Kassis E, Loring SH, Talmor D: Should we titrate peep based on end-expiratory transpulmonary pressure?-yes. Ann Transl Med 2018; 6:390. [PMC free article] [PubMed] [Google Scholar]
- Baedorf Kassis E, Loring SH, Talmor D: Lung volumes and transpulmonary pressure are decreased with expiratory effort and restored with passive breathing in ARDS: A reapplication of the traditional Campbell diagram. Intensive Care Med 2018; 44:534–6 [PubMed] [Google Scholar]
- Baedorf Kassis E, Loring SH, Talmor D: Esophageal pressure:research or clinical tool? Med Klin Intensivmed Notfmed 2018; 113(Suppl 1):13–20 [PubMed] [Google Scholar]
- Akoumianaki E, Maggiore SM, Valenza F, Bellani G, Jubran A, Loring SH, Pelosi P, Talmor D, Grasso S, Chiumello D, Guérin C, Patroniti N, Ranieri VM, Gattinoni L, Nava S, Terragni PP, Pesenti A, Tobin M, Mancebo J, Brochard L; PLUG Working Group (Acute Respiratory Failure Section of the European Society of Intensive Care Medicine): The application of esophageal pressure measurement in patients with respiratory Am J Respir Crit Care Med 2014; 189:520–31 [PubMed] [Google Scholar]
- Chiumello D, Carlesso E, Brioni M, Cressoni M: Airway driving pressure and lung stress in ARDS patients. Crit Care 2016; 20:276. [PMC free article] [PubMed] [Google Scholar]
- Amato MB, Meade MO, Slutsky AS, Brochard L, Costa EL, Schoenfeld DA, Stewart TE, Briel M, Talmor D, Mercat A, Richard JC, Carvalho CR, Brower RG:Driving pressure and survival in the acute respiratory distress syndrome. N Engl J Med 2015; 372:747–55 [PubMed] [Google Scholar]
- Loring SH, Malhotra A: Driving pressure and respiratory mechanics in ARDS. N Engl J Med 2015; 372:776–7 [PMC free article] [PubMed] [Google Scholar]
- Bellani G, Grassi A, Sosio S, Foti G: Plateau and driving pressure in the presence of spontaneous breathing. Intensive Care Med 2019; 45:97–8 [PubMed] [Google Scholar]
- Lanspa MJ, Peltan ID, Jacobs JR, Sorensen JS, Carpenter L, Ferraro JP, Brown SM, Berry JG, Srivastava R, Grissom CK: Driving pressure is not associated with mortality in mechanically ventilated patients without Crit Care 2019; 23:424. [PMC free article] [PubMed] [Google Scholar]
- Bellani G, Laffey JG, Pham T, Fan E, Brochard L, Esteban A, Gattinoni L, van Haren F, Larsson A, McAuley DF, Ranieri M, Rubenfeld G, Thompson BT, Wrigge H, Slutsky AS, Pesenti A; LUNG SAFE Investigators; ESICM Trials Group: Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 JAMA 2016; 315:788–800 [PubMed] [Google Scholar]
- Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, Caldwell E, Fan E, Camporota L, Slutsky AS; ARDS Definition Task Force: Acute respiratory distress syndrome: The Berlin definition. JAMA 2012; 307:2526–33 [PubMed] [Google Scholar]
- Cornejo RA, Diaz JC, Tobar EA, Bruhn AR, Ramos CA, Gonzalez RA, Repetto CA, Romero CM, Galvez LR, Llanos O, Arellano DH, Neira WR, Diaz GA, Zamorano AJ, Pereira GL: Effects of prone positioning on lung protection in patients with acute respiratory distress syndrome. Am J Respir Crit Care Med 2013; 188:440–8 [PubMed] [Google Scholar]
- Rubenfeld GD, Shankar-Hari M: Lessons from ARDS for non-ARDS research: Remembrance of trials JAMA 2018; 320:1863–5 [PubMed] [Google Scholar]
- Laffey JG, Bellani G, Pham T, Fan E, Madotto F, Bajwa EK, Brochard L, Clarkson K, Esteban A, Gattinoni L, van Haren F, Heunks LM, Kurahashi K, Laake JH, Larsson A, McAuley DF, McNamee L, Nin N, Qiu H, Ranieri M, Rubenfeld GD, Thompson BT, Wrigge H, Slutsky AS, Pesenti A; LUNG SAFE Investigators and the ESICM Trials Group: Potentially modifiable factors contributing to outcome from acute respiratory distress syndrome: The LUNG SAFE Intensive Care Med 2016; 42:1865–76 [PubMed] [Google Scholar]
- Blondonnet R, Joubert E, Godet T, Berthelin P, Pranal T, Roszyk L, Chabanne R, Eisenmann N, Lautrette A, Belville C, Cayot S, Gillart T, Souweine B, Bouvier D, Blanchon L, Sapin V, Pereira B, Constantin JM, Jabaudon M: Driving pressure and acute respiratory distress syndrome in critically ill patients. Respirology 2019; 24:137–45 [PubMed] [Google Scholar]
- Georgopoulos D, Xirouchaki N, Tzanakis N, Younes M: Driving pressure during assisted mechanical ventilation: Is it controlled by patient brain? Respir Physiol Neurobiol 2016; 228:69–75 [PubMed] [Google Scholar]
- Younes M, Webster K, Kun J, Roberts D, Masiowski B: A method for measuring passive elastance during proportional assist Am J Respir Crit Care Med 2001; 164:50–60 [PubMed] [Google Scholar]
- Bellani G, Grasselli G, Teggia-Droghi M, Mauri T, Coppadoro A, Brochard L, Pesenti A: Do spontaneous and mechanical breathing have similar effects on average transpulmonary and alveolar pressure? A clinical crossover study. Crit Care 2016; 20:142. [PMC free article] [PubMed] [Google Scholar]
- Bellani G, Grassi A, Sosio S, Gatti S, Kavanagh BP, Pesenti A, Foti G: Driving pressure is associated with outcome during assisted ventilation in acute respiratory distress syndrome. Anesthesiology 2019; 131:594–604 [PubMed] [Google Scholar]
- National Heart L, Blood Institute PCTN, Moss M, Huang DT, Brower RG, Ferguson ND, Ginde AA, Gong MN, Grissom CK, Gundel S, Hayden D, Hite RD, Hou PC, Hough CL, Iwashyna TJ, Khan A, Liu KD, Talmor D, Thompson BT, Ulysse CA, Yealy DM, Angus DC: Early neuromuscular blockade in the acute respiratory distress syndrome. N Engl J Med 2019; 380: 1997–2008 [PMC free article] [PubMed] [Google Scholar]
- Papazian L, Forel JM, Gacouin A, Penot-Ragon C, Perrin G, Loundou A, Jaber S, Arnal JM, Perez D, Seghboyan JM, Constantin JM, Courant P, Lefrant JY, Guérin C, Prat G, Morange S, Roch A; ACURASYS Study Investigators: Neuromuscular blockers in early acute respiratory distress syndrome. N Engl J Med 2010; 363:1107–16 [PubMed] [Google Scholar]
- Park M, Ahn HJ, Kim JA, Yang M, Heo BY, Choi JW, Kim YR, Lee SH, Jeong H, Choi SJ, Song IS: Driving pressure during thoracic surgery: A randomized clinical trial. Anesthesiology 2019; 130:385–93 [PubMed] [Google Scholar]
- Araos J, Alegria L, Garcia P, Cruces P, Soto D, Erranz B, Amthauer M, Salomon T, Medina T, Rodriguez F, Ayala P, Borzone GR, Meneses M, Damiani F, Retamal J, Cornejo R, Bugedo G, Bruhn A: Near-apneic ventilation decreases lung injury and fibroproliferation in an acute respiratory distress syndrome model with extracorporeal membrane oxygenation. Am J Respir Crit Care Med 2019; 199:603–12 [PubMed] [Google Scholar]
- Carson SS, Goss CH, Patel SR, Anzueto A, Au DH, Elborn S, Gerald JK, Gerald LB, Kahn JM, Malhotra A, Mularski RA, Riekert KA, Rubenfeld GD, Weaver TE, Krishnan JA; American Thoracic Society Comparative Effectiveness Research Working Group: An official American Thoracic Society research statement: Comparative effectiveness research in pulmonary, critical care, and sleep medicine. Am J Respir Crit Care Med 2013; 188:1253–61 [PMC free article] [PubMed] [Google Scholar]
- Yoshida T, Piraino T, Lima CAS, Kavanagh BP, Amato MBP, Brochard L: Regional ventilation displayed by electrical impedance tomography as an incentive to decrease positive end-expiratory pressure. Am J Respir Crit Care Med 2019; 200:933–7 [PubMed] [Google Scholar]
- Malhotra A, Drazen JM: High-frequency oscillatory ventilation on shaky N Engl J Med 2013; 368:863–5 [PMC free article] [PubMed] [Google Scholar]
- Beitler JR, Majumdar R, Hubmayr RD, Malhotra A, Thompson BT, Owens RL, Loring SH, Talmor D: Volume delivered during recruitment maneuver predicts lung stress in acute respiratory distress syndrome. Crit Care Med 2016; 44:91–9 [PMC free article] [PubMed] [Google Scholar]
- Hubmayr RD, Malhotra A: Still looking for best PEEP. Anesthesiology 2014; 121:445–6 [PMC free article] [PubMed] [Google Scholar]
- Hubmayr RD, Shore SA, Fredberg JJ, Planus E, Panettieri RA Jr, Moller W, Hey der J, Wang N: Pharmacological activation changes stiffness of cultured human airway smooth muscle cells. Am J Physiol 1996; 271(5 Pt 1):C1660– 8 [PubMed] [Google Scholar]