Ung thư
Ung thư đại trực tràng: Nguyên nhân, chẩn đoán và điều trị theo BMJ
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nhà thuốc Ngọc Anh – Để tải bài viết Ung thư đại trực tràng: Nguyên nhân, chẩn đoán và điều trị theo BMJ file PDF xin vui lòng click vào link ở đây.
Tóm tắt
◊ Loại ung thư phổ biến thứ ba ở các nước phương Tây.
◊ Hiếm gặp ở người dưới 40 tuổi.
◊ Các triệu chứng không đặc hiệu và thường xuyên xuất hiện ở bệnh đại trực tràng lành tính.
◊ Phẫu thuật cắt bỏ là biện pháp điều trị chữa khỏi chính.
◊ Điều trị theo phương thức kết hợp (hóa trị liệu, xạ trị, cắt bỏ khối di căn) làm tăng khả năng sống sót ở các ca bệnh chọn lọc.
Thông tin cơ bản
Định nghĩa
Phần lớn ung thư đại trực tràng là ung thư biểu mô tuyến phát sinh từ tế bào biểu mô. Khoảng 71% trường hợp ung thư đại trực tràng mới phát sinh từ đại tràng và 29% phát sinh từ trực tràng.[1] Các loại khối u đại trực tràng ác tính ít gặp hơn là khối u carcinoid, khối u tế bào stroma đường tiêu hóa và u lympho. Tuổi cao là yếu tố nguy cơ lớn nhất của ung thư biểu mô tuyến đại trực tràng đơn phát với 99% trường hợp gặp ở người từ 40 tuổi trở lên.
Dịch tễ học
Ung thư đại trực tràng là loại ung thư phổ biến thứ ba ở các nước phương Tây. Trên toàn thế giới, tỷ lệ mắc mới ung thư đại trực tràng cao nhất ở châu Âu, Bắc Mỹ và Úc; thấp nhất ở châu Phi và châu Á.
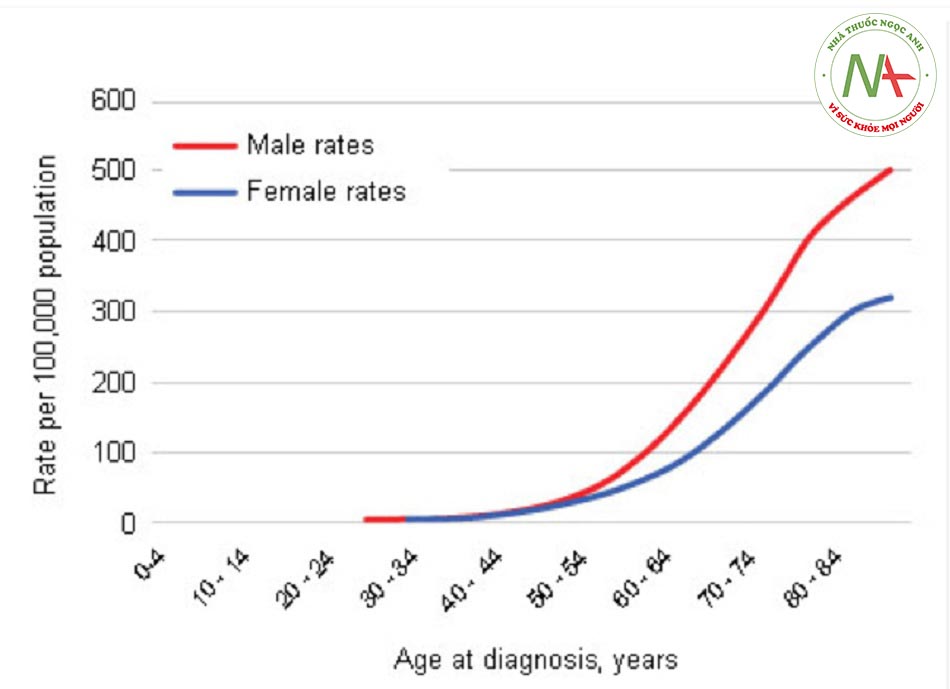
Nguy cơ phát triển ung thư đại trực tràng cả đời là 5,42% và là nguyên nhân đứng thứ ba dẫn đến tử vong do ung thư tại Hoa Kỳ ở cả nam và nữ giới.[5] Nghiên cứu ung thư ở Anh đã chỉ ra tỷ lệ tử vong do ung thư đại trực tràng đã giảm 30% trong 20 năm qua.[6] Cụ thể là ung thư đại trực tràng là nguyên nhân gây ra 38 ca tử vong trên 100.000 người dân năm 1995 đã giảm xuống 26 ca trên 100.000 người dân vào năm 2015. Số liệu này tương đương với mức giảm tỷ lệ tử vong do ung thư đại trực tràng từ 17.600 năm 1995 xuống còn 15.800 vào năm 2015 có tính đến sự thay đổi số liệu dân số.
Tại Hoa Kỳ, tỷ lệ mắc mới ung thư đại trực tràng là 44,2 trên 100.000 ở nam giới và 33,6 trên 100.000 ở nữ giới.[7] Tuổi tác là yếu tố nguy cơ chính gây ra ung thư đại trực tràng lẻ tẻ, bệnh hiếm khi xảy ra trước 40 tuổi. Tại Hoa Kỳ, từ năm 2000 đến 2004, tuổi trung bình tại thời điểm chẩn đoán ung thư đại tràng và trực tràng là 71 tuổi.[5] Tỷ lệ mắc mới điều chỉnh theo độ tuổi là 51,6 trên 100.000 nam giới và nữ giới mỗi năm. Tỷ lệ mắc mới và tỷ lệ tử vong ở người gốc La tinh, người châu Á, người dân đảo Thái Bình Dương, người Mỹ da đỏ và người bản địa Alaska thấp hơn nhiều so với người da trắng và da đen.[5] Sự chênh lệch này có thể do khác biệt về độ nhạy di truyền. Trong 10 năm qua, tỷ lệ mắc mới và tỷ lệ tử vong do ung thư đại trực tràng đã giảm ở mọi quần thể ngoại trừ người Mỹ da đỏ và người bản địa Alaska. Tỷ lệ mắc mới và tỷ lệ tử vong là tương đương nhau giữa nam và nữ giới cho đến tuổi 50 thì tỷ lệ ở nam giới sẽ cao hơn.
Một nghiên cứu thuần tập trên một quần thể bao gồm trên 60.000 người nội soi đại tràng ở độ tuổi từ 66 đến 75, phát hiện khả năng mắc ung thư đại trực tràng ở người da đen lớn tuổi cao hơn ở người lớn da trắng tại thời điểm từ 6 đến 59 tháng sau khi nội soi đại tràng.[8] Nghiên cứu đã chỉ ra xác suất mắc ung thư là 7,1% ở bệnh nhân là người da đen so với 5,8% ở bệnh nhân là người da trắng. Hiệu chỉnh với tỷ lệ phát hiện polyp (chỉ số đánh giá chất lượng nội soi đại tràng) không loại trừ được sự khác biệt có ý nghĩa thống kê giữa hai chủng tộc này. Hiệu chỉnh với độ tuổi, giới tính và khu vực địa lý cũng không làm thay đổi kết quả.
Phân bố vùng giải phẫu của ung thư đại trực tràng cũng khác nhau theo độ tuổi và giới tính. Nhìn chung, ung thư đại trực tràng có thể ở đại tràng gần (manh tràng, đại tràng lên và đại tràng ngang), đại tràng xa (đại tràng xuống, đại tràng sigma) hoặc trực tràng (trực tràng sigma, trực tràng). Các nghiên cứu nhân khẩu học đã chứng minh khối u đại tràng gần phổ biến hơn ở bệnh nhân nữ và bệnh nhân lớn tuổi. Các tổn thương xa hơn thường gặp hơn ở bệnh nhân nam và trẻ tuổi.[9] Ví dụ, tỷ lệ mắc ung thư đại tràng gần ở nam giới chỉ cao hơn một chút so với nữ giới; tuy nhiên, tỷ lệ mắc ung thư trực tràng của nam giới trên nữ giới là gần 1,7.[10]
Bệnh căn học
Ung thư đại trực tràng có mối tương tác phức tạp giữa các yếu tố di truyền và môi trường.
Yếu tố di truyền:
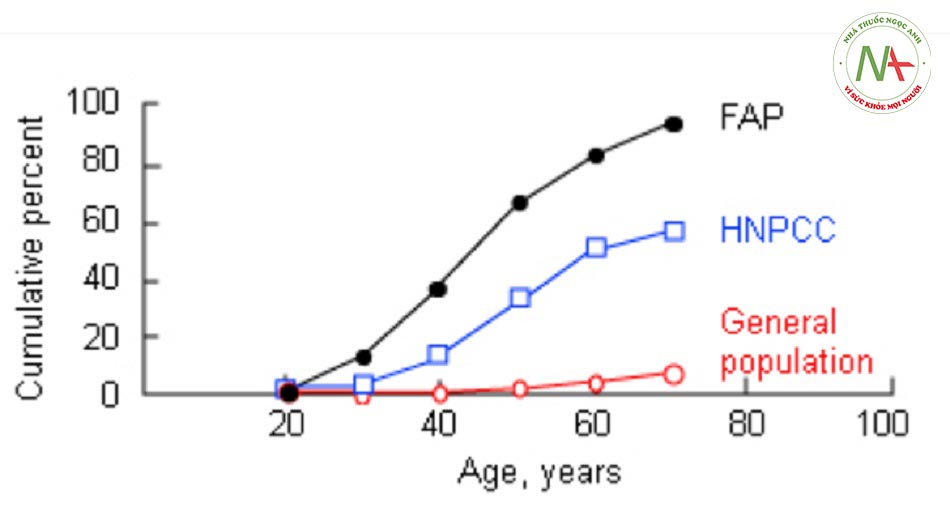
- Phần lớn ung thư đại trực tràng là đơn phát chứ không phải do yếu tố gia đình, nhưng bên cạnh tuổi tác, tiền sử gia đình cũng là yếu tố nguy cơ thường gặp nhất. Nguy cơ mắc ung thư đại trực tràng tăng gấp 2 đến 3 lần ở những người có tiền sử gia đình có một thành viên có quan hệ trực hệ mắc bệnh và nguy cơ này còn tăng cao hơn nếu ung thư phát triển ở tuổi còn trẻ (<45 tuổi). Nguy cơ mắc ung thư đại trực tràng tăng gấp 3 đến 4 lần nếu có 2 thành viên có quan hệ trực hệ mắc bệnh.[11] Các hội chứng ung thư có tính gia đình đã xác định rõ như bệnh đa polyp dạng tuyến gia đình (FAP) và hội chứng Lynch là thường gặp nhất trong các hội chứng ung thư có tính gia đình và liên quan đến các khiếm khuyết của một gen. Tuy nhiên, các hội chứng này chỉ chiếm khoảng 5% đến 6% các trường hợp ung thư đại trực tràng.
Tuy nhiên, ngày càng làm sáng tỏ đặc điểm phân tử của ung thư đại tràng và trực tràng ở người.((Cancer Genome Atlas Network. Comprehensive molecular characterization of human colon and rectal cancer. Nature. 2012;487:330-337. Toàn văn Tóm lược))
Yếu tố môi trường:
- Béo phì góp phần làm tăng nguy cơ ung thư đại tràng gấp 1,5 lần so với những người có cân nặng bình thường và cũng liên quan đến tăng nguy cơ tử vong do bệnh này.((Martinez ME, Giovannucci E, Spiegelman D, et al. Leisure-time physical activity, body size, and colon cancer in women. Nurses’ Health Study Research Group. J Natl Cancer Inst. 1997;89:948-955. Toàn văn Tóm lược)) ((Calle EE, Rodriguez C, Walker-Thurmond K, et al. Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults. N Engl J Med. 2003 Apr 24;348(17):1625-38. Toàn văn Tóm lược)) Béo phì, tiêu thụ nhiều năng lượng và ít hoạt động thể lực có thể là các yếu tố nguy cơ phối hợp((Mao Y, Pan S, Wen SW, et al. Physical inactivity, energy intake, obesity and the risk of rectal cancer in Canada. Int J Cancer. 2003;105:831-837. Tóm lược)) ((Wolin KY, Yan Y, Colditz GA, Lee IM. Physical activity and colon cancer prevention: a meta-analysis. Br J Cancer. 2009;100:611-616. Toàn văn Tóm lược)) Hầu hết các nghiên cứu (nhưng không phải tất cả) cho thấy có mối tương quan hệ tỷ lệ nghịch giữa lượng chất xơ tiêu thụ và nguy cơ mắc ung thư đại trực tràng.((Ferguson LR, Harris PJ. The dietary fibre debate: more food for thought. Lancet. 2003;361:1487-1488. Tóm lược)) Các nghiên cứu tiến cứu lớn với các giai đoạn theo dõi lâu dài đã chỉ ra rằng tiêu thụ lượng lớn thịt màu đỏ và đã chế biến có liên quan với tăng nguy cơ mắc ung thư đại trực tràng.((Chao A, Thun MJ, Connell CJ, et al. Meat consumption and risk of colorectal cancer. JAMA. 2005;293:172-182. Toàn văn Tóm lược)) ((Norat T, Bingham S, Ferrari P, et al. Meat, fish, and colorectal cancer risk: the European Prospective Investigation into cancer and nutrition. J Natl Cancer Inst. 2005;97:906-916. Toàn văn Tóm lược)) ((Willett WC, Stampfer MJ, Colditz GA, et al. Relation of meat, fat, and fiber intake to the risk of colon cancer in a prospective study among women. N Engl J Med. 1990;323:1664-1672. Tóm lược))
Sinh lý bệnh học
Ở phần lớn các trường hợp, ung thư đại trực tràng tiến triển từ polyp dạng tuyến loạn sản. Có quy trình nhiều bước liên quan đến bất hoạt của nhiều loại gen sửa chữa ADN và chất ức chế khối u, cùng với kích hoạt đồng thời các gen gây ung thư. Điều này thuận lợi cho sự tăng trưởng có chọn lọc tế bào biểu mô của đại tràng và thúc đẩy chuyển dạng từ biểu mô đại tràng bình thường thành polyp dạng tuyến và thành ung thư đại trực tràng xâm lấn.[21]
Đột biến dòng mầm là cơ sở của các hội chứng ung thư đại tràng di truyền đã được mô tả đầy đủ, trong khi đó các ung thư đơn phát là do tích lũy từng bước các đột biến gen soma. Đột biến dòng mầm trong gen ức chế khối u đa polyp dạng tuyến (APC) là nguyên nhân dẫn đến bệnh đa polyp dạng tuyến có tính chất gia đình của hội chứng di truyền trội. Biểu hiện lâm sàng của bệnh thường thấy khi theo sau đột biến di truyền một alen APC là đột biến tấn công thứ hai hoặc xóa alen thứ hai.
Ung thư đại tràng lan rộng đến hạch vùng, thông qua dẫn lưu tĩnh mạch ruột đến gan và qua đường máu đến phổi, và ít gặp hơn là đến xương và não. Tuy nhiên, khi tỷ lệ sống sót cải thiện bằng hóa trị liệu toàn thân, di căn đến xương và não đã ngày càng được ghi nhận.[22]
Phân loại
Cơ sở
Vào năm 1929, Cuthbert Dukes đã đưa ra cách phân loại dựa trên sự tiến triển theo từng giai đoạn của quá trình ung thư trực tràng xâm lấn cục bộ – khu vực. Phân loại này đã được chỉnh sửa nhiều lần nhằm làm tăng giá trị tiên lượng. Hệ thống Dukes sửa đổi được sử dụng rộng rãi nhất là bản của Astler và Coller.[2]
Gần đây, Ủy ban Phối hợp Ung thư Hoa Kỳ (AJCC) đã đề xuất phân loại TNM để đánh giá mức độ khối u nguyên phát (T), tình trạng của hạch vùng (N) và có/hoặc không có di căn xa (M) nhằm thống nhất cách phân loại ung thư đại trực tràng. Mặc dù phân loại Dukes và các hệ thống phân giai đoạn Astler-Coller chỉnh sửa (MAC) đôi khi vẫn được sử dụng, AJCC là hệ thống phân giai đoạn thường được sử dụng và phù hợp nhất để ghi nhận về mặt mô bệnh học
Phân giai đoạn TNM AJCC[3]
Khối u nguyên phát (T):
- Tx: Không thể đánh giá khối u nguyên phát
- T0: Không có bằng chứng về khối u nguyên phát
- Tis: Khối u chỉ liên quan đến niêm mạc. Cũng được biết đến là ung thư biểu mô nội mạc (ung thư biểu mô tại chỗ)
- T1: Khối u lan qua niêm mạc và vào lớp dưới niêm mạc
- T2: Khối u lan qua lớp dưới niêm mạc và vào lớp cơ
- T3: Khối u lan qua lớp cơ vào lớp dưới thanh mạc nhưng không vào các cơ quan hoặc mô xung quanh
- T4a: Khối u lan qua bề mặt của phúc mạc tạng
- T4b: Khối u trực tiếp xâm lấn vào các cơ quan hoặc mô khác.
Hạch vùng (N):
- NX: Không đánh giá được hạch vùng
- N0: Không phát hiện được tổn thương hạch bạch huyết
- N1: Di căn 1 đến 3 hạch vùng
- N1a: Di căn 1 hạch vùng
- N1b: Di căn 2 đến 3 hạch vùng
- N1c: Khối u nằm ở mô dưới thanh mạc, màng treo ruột, quanh kết tràng hoặc quanh trực tràng không ảnh hưởng tới phúc mạc, không di căn hạch vùng
- N2: Di căn 4 hạch vùng trở lên
- N2a: Di căn 4 đến 6 hạch vùng
- N2b: Di căn 7 hạch vùng trở lên.
Di căn xa (M):
- MX: Không thể đánh giá di căn xa (không đánh giá được bằng bất kỳ phương thức nào)
- M0: Không có di căn xa
- M1: Di căn xa
- M1a: Di căn đến 1 cơ quan hoặc vị trí
- M1b: Di căn đến hơn 1 cơ quan hoặc vị trí hoặc phúc mạc.
Nhóm giai đoạn: Sau khi đã xác định loại T, N và M của bệnh nhân, thường là sau khi phẫu thuật, thông tin này sẽ được kết hợp để xác định giai đoạn khối u:
- Giai đoạn 0: Tis, N0, M0
- Giai đoạn I: T1, N0, M0; T2, N0, M0
- Giai đoạn IIA: T3, N0, M0
- Giai đoạn IIB: T4a, N0, M0
- Giai đoạn IIC: T4b, N0, M0
- Giai đoạn IIIA: T1-T2, N1/N1c, M0; T1, N2a, M0
- Giai đoạn IIIB: T3-T4a, N1/N1c, M0; T2-T3, N2a, M0; T1-T2, N2b, M0
- Giai đoạn IIIC: T4a, N2a, M0; T3-T4a, N2b, M0; T4b, N1-N2, M0
- Giai đoạn IVA: T bất kỳ, N bất kỳ, M1a
- Giai đoạn IVB: T bất kỳ, N bất kỳ, M1b.
Hệ thống phân giai đoạn Astler-Coller (MAC) chỉnh sửa (AC ban đầu được chỉnh sửa từ hệ thống Dukes)
A: Giới hạn ở niêm mạc
B1: Khối u lan vào nhưng không xuyên qua lớp cơ
B2: Khối u thâm nhiễm vào thanh mạc nhưng không ảnh hưởng đến hạch bạch huyết
B3: Khối u xâm lấn vào các cấu trúc liền kề
C1: Tương tự như B1 cộng với di căn hạch vùng
C2: Tương tự như B2 cộng với di căn hạch vùng
C3: Tương tự như B3 cộng với di căn hạch vùng
D: Di căn xa.
Phân loại của Dukes
A: Giới hạn ở thành ruột
B: Xuyên qua thành ruột
C: Di căn hạch vùng
Phòng ngừa
Ngăn ngừa sơ cấp
Không có thử nghiệm lâm sàng, đối chứng giả dược, ngẫu nhiên nào chứng minh rằng can thiệp này là biện pháp phòng ngừa cấp một của ung thư đại trực tràng ở những người có nguy cơ trung bình.
Nhóm Đặc trách về Dịch vụ Dự phòng Mỹ (USPSTF) đã đưa ra bằng chứng về sử dụng aspirin để ngăn ngừa ung thư đại trực tràng ở những người có nguy cơ. Khuyến cáo dùng aspirin liều thấp để dự phòng cấp một ung thư đại trực tràng ở người từ 50 đến 59 tuổi có nguy cơ mắc bệnh tim mạch trong 10 năm là từ 10% trở lên mà không có nguy cơ cao bị chảy máu, có tuổi thọ dự kiến ít nhất là 10 năm và sẵn sàng dùng aspirin liều thấp hàng ngày trong ít nhất 10 năm.[38] USPSTF cũng khuyến cáo nên xem xét theo từng cá nhân về việc bắt đầu dùng aspirin liều thấp ở người từ 60 đến 69 tuổi có nguy cơ mắc bệnh tim mạch trong 10 năm là từ 10% trở lên.[38] USPSTF không khuyến cáo cho các nhóm tuổi khác do thiếu bằng chứng.
Các thử nghiệm lâm sàng, đối chứng, ngẫu nhiên đã chỉ ra rằng chất ức chế cyclo-oxygenase (COX-2) làm giảm tỷ lệ tái phát u tuyến, yếu tố có tác động đến nguy cơ mắc ung thư sau đó.[39] Bổ sung canxi vào chế độ ăn (1200 mg) cũng làm giảm tỷ lệ tái phát polyp.[40] Cắt bỏ polyp tuyến qua nội soi đại tràng ngăn ngừa tử vong do ung thư đại trực tràng.[41] Sự cân bằng giữa lợi ích và nguy cơ không ủng hộ cho hóa dự phòng ở những người có nguy cơ trung bình.[42]
Khám sàng lọc
Quần thể có nguy cơ trung bình
Phương pháp tầm soát được sử dụng rộng rãi nhất là xét nghiệm máu ẩn trong phân (FOBT), dựa trên ung thư và polyp có thể chảy máu.[79] Kết quả dương tính dẫn cần chụp hình ảnh toàn bộ đại tràng, thường kèm nội soi đại tràng. Các ung thư phát hiện được nhờ tầm soát FOBT thường ở giai đoạn đầu chứ không phải giai đoạn ung thư có triệu chứng, và do đó có tiên lượng tốt hơn.[80] [81] Phân tích tổng hợp 4 thử nghiệm đối chứng, ngẫu nhiên đã cho thấy tầm soát FOBT làm giảm nguy cơ tử vong do ung thư đại trực tràng đến 25% những người thực tế đã được tầm soát. Ước tính tầm soát FOBT có thể ngăn ngừa khoảng một trong 6 ca tử vong do ung thư đại trực tràng.[82]
FOBT truyền thống đã được thực hiện bằng các phương pháp dựa trên guaiac trong đó sử dụng guaiac để phát hiện máu trong phân. Lưu ý, nhiều thực phẩm và thuốc có thể khiến FOBT dựa trên guaiac dương tính, vì vậy các bệnh nhân cần được hướng dẫn là tránh một số loại thuốc và thực phẩm nhất định trong vài ngày trước khi tiến hành FOBT dựa trên guaiac.
FOBT hóa miễn dịch (iFOBT) đã cho thấy cải thiện độ nhạy và độ đặc hiệu trong việc phát hiện ung thư đại trực tràng so với FOBT dựa trên guaiac tiêu chuẩn.[83] Những xét nghiệm này dựa trên kháng thể để phát hiện protein haemoglobin của người trong phân. Không giống như xét nghiệm dựa trên guaiac, không cần hạn chế về chế độ ăn hoặc thuốc trước khi tiến hành iFOBT, vì vậy một số bệnh nhân cảm thấy dễ sử dụng hơn. iFOBT hàng năm đã được chấp thuận như phương pháp tầm soát ung thư đại trực tràng.[84] Nội soi đại tràng sigma ống mềm đã được chứng minh là có kết quả chẩn đoán cao hơn là FOBT.[85]
Vào năm 2014, ColoGuard, một xét nghiệm tầm soát ung thư đại trực tràng dựa trên ADN, đã được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ chấp thuận. Xét nghiệm này phát hiện có tế bào hồng cầu và đột biến ADN trong phân, điều này có thể chỉ ra sự có mặt của polyp hoặc ung thư. Mặc dù là một lựa chọn đầy hứa hẹn cho tầm soát ung thư đại trực tràng, nhưng lại không phải là phương pháp tầm soát được Nhóm Đặc trách về Dịch vụ Phòng bệnh của Hoa Kỳ (USPSTF) khuyến cáo cho ung thư đại trực tràng.[86]
Các chiến lược tầm soát khác bao gồm nội soi đại tràng sigma ống mềm 5 năm một lần có hoặc không có FOBT, thụt tháo bari cản quang kép hoặc nội soi đại tràng 10 năm một lần. Tất cả các phương pháp này, bắt đầu từ 50 tuổi, làm giảm tỷ lệ tử vong do ung thư đại trực tràng so với không tầm soát và tiết kiệm chi phí khi so với chụp quang tuyến vú ở phụ nữ trên 50 tuổi. Hướng dẫn của Hoa Kỳ khuyến cáo nam giới và phụ nữ có nguy cơ trung bình cần được chỉ định một trong các chiến lược tầm soát này bắt đầu từ 50 tuổi và ưu tiên nội soi đại tràng so với các phương pháp khác.[87] [88]
USPSTF khuyến cáo tầm soát ung thư đại trực tràng bắt đầu từ 50 tuổi và tiếp tục cho đến khi 75 tuổi.[86] Quyết định tầm soát ung thư đại trực tràng ở người từ 76 đến 85 tuổi dựa theo từng cá nhân, có tính đến sức khỏe tổng thể của bệnh nhân và tiền sử tầm soát trước đó.[86]
Là một phần của chiến lược làm tăng tỷ lệ tầm soát, hướng dẫn cung cấp một loạt các lựa chọn tầm soát chứ không phải thứ tự các xét nghiệm.
- Xét nghiệm tầm soát dựa trên phân và tần suất xét nghiệm như sau:
- FOBT dựa trên guaiac, hàng năm
- Xét nghiệm hóa miễn dịch phân (FIT), hàng năm
- FIT-DNA, 1 hoặc 3 năm một lần.
- Xét nghiệm tầm soát hình ảnh trực tiếp và tần suất xét nghiệm như sau:
- Nội soi đại tràng, 10 năm một lần
- Chụp cắt lớp vi tính (CT) đại tràng, 5 năm một lần
- Nội soi đại tràng sigma ống mềm, 5 năm một lần
- Nội soi đại tràng sigma ống mềm với FIT; nội soi đại tràng sigma 10 năm một lần, với FIT hàng năm.
Nhóm Đặc trách về Chăm sóc Sức khỏe Phòng bệnh của Canada khuyến cáo không nên sử dụng nội soi đại tràng như công cụ tầm soát chính ở người trưởng thành không có triệu chứng từ 50 tuổi trở lên không có nguy cơ cao mắc ung thư đại trực tràng, trích dẫn bằng chứng không đầy đủ về ưu thế của nội soi đại tràng so với các xét nghiệm tầm soát khác, đặc biệt là FOBT.[89] Tuy nhiên, các khuyến cáo này được phân loại là ‘yếu’ do thiếu bằng chứng ở các thử nghiệm đối chứng, ngẫu nhiên.
Anh có chương trình tầm soát sử dụng FOBT dành cho những người từ 60 đến 70 tuổi.[90] FOB dương tính dẫn đến nội soi đại tràng.[85] Bằng chứng từ Anh gợi ý chỉ sử dụng nội soi đại tràng sigma ống mềm cho độ tuổi từ 55 đến 64 có thể là công cụ tầm soát thay thế hiệu quả.[91] [92]
Nguy cơ có tính chất gia đình hoặc di truyền
Khuyến cáo nội soi đại tràng tầm soát ở những bệnh nhân có từ 2 thành viên trong gia đình trực hệ trở lên mắc ung thư đại trực tràng hoặc có một thành viên trong gia đình trực hệ mắc ung thư đại tràng hoặc polyp tuyến được chẩn đoán ở tuổi dưới 60. Nội soi đại tràng nên bắt đầu vào năm 40 tuổi hoặc sớm hơn 10 năm so với độ tuổi chẩn đoán bệnh sớm nhất trong gia đình, tùy theo thời gian nào xảy ra trước và lặp lại 5 năm một lần.[87] Hướng dẫn của Anh khuyến cáo bắt đầu tầm soát ở tuổi 50 (55 tuổi đối với những người có nguy cơ thấp hơn).[93]
Nguy cơ cao
Đa polyp tuyến có tính chất gia đình (FAP):
- Các bệnh nhân FAP cần xét nghiệm di truyền cùng với tư vấn chuyên khoa để xác định đột biến gây bệnh (được xác định ở khoảng 80% bệnh nhân). Một khi đã xác định đột biến, các thành viên khác trong gia đình từ 10 tuổi trở lên nên được xét nghiệm để xác định đột biến. Người thân có xét nghiệm di truyền dương tính được chỉ định nội soi đại tràng hàng năm bắt đầu từ 10 đến 12 tuổi. Những người có xét nghiệm âm tính có thể được tầm soát như quần thể nói chung. Khi đa u tuyến được xác định trên nội soi đại tràng, cắt bỏ đại tràng được chỉ định, thường khi bệnh nhân ở độ tuổi thanh thiếu niên hoặc đầu độ tuổi 20. Những quần thể có kiểu hình yếu có thể chờ cho đến khi 20 đến 30 tuổi vì khởi phát ung thư đại trực tràng muộn hơn. Các bệnh nhân FAP có nguy cơ cao mắc các bệnh ác tính ngoài đại tràng và đã có những hướng dẫn tầm soát cho những bệnh nhân này.[94]
Hội chứng Lynch:
- Khuyến cáo xét nghiệm sự mất ổn định vị vệ tinh (MSI) và các mức thấp của biểu hiện sản phẩm protein của gen sửa chữa bắt cặp sai thường gặp (MLH1, MSH2, PMS1 và MSH6) ở mô ung thư đại trực tràng để sàng lọc bệnh nhân, dựa trên biểu hiện lâm sàng hoặc mô bệnh học, bị nghi ngờ mắc hội chứng Lynch. Tiêu chuẩn Amsterdam II đã được sử dụng trong các nghiên cứu để xác định bệnh nhân có nguy cơ cao, nhưng không đặc hiệu hoặc nhạy khi sử dụng trong lâm sàng thường quy.[87] Tiêu chuẩn Bethesda sửa đổi xác định các cá nhân mắc ung thư đại trực tràng cần được xét nghiệm phát hiện MSI. Nếu xác định được đột biến trong mô hoặc máu, cần thực hiện xét nghiệm di truyền ở người thân không có triệu chứng. Bệnh nhân được chẩn đoán hội chứng Lynch về mặt di truyền hoặc lâm sàng cần nội soi đại tràng mỗi 1 đến 2 năm một lần, bắt đầu từ khi 20 đến 25 tuổi hoặc sớm hơn 10 năm so với độ tuổi của trường hợp bệnh được phát hiện sớm nhất trong gia đình, tùy theo thời gian nào xảy ra trước.[87] Bệnh nhân mắc hội chứng Lynch cũng có nguy cơ gia tăng phát triển các bệnh ác tính khác vào đã công bố hướng dẫn tầm soát.[94] Phụ nữ dương tính với hội chứng Lynch về mặt di truyền có thể được chỉ định khám vùng chậu, siêu âm vùng chậu và sinh thiết nội mạc tử cung hàng năm từ 30 đến 35 tuổi.[95]
Đa polyp liên quan đến MYH (MAP):
- Xét nghiệm di truyền để xác định chính xác các bệnh nhân bị đột biến trong gen MYH. Chưa có khuyến cáo tầm soát MAP. Bệnh nhân MAP nên thực hiện theo các hướng dẫn tầm soát FAP, tùy theo mức độ polyp của từng người.
Bệnh viêm ruột
- Bệnh nhân bị viêm loét đại tràng hoặc Crohn cần được nội soi đại tràng theo dõi với sinh thiết có hệ thống 1 đến 2 năm một lần sau 8 năm nếu mắc viêm đại tràng toàn bộ hoặc sau 15 năm nếu mắc viêm đại tràng bên trái. Tất cả bệnh nhân cần được nội soi đại tràng theo dõi trong 8 đến 10 năm kể từ khi khởi phát bệnh để xác định mức độ bệnh.[87] Hướng dẫn của Anh khuyến cáo nội soi đại tràng 3 năm một lần sau 8 năm mắc viêm đại tràng toàn bộ và thực hiện thường xuyên hơn khi mắc bệnh đến ba mươi năm.[93]
Hướng dẫn của Hiệp hội Tiêu hóa Anh khuyến cáo tầm soát bằng nội soi đại tràng bắt đầu từ 40 tuổi và lặp lại 5 đến 10 năm một lần nếu nội soi đại tràng ban đầu không có polyp. Nếu phát hiện polyp, thì thời gian nội soi đại tràng sau đó phụ thuộc vào số lượng polyp và mô học.[96] Nếu phát hiện u tuyến trong lần tầm soát ban đầu, hoặc mức IGF-1 nằm trên mức giới hạn trên của bình thường hiệu chỉnh theo độ tuổi, bệnh nhân cần được chỉ định tầm soát 3 năm một lần.[93]
Ngăn ngừa thứ cấp
Có một số bằng chứng cho thấy thuốc kháng viêm không steroid có thể cải thiện thời gian sống ở những người có khối u KRAS loại tự nhiên.[219]
Chẩn đoán
Tiền sử ca bệnh
Tiền sử ca bệnh #1
Bệnh nhân nam 70 tuổi đến khám bác sĩ gia đình với biểu hiện đại tiện có máu. Bệnh nhân mô tả có máu lẫn trong phân kèm theo thay đổi thói quen đại tiện như đi nhiều lần hơn bình thường. Có một số cơn đau thắt vùng bụng ở bên trái và sút cân. Trước đây hoàn toàn khỏe mạnh và không có tiền sử gia đình mắc bệnh về đường tiêu hóa. Khám bụng và thăm trực tràng bằng ngón tay cho kết quả bình thường.
Các bài trình bày khác
Các triệu chứng ung thư đại trực tràng thường không đặc hiệu, vì vậy bệnh nhân thường được chẩn đoán ở giai đoạn muộn khi bệnh đã tiến triển. Các triệu chứng và dấu hiệu thường gặp nhất là đại tiện phân máu, thay đổi kéo dài thói quen đại tiện và thiếu máu. Khi khối u tiến triển hơn có thể gây chán ăn, sút cân và đau bụng. Các triệu chứng sớm là thường gặp và có thể do nhiều nguyên nhân khác nhau. Tại Anh và xứ Wales, chỉ có 10,3% bệnh nhân được chỉ định xét nghiệm khẩn cấp do nghi ngờ mắc ung thư và cuối cùng được chẩn đoán là ung thư đại trực tràng.[4] Hướng dẫn quốc gia đã chỉ ra những bệnh nhân này có các triệu chứng có nguy cơ cao mắc ung thư đại trực tràng.
Cách tiếp cận chẩn đoán từng bước
Đánh giá lâm sàng
Bệnh nhân ung thư đại trực tràng biểu hiện theo 3 cách sau:
- Bệnh nhân ngoại trú có các dấu hiệu và triệu chứng nghi ngờ
- Không có triệu chứng, được phát hiện qua tầm soát thường quy nhóm đối tượng có nguy cơ trung bình và cao
- Nhập viện cấp cứu với tắc nghẽn ruột, viêm phúc mạc, hoặc hiếm gặp là chảy máu.
Đau bụng, thay đổi thói quen đại tiện, đại tiện ra máu hoặc thiếu máu là các biểu hiện thường gặp nhất, nhưng cũng gặp ở các bệnh đường tiêu hóa khác. Ung thư đại trực tràng bên trái thường biểu hiện bằng thay đổi thói quen đại tiện do ngày càng hẹp lòng ruột, điển hình là tiêu chảy, thay đổi dạng khuôn phân (đường kính nhỏ hoặc như dải ruy băng) và cuối cùng là tắc ruột. Các triệu chứng có giá trị dự đoán ung thư đại trực tràng thấp là đau bụng khu trú, đại tiện ra máu liên quan đến triệu chứng hậu môn và thay đổi thói quen đại tiện với phân cứng hơn. 6% đến 10% bệnh nhân bị thiếu máu thiếu sắt sẽ được phát hiện ung thư đại trực tràng, phổ biến nhất là ở đại tràng bên phải.[43] [44]
Trướng bụng, sút cân và nôn thường cho thấy bệnh tiến triển. Đau bụng dưới có thể do khối u lớn xâm lấn vào mô xung quanh. Cảm giác mót rặn thường gặp trong ung thư trực tràng. Tuy nhiên, khám lâm sàng thường cho kết quả bình thường (ngoài các trường hợp cấp cứu) và luôn bao gồm khám trực tràng bằng ngón tay để có thể sờ thấy tổn thương . Khi bệnh tiến triển, có thể sờ thấy khối ở bụng hoặc gan to do di căn.
Nội soi
Chỉ định khám toàn diện đại tràng ở những bệnh nhân nghi ngờ mắc ung thư đại trực tràng và có thể thực hiện bằng nội soi đại tràng.[45] Thụt tháo bari đối quang kép cũng được sử dụng để tạo hình ảnh đại tràng, nhưng hiện được sử dụng ít hơn ở những bệnh nhân không được chỉ định chụp hình ảnh trực tiếp hoặc có chống chỉ định nội soi đại tràng kể từ khi có CT đại tràng.[46]
Nội soi đại tràng sigma ống soi mềm có thể phù hợp ở những bệnh nhân có nguy cơ thấp, như đại tiện ra máu có cầm ở bệnh nhân dưới 50 tuổi. Nếu phát hiện ung thư qua nội soi đại tràng sigma bằng ống soi mềm, điều quan trọng là cần quan sát đầy đủ toàn bộ đại tràng trước hoặc sau phẫu thuật vì các ung thư xảy ra đồng thời ở khoảng 5% bệnh nhân.[47]
Nội soi đại tràng là thăm dò bước đầu, trừ khi có bằng chứng lâm sàng cho đe dọa tắc ruột cần chống chỉ định dùng thuốc xổ chuẩn bị nội soi. Nội soi đại tràng là xét nghiệm chẩn đoán nhạy nhất đối với ung thư đại trực tràng và có lợi thế hơn các phương pháp chụp x-quang khi cần tránh bức xạ và cho phép sinh thiết tổn thương nghi ngờ cũng như loại bỏ các polyp một cách ngẫu nhiên.
Tuy nhiên, nội soi đại tràng có thể xảy ra sai sót và tỷ lệ sót ung thư từ 2% đến 6%.[48]Nhược điểm của thủ thuật là phụ thuộc nhiều vào trình độ của bác sĩ, thường cần dùng thuốc an thần đường tĩnh mạch, có thể không quan sát đầy đủ hình ảnh lên đến 30% các trường hợp và định vị khối u có thể không chính xác. Có nguy cơ nhỏ gây biến chứng như thủng ruột, thậm chí ở các trường hợp nội soi chẩn đoán không thực hiện thủ thuật cắt bỏ polyp.[49] Dùng mực đánh dấu vị trí của ung thư giúp tăng khả năng định vị trong khi phẫu thuật và tránh báo cáo các vị trí không chính xác.[50]
Chẩn đoán hình ảnh
Chụp CT đại tràng có độ nhạy tương tự với nội soi đại tràng quang học trong việc phát hiện ung thư đại tràng.[45] Cả hai phương pháp đều được sử dụng trong thăm dò ban đầu các triệu chứng nghi ngờ và/hoặc để hoàn tất đánh giá đại tràng khi nội soi đại tràng chưa hoàn thành vì lý do kỹ thuật. Được xem xét là xét nghiệm nhạy hơn so với thụt tháo bari.[46]
Thụt tháo bari đối quang kép là biện pháp thay thế an toàn của nội soi đại tràng và không cần thuốc an thần. Có thể cần kết hợp với nội soi đại tràng sigma ống mềm nếu đại tràng sigma không hiện đầy đủ, ví dụ trong bệnh túi thừa nặng. Điều này chỉ ra sự nghi ngờ về độ nhạy và độ đặc hiệu của thụt tháo bari và vì vậy CT đại tràng được sử dụng thường xuyên hơn.[46]
Mô học là biện pháp lý tưởng xác định ung thư đại tràng. Xác định mô học là hết sức cần thiết trong ung thư trực tràng.
Có thể khó thực hiện kỹ thuật hình ảnh đại tràng thường quy ở bệnh nhân cao tuổi hoặc yếu do tình trạng bất động và kém dung nạp thuốc chuẩn bị ruột. Các nghiên cứu tiến cứu với quả lâm sàng trong 12 đến 30 tháng đã chỉ ra rằng ở các bệnh nhân có triệu chứng, chụp CT bụng thông thường có uống chất cản quang (nhưng không dùng thuốc chuẩn bị ruột trước đó) có độ nhạy phát hiện ung thư đại tràng là 88% đến 94%.[51] [52]
Kết quả thử nghiệm không rõ ràng có thể cần thăm dò thêm. Một khi đã chẩn đoán ung thư đại trực tràng, cần tiến hành chụp hình ảnh để xác định giai đoạn bệnh. Chụp hình ảnh gan và lồng ngực, thường bằng CT, để phát hiện di căn. Siêu âm nội soi trực tràng hoặc MRI (chụp cộng hưởng từ) vùng chậu để xác định giai đoạn tại chỗ (T và N) của ung thư trực tràng và giúp lựa chọn biện pháp điều trị. MRI có độ chính xác cao ở cả bờ cắt (CRM) và phân loại T.[53]
PET (chụp cắt lớp phát xạ positron) ngày càng được sử dụng trong ung thư đại trực tràng. Các chỉ định bao gồm phát hiện di căn ngoài gan ở những bệnh nhân được cho là có bệnh di căn chỉ ở gan, để cân nhắc phẫu thuật cắt bỏ di căn.[54] [55] [56] Tuy nhiên, một thử nghiệm đã phát hiện sử dụng PET-CT so với chỉ dùng CT ở những bệnh nhân có di căn gan có thể cắt bỏ không dẫn đến sự thay đổi trong điều trị phẫu thuật và dẫn đến nghi ngờ việc dùng PET trong trường hợp này.[57] PET cũng được sử dụng để giúp xác định bệnh tái phát ở những bệnh nhân có các triệu chứng hoặc tăng kháng nguyên carcinoembryonic (CEA) nghi ngờ do tái phát những phương pháp chẩn đoán hình ảnh thông thường lại cho kết quả âm tính.[58] [59]
Các chỉ định trong tương lai của PET có thể bao gồm tiên lượng đáp ứng sớm trong quá trình hóa trị liệu.
Xét nghiệm
CEA là chất chỉ điểm khối u kinh điển của ung thư đại trực tràng. Nồng độ CEA huyết thanh tăng ở khoảng 80% bệnh nhân ung thư đại trực tràng, tùy thuộc vào giai đoạn bệnh. Tuy nhiên, xét nghiệm này không đủ độ nhạy hoặc độ đặc hiệu để sử dụng như công cụ chẩn đoán ở bệnh nhân có triệu chứng hoặc như là công cụ tầm soát ở quần thể không có triệu chứng.[60] Tiện ích lâm sàng chính là theo dõi điều trị và khả năng tái phát ở bệnh nhân ung thư đại trực tràng. Được dùng để đánh giá đáp ứng lâm sàng với hóa trị liệu và phát hiện tái phát ung thư đại trực tràng ở những bệnh nhân đã phẫu thuật cắt bỏ. Xét nghiệm FBC (công thức máu), chức năng gan, đánh giá xương và chức năng thận thường quy là các xét nghiệm cơ bản nhằm hỗ trợ điều trị. Mặc dù xét nghiệm máu ẩn trong phân là phương thức có hiệu quả để tầm soát trong quần thể, nhưng lại không đủ độ nhạy để sử dụng cho bệnh nhân có triệu chứng.
Các yếu tố nguy cơ
Thường gặp
Tuổi ngày càng tăng
- Trong số các yếu tố nguy cơ đã biết, gia tăng tuổi là yếu tố nguy cơ lớn nhất đối với ung thư đại trực tràng đơn phát. Khoảng 99% trường hợp xảy ra ở những người trên 40 tuổi và 85% là ở những người trên 60 tuổi.[5]
Đột biến APC
- Gen đa polyp dạng tuyến (APC) bình thường được cho là gián tiếp điều hòa phiên mã của một số gen tăng sinh tế bào quan trọng thông qua tương tác với yếu tố phiên mã beta-catenin. Bệnh đa polyp tuyến có tính gia đình (FAP) và biến thể của bệnh là FAP thể nhẹ (AFAP), là các bệnh gen trội nhiễm sắc thể thường do đột biến mầm ở gen APC trên nhiễm sắc thể 5q. Những bệnh nhân này theo thời gian sẽ phát triển hàng trăm đến hàng ngàn polyp dạng tuyến ở tuổi 20 đến 30 tuổi và chắc chắn sẽ phát triển ung thư đại trực tràng trừ khi phẫu thuật cắt bỏ dự phòng. Thể nhẹ có liên quan đến ít polyp hơn và bệnh nhân bị ung thư ở tuổi muộn hơn.[23] Những bệnh nhân bị ảnh hưởng cũng có nguy cơ mắc một số bệnh ác tính ngoài đại tràng (như dạ dày tá tràng, tuyến giáp, hệ thần kinh trung ương và u nguyên bào gan thời niên thiếu).
Hội chứng Lynch (HNPCC)
- Hội chứng Lynch cũng được biết đến là ung thư đại trực tràng không đa polyp di truyền (HNPCC). Đây là hội chứng gen trội nhiễm sắc thể thường và chiếm khoảng 6% tổng số ca ung thư đại trực tràng.[24] Đặc trưng bởi tăng nguy cơ phát triển ung thư đại trực tràng ở độ tuổi còn trẻ (nghĩa là 44 tuổi) và nguy cơ cao mắc các bệnh ác tính ngoài đại tràng, đặc biệt là ung thư nội mạc tử cung.[24] Bệnh do đột biến dòng mầm ở một trong 6 gen sửa chữa bắt cặp sai ADN. Những gen này chỉnh sửa việc bắt cặp sai base nucleotide và thêm hoặc xóa lượng nhỏ diễn ra trong quá trình sao chép ADN. Khiếm khuyết trong sửa chữa bắt cặp sai thúc đẩy phát triển các u tuyến và tăng tốc tiến trình phát triển từ u tuyến thành ung thư biểu mô.[25] Mất ổn định vị vệ tinh (thay đổi độ dài của chuỗi gen lặp lại đơn giản) là dấu hiệu mô học hội chứng Lynch.

Đa polyp liên quan đến MYH
- Đa polyp liên quan đến MYH (MAP) là dạng đa polyp gen lặn do đột biến cả hai alen của gen MUTYH. Sản phẩm protein của MUTYH là glycosylase tham gia vào việc sửa chữa ADN bị hỏng. Những bệnh nhân bị ảnh hưởng thường phát triển 10 đến 100 polyp ở độ tuổi 40 và có nguy cơ cao mắc ung thư đại trực tràng. Khoảng một phần ba bệnh nhân có 15 đến 100 polyp được phát hiện có đột biến gen MYH. Ngoài ra, MAP cũng chiếm tỷ lệ nhỏ bệnh nhân có hàng ngàn polyp mà không có FAP.
Hội chứng đa polyp u mô thừa
- Hội chứng đa polyp u mô thừa đặc trưng ở sự phát triển quá mức các tế bào nằm ngay tại khu vực mà chúng cư trú. Các thay đổi về di truyền là nguyên nhân gây các hội chứng di truyền hiếm gặp, đa polyp tuổi vị thành niên và hội chứng Peutz-Jeghers. Hội chứng Peutz-Jeghers là rối loạn trội nhiễm sắc thể thường đặc trưng bởi các vảy tế bào melanin môi và niêm mạc má, polyp u mô thừa ở đường tiêu hóa và tăng nguy cơ mắc ung thư ở đường tiêu hóa và ung thư ngoài đường tiêu hóa.[26] Nguy cơ mắc ung thư đại trực tràng suốt đời ở những bệnh nhân này được ước tính là 39% và được cho là do thay đổi dạng tuyến nằm trong u mô thừa.[26]
Bệnh ruột viêm
- Các bệnh nhân viêm loét đại tràng và viêm đại tràng Crohn có nguy cơ cao mắc ung thư đại tràng; nguy cơ này liên quan đến mức độ và thời gian mắc bệnh.[27] [28] Sau 10 năm mắc viêm loét đại tràng lan rộng, nguy cơ mắc ung thư từ 0,5% đến 1% mỗi năm. Nguy cơ ung thư đại trực tràng cũng tăng tương tự ở những bệnh nhân viêm đại tràng Crohn lan rộng.[29] Những bệnh nhân bị viêm đại tràng bên trái, nhưng không bị viêm ruột thẳng hoặc viêm trực tràng sigma, có tăng nguy cơ nhưng không cùng mức độ với bệnh nhân bị các bệnh lan rộng.[30] [31]
Béo phì
- Béo phì luôn liên quan đến bệnh ung thư đại trực tràng và rõ rệt hơn ở nam giới so với nữ giới.((Martinez ME, Giovannucci E, Spiegelman D, et al. Leisure-time physical activity, body size, and colon cancer in women. Nurses’ Health Study Research Group. J Natl Cancer Inst. 1997;89:948-955. Toàn văn Tóm lược)) ((Calle EE, Rodriguez C, Walker-Thurmond K, et al. Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults. N Engl J Med. 2003 Apr 24;348(17):1625-38. Toàn văn Tóm lược)) [32] [33] Nguy cơ tăng khoảng 60% ở nam giới và 30% ở nữ giới với chỉ số khối cơ thể (BMI) >28,5 khi so với BMI <22.[34] Chưa rõ cơ chế gây tăng nguy cơ ung thư nhưng có thể liên quan đến tăng bài tiết và sinh khả dụng của các yếu tố tăng trưởng, insulin và yếu tố tăng trưởng giống insulin. Hoạt động thể lực mức độ cao ở những bệnh nhân béo phì dường như có thể chống lại tăng nguy cơ mắc ung thư đại trực tràng.
Không thường gặp
Bệnh to đầu chi
- Bệnh nhân mắc bệnh to đầu chi tăng nguy cơ mắc ung thư đại trực tràng, mặc dù vẫn còn đang gây tranh cãi. Qua các nghiên cứu dựa trên quần thể, ước tính những người mắc bệnh to đầu chi có nguy cơ mắc ung thư đại trực tràng cao gấp hai lần.[35]
Ít hoạt động thể lực
- Có mối tương quan nghịch giữa hoạt động thể lực và ung thư đại tràng (nhưng không phải với ung thư trực tràng) tức là nguy cơ mắc bệnh giảm 50% ở những người có hoạt động thể lực mức cao nhất.[36] [16]
Thiếu chất xơ trong chế độ ăn
- Chất xơ trong chế độ ăn có tác dụng bảo vệ yếu chống lại ung thư đại trực tràng. Nhiều nghiên cứu đã được tiến hành, nhưng kết quả vẫn còn mâu thuẫn trong nhiều trường hợp. Một nghiên cứu đã gợi ý tăng gấp đôi lượng chất xơ làm giảm nguy cơ ung thư đại trực tràng đến 40% so với nhóm ăn ít chất xơ.[37]
Các yếu tố về tiền sử và thăm khám
Các yếu tố chẩn đoán chủ yếu
Có các yếu tố nguy cơ (thường gặp)
- Các yếu tố nguy cơ chính bao gồm đột biến APC, hội chứng Lynch (ung thư đại trực tràng không đa polyp di truyền, HNPCC), bệnh đa polyp liên quan đến MYH, hội chứng đa polyp u mô thừa, bệnh ruột viêm và béo phì.
Tuổi ngày càng tăng (thường gặp)
- Tỷ lệ mắc ung mới thư đại trực tràng tăng theo độ tuổi. Dưới 5% những trường hợp mắc bệnh trẻ hơn 44 tuổi và độ tuổi trung bình khi chẩn đoán là 71.[5]
Xuất huyết trực tràng (thường gặp)
- Đại tiện ra máu thường do bệnh lành tính, nhưng là triệu chứng thường gặp ở bệnh nhân mắc ung thư đại trực tràng. Một nghiên cứu tiến cứu 10 năm về chăm sóc sức khỏe ban đầu cho thấy đại tiện ra máu gần đây ở bệnh nhân trên 45 tuổi có giá trị dự đoán dương tính ung thư đại trực tràng là 5,7%.[62]
Thay đổi thói quen đại tiện (thường gặp)
- Đại tiện nhiều lần hoặc phân lỏng hơn, đặc biệt kềm đại tiện ra thường gặp hơn ở ung thư bên trái. Tuy nhiên, thay đổi thói quen đại tiện theo hướng giảm số lần và phân rắn có giá trị dự đoán thấp đối với ung thư đại trực tràng.
Khối ở trực tràng (thường gặp)
- Có khối trực tràng có thể sờ thấy ở 40% đến 80% bệnh nhân mắc ung thư trực tràng.[63] [64] Khám trực tràng bằng ngón tay để đánh giá tổn thương khối u trên thành vùng chậu và khả năng phẫu thuật là không đáng tin cậy và tốt hơn là đánh giá bằng MRI và siêu âm nội soi qua trực tràng.
Tiền sử gia đình dương tính (không thường gặp)
- Đối với các cá nhân có một người họ hàng thế hệ thứ nhất trong gia mắc bệnh thì nguy cơ tương đối mắc ung thư đại trực tràng là 2,24. Nguy cơ này tăng đến 3,97 nếu có 2 người họ hàng thế hệ thứ nhất mắc bệnh.[61] Tuy nhiên, chỉ khoảng 10% đến 20% bệnh nhân có tiền sử gia đình mắc ung thư đại trực tràng.
Khối ở bụng (không thường gặp)
- Khám bụng thường cho kết quả bình thường. Đôi sờ thấy khối u, nhất là khi bệnh tiến triển.
Các yếu tố chẩn đoán khác
Chứng thiếu máu (thường gặp)
- Gần 90% bệnh nhân ung thư đại tràng bên phải có thiếu máu lúc chẩn đoán.[65]
Giới tính nam (không thường gặp)
- Đến 50 tuổi, tỷ lệ mắc bệnh ung thư ruột ở nam giới và nữ giới là tương đương nhau, nhưng sau đó, tỷ lệ ở nam giới sẽ cao hơn.
Đau bụng (không thường gặp)
- Bệnh nhân bị đau bụng mà không có bất kỳ triệu chứng đường tiêu hóa nào khác không có Khả năng mắc ung thư đại trực tràng.
Sút cân và chán ăn (không thường gặp)
- Liên quan đến bệnh tiến triển.
Chướng bụng (không thường gặp)
- Là biểu hiện của bệnh tiến triển do cổ trướng hoặc tắc ruột.
Hạch bạch huyết có thể sờ thấy (không thường gặp)
- Là biểu hiện của bệnh tiến triển.
Xét nghiệm chẩn đoán
Xét nghiệm thứ nhất cần yêu cầu
| Xét nghiệm | Kết quả |
| Công thức máu
• Xét nghiệm cơ bản trong đánh giá bệnh nhân và để đánh giá điều trị trong tương lai. • Từ 6% đến 10% bệnh nhân bị thiếu máu thiếu sắt được phát hiện là mắc ung thư đại trực tràng. Gần 90% bệnh nhân bị ung thư đại trực tràng bên phải bị thiếu máu. |
Chứng thiếu máu |
| Sinh hóa gan
• Xét nghiệm cơ bản trong đánh giá bệnh nhân và để đánh giá điều trị trong tương lai. |
Bình thường, thường ngảy cả khi có di căn gan |
| Chức năng thận
• Xét nghiệm cơ bản trong đánh giá bệnh nhân và để đánh giá điều trị trong tương lai. |
Bình thường, ngoại trừ nếu các bệnh lý vùng chậu tiến triển đang chèn ép niệu quản |
| Nội soi đại tràng
• Nội soi đại tràng cần chuẩn bị ruột bằng thuốc nhuận tràng qua đường uống để đảm bảo nhìn rõ toàn bộ niêm mạc. • Cần sinh thiết để xác nhận mô bệnh học. • Tiêm dung dịch dưới niêm mạc (nước muối, dịch keo có hoặc không có adrenaline, hoặc thậm chí thuốc nhuộm) để tách niêm mạc chỉ được sử dụng để hỗ trợ trong phẫu thuật nội soi cắt bỏ hoàn toàn hoặc thủ thuật cắt bỏ polyp; bản thân thủ thuật không phải là xét nghiệm chẩn đoán thường quy. Không tách polyp bằng cách tiêm dưới niêm mạc có thể cho thấy xâm lấn nhiều hơn và có thể là dấu hiệu của bệnh ác tính tiềm ẩn. • Nội soi đại tràng phụ thuộc nhiều vào trình độ của bác sĩ nội soi. Tỷ lệ soi hoàn toàn (tức là soi được qua manh tràng) khá khác nhau và tỷ lệ 90% là chấp nhận được mặc dù nhiều người đạt tỷg lệ 98%. Nội soi đại tràng không hoàn toàn và chuẩn bị ruột kém là 2 trong nhiều yếu tố khiến tỷ lệ phát hiện sót ung thư đại trực tràng từ 2% đến 6% khi nội soi đại tràng.[48] Các nguy cơ khác của thủ thuật liên quan đến thuốc an thần và thủng đại tràng (lên tới 0,12%).[66] [67] Trong các nghiên cứu so sánh tiến cứu, nội soi đại tràng thông thường được chấp nhận ở các bệnh nhân như biện pháp chụp đại tràng ảo và cả hai biện pháp này đều thích hợp hơn thụt tháo bari cản quang kép.[68] [69] |
Tổn thương niêm mạc có loét hoặc lồi có thể gây hẹp lòng ruột |
| Thụt tháo bari cản quảng kép
• Thụt tháo bari cản quang kép là phương pháp an toàn và dung nạp tốt, không cần thuốc an thần qua đường tĩnh mạch. Cần phải chuẩn bị ruột cẩn thận trước khi thực hiện và tỷ lệ soi toàn bộ cao. Tuy nhiên, trong các nghiên cứu so sánh tiến cứu, các bệnh nhân thích chụp CT đại tràng hoặc chụp đại tràng thông thường hơn thụt tháo bari để quan sát đại tràng. • Các bất lợi bao gồm cần dùng thuốc an thần và giảm độ chính xác khi có bệnh túi thừa sigma. Các biến chứng hiếm gặp và bao gồm thủng đại tràng (<0,001%) và rối loạn nhịp tim với tỷ lệ tử vong là 1 trên 70.000 ca bệnh. |
Tổn thương lớn trong đại tràng và/hoặc như tổn thương có đặc điểm ‘lõi táo’ |
| Chụp CT đại tràng
• Chụp CT đại tràng (nội soi đại tràng ảo) cho phép quan sát trong lòng đại tràng tương tự như nội soi đại tràng truyền thống. Phương pháp này có độ nhạy tương đương nội soi đại tràng thông thường trong phát hiện ung thư đại trực tràng và không cần thuốc an thần, nhưng độ đặc hiệu thấp hơn. • Những cải thiện về mặt kỹ thuật của phương pháp này (chất cản quang đường tĩnh mạch và chất đánh dấu đường uống thải trừ qua phân) trong tương lai có thể giúp phân biệt phân và tổn thương khối, như polyp và ung thư và do đó loại bỏ nhu cầu chuẩn bị ruột trước đó. Tuy nhiên, hiện tại, để đánh giá được đầy đủ hình ảnh đại tràng trên CT vẫn cần phải chuẩn bị ruột kỹ lưỡng như trong nội soi đại tràng • Được xem xét là thử nghiệm nhạy hơn so với thụt tháo bari. |
Bề ngoài tương tự như nội soi đại tràng thông thường, với tổn thương niêm mạc dạng chồi sùi gây loét có thể làm hẹp lòng ruột |
| Chụp CT ngực, vùng bụng và vùng chậu
• Tất cả bệnh nhân ung thư trực tràng phải được xác định giai đoạn trước khi phẫu thuật bằng chụp CT ngực, vùng bụng và vùng chậu để xác định mức độ lan rộng tại chỗ hoặc lan xa, đồng thời để hướng dẫn điều trị cũng như tiên lượng. Những người ung thư đại tràng được xác định giai đoạn đầy đủ bằng chụp CT vùng bụng và vùng chậu bằng CXR (X-quang ngực thẳng) để đánh giá lồng ngực. Chất cản quang đường uống và đường tĩnh mạch ở cả hai trường hợp đều cần thiết để có độ nhạy và độ đặc hiệu tốt nhất. • Bệnh nhân nhập viện cấp cứu do tắc đại tràng cũng cần chụp CT nếu có thể vì điều này giúp hỗ trợ điều trị. Ví dụ, đặt cầu nối đại tràng có thể phù hợp hơn khi có nhiều di căn gan, khi mà cắt bỏ khối u nguyên phát không làm thay đổi tiên lượng. • Vai trò chính của chụp CT là để phát hiện di căn xa; đây là phương pháp không chính xác để đánh giá bệnh lý hạch ác tính hoặc độ sâu của sự xâm lấn khối u trong thành ruột.[73] Bệnh nhân di căn gan có thể được lựa chọn để cắt bỏ dựa trên thùy gan bị ảnh hưởng, phần trăm gan bị tổn thương và không tổn thương động mạch hoặc tĩnh mạch chính. |
Thành đại tràng dày lên, hạch bạch huyết to, di căn gan, cổ trướng, bệnh phổi thứ phát |
Các xét nghiệm khác cần cân nhắc
| Xét nghiệm | Kết quả |
| MRI vùng chậu
• Cần phải xác định chính xác giai đoạn của ung thư trực tràng để lựa chọn bệnh nhân có thể thực hiện phẫu thuật bảo tồn cơ thắt và xác định biện pháp điều trị bổ trợ phù hợp. MRI vùng chậu độ phân giải cao được sử dụng trước khi phẫu thuật ở những bệnh nhân ung thư trực tràng để xác định độ sâu của xâm lấn khối u và tổn thương do khối u vào mạc treo trực tràng có thể quan sát được (bờ của diện cắt ). MRI cũng đánh giá tổn thương hạch quanh trực tràng. MRI có độ chính xác cao ở cả oờ diện cắt (CRM) và loại T. |
Sự xâm lấn của khối u vào mạc treo trực tràng |
| Nội soi siêu âm quả trực tràng (TRUS)
• TRUS ưu thể hơn CT trong việc xác định giai đoạn T lâm sàng của ung thư trực tràng. Cũng ưu thế hơn MRI trong phân biệt khối u T0, T1 và T2 nhưng MRI hữu ích hơn khi phân biệt T3 với T4 và đánh giá hạch mạc treo trực tràng. Cải thiện độ chính xác của việc xác định giai đoạn T có thể xác định bệnh nhân phù hợp với thủ thuật cắt bỏ cục bộ (xuyên hậu môn) (khối u T1). Điều này cũng sẽ xác định chỉ định liệu pháp bổ trợ ở những người có thể đã bị bỏ qua khi dùng các phương thức ghi hình khác. |
Hạch bạch huyết quanh trực tràng to gợi ý tổn thương ác tính; xâm lấn quả lớp dưới niêm mạc và đến lớp cơ xác định khối u T2 và sự xâm lấn khối u vào vùng quanh trực tràng xác định khối u T3 |
| Sinh thiết
• Đại đa số (98%) ung thư đại trực tràng xuất phát từ các tế bào biểu mô đại tràng và là ung thư biểu mô tuyến. |
Xác nhận chẩn đoán bằng hình ảnh mô học đặc trưng cũng như mức độ biệt hóa khối u (tức là biệt hóa tốt, trung bình hoặc kém) |
| Kháng nguyên carcinoembryonic (CEA)
• Nồng độ CEA chỉ được đo sau khi xác nhận chẩn đoán ung thư đại trực tràng. CEA tăng chỉ ở 40% đến 80% bệnh nhân ung thư đại trực tràng ở thời điểm chẩn đoán và không đủ độ nhạy để sử dụng như công cụ chẩn đoán. Chỉ số này cũng không đặc hiệu cho ung thư đại trực tràng và nhiều tình trạng lành tính có thể gây tăng CEA . • Sử dụng lâm sàng chính của CEA là xác định khả năng tái phát ung thư đại trực tràng sau khi điều trị phẫu thuật (kết hợp với hình ảnh và nội soi) và trong đánh giá đáp ứng với hóa trị liệu. |
Tăng; giới hạn bình thường củả CEA ở người lớn không hút thuốc là <2,5 microgram/ L (<2,5 nanogram/mL) và đối với người hút thuốc là <5,0 microgram/L (<5,0 nanogram/ mL); phạm vi thảm chiếu khác nhảu giữa các phòng xét nghiệm và tùy thuộc vào phương pháp xét nghiệm |
| Chụp PET
• PET (chụp cắt lớp phát xạ positron) ngày càng được sử dụng trong ung thư đại trực tràng. Các chỉ định bao gồm phát hiện di căn ngoài gan ở những bệnh nhân được cho là có bệnh di căn chỉ ở gan, để cân nhắc phẫu thuật cắt bỏ di căn. Các chỉ định trong tương lai có thể bao gồm tiên lượng đáp ứng sớm trong quá trình hóa trị liệu. Phương pháp này cũng được sử dụng để xác định sự tái phát của bệnh ở những bệnh nhân có các triệu chứng hoặc tăng kháng nguyên carcinoembryonic (CEA) nghi ngờ tái phát nhưng chụp ảnh thông thường lại cho kết quả âm tính. Hiện nay, xét nghiệm này không được sử dụng để xác định giai đoạn ban đầu của ung thư đại trực tràng. |
Ổ tăng hấp thụ 18-fluoro-2- deoxyglucose (FDG) phát hiện các thay đổi chuyển hóa của bệnh ác tính |
Chẩn đoán khác biệt
| Tình trạng | Các dấu hiệu/triệu chứng khác biệt | Các xét nghiệm khác biệt |
| Hội chứng ruột kích thích (IBS) | • Chẩn đoán lâm sàng dựa trên Tiêu chuẩn Rome III với đau bụng hoặc khó chịu tái phát ít nhất 3 tháng, khởi phát ít nhất 6 tháng trước đó, liên quan đến 2 hoặc nhiều tiêu chuẩn sau: cải thiện đau bụng sau khi đại tiện, thay đổi số lần đại tiện, và thay đổi hình dạng khuôn phân. | • Không có xét nghiệm chẩn đoán đặc hiệu cho IBS.
• Bệnh nhân đáp ứng các tiêu chuẩn lâm sàng của IBS (hội chứng ruột kích thích) và không có dấu hiệu cảnh báo có xác suất mắc bệnh thực thể rất thấp. Khuyến cáo nên nội soi đại tràng hoặc chụp hình ảnh đại tràng ở những bệnh nhân trên 50 tuổi do khả năng mắc ung thư đại trực tràng trước xét nghiệm cao hơn. |
| Viêm loét đại tràng | • Độ tuổi trung bình khởi phát bệnh ruột viêm (20 đến 40 tuổi) trẻ hơn độ tuổi trung bình khởi phát ung thư đại trực tràng. Bệnh nhân mắc bệnh viêm ruột thường bị tiêu chảy phân nước. Tuy nhiên, bệnh nhân bị viêm đại tràng có nguy cơ mắc ung thư đại trực tràng cao hơn và cần nội soi đại tràng có sinh thiết 2 năm một lần, và sau đó là hàng năm bắt đầu 8 năm sau khi chẩn đoán phát hiện loạn sản tiền ung thư. | • Nội soi đại tràng sẽ phát hiện tổn thương trực tràng, tổn thương đồng nhất liên tục, mất dấu mạch masu, ban đỏ lan tỏa, hạt màng nhầy, hồi tràng đoạn cuối bình thường (hoặc viêm hồi tràng nhẹ trong viêm đại tràng toàn bộ). |
| Bệnh Crohn | • Độ tuổi trung bình khởi phát bệnh ruột viêm (20 đến 40 tuổi) trẻ hơn độ tuổi trung bình khởi phát ung thư đại trực tràng. Bệnh nhân mắc bệnh viêm ruột thường bị tiêu chảy ra nước. Bệnh nhân bị viêm đại tràng có nguy cơ mắc ung thư đại trực tràng cao hơn và cần đánh giá thường xuyên bằng nội soi đại tràng có sinh thiết tùy thuộc theo dạng bệnh. | • Nội soi đại tràng có đặt ống hồi tràng là xét nghiệm xác định để chẩn đoán bệnh Crohn và sẽ cho thấy viêm niêm mạc và loét sâu bề mặt rải rác theo chiều ngang và chiều dọc, tạo thành hình dạng đá cuội. Tổn thương gián đoạn với các đoạn ruột bình thường (tổn thương rải rác). |
| Bệnh trĩ | • Gây ra đại tiện ra máu tươi không lẫn trong phân. Không có khó chịu hoặc đau bụng, thay đổi thói quen đại tiện hoặc sút cân. | • Khuyến cáo nên nội soi đại tràng hoặc chụp hình ảnh đại tràng ở những bệnh nhân có các triệu chứng ở bụng ngoài đại tiện ra máu và ở những bệnh nhân trên 50 tuổi. Ngoài ra, cũng khuyến cáo cho những bệnh nhân mà đánh giá ruột thẳng lâm sàng không phát hiện được nguồn gốc chảy máu hậu môn. |
| Nứt kẽ hậu môn | • Đau nghiêm trọng khi đại tiện. Thường có máu khi lau sau khi đi vệ sinh. Không có khó chịu hoặc đau bụng, thay đổi thói quen đại tiện hoặc sút cân. | • Nên nội soi đại tràng hoặc chụp hình ảnh đại tràng ở những bệnh nhân có các triệu chứng ở bụng cùng với đại tiện ra máu và ở những bệnh nhân trên 50 tuổi. |
| Bệnh túi thừa | • Có thể không phân biệt được chít hẹp túi thừa hoặc khối viêm với ung thư đại trực tràng về mặt lâm sàng. | • CT thường sẽ phân biệt được. Chỉ định nội soi đại tràng để đánh giá hẹp, nhưng có thể bị chống chỉ định ở các bệnh nhân mắc tình trạng viêm cấp tính. |
Điều trị
Cách tiếp cận điều trị từng bước
Phẫu thuật cắt bỏ cho ung thư đại trực tràng khu trú là biện pháp điều trị chữa khỏi chính. Nên tránh phẫu thuật khi nguy cơ được cho là cao hơn lợi ích , như khi bệnh nhân không phù hợp để trải qua đại phẫu thuật hoặc bệnh đã tiến triển (giai đoạn IV), lúc này cắt bỏ có thể không thay đổi tỷ lệ sống sót hoặc chất lượng cuộc sống.
Trước khi phẫu thuật, những bệnh nhân cần tạo lỗ mở cần được điều dưỡng chuyên khoa đánh giá để đảm bảo đủ thời gian chuẩn bị và phù hợp với thiết bị. Ngoài mục đích cắt bỏ giảm nhẹ bệnh (ví dụ: vì tắc nghẽn), mục đích của phẫu thuật là cắt bỏ để chữa bệnh dựa trên bờ cắt sạch cả về mặt đại thể và mô học.
Phẫu thuật nội soi đang ngày càng được sử dụng rộng rãi trong ung thư đại tràng và nhanh chóng trở thành tiêu chuẩn vàng cho cắt bỏ ung thư đại tràng. Lợi ích của cắt bỏ bằng nội soi bởi bác sĩ phẫu thuật được đào tạo phù hợp bao gồm giảm đau sau phẫu thuật, rút ngắn thời gian nằm viện và rút ngắn giai đoạn phục hồi so với phẫu thuật mở thông thường. Thời gian tái phát khối u và tỷ lệ sống sót tương tự nhau ở cả hai loại phẫu thuật.((Clinical Outcomes of Surgical Therapy Study Group. A comparison of laparoscopically assisted and open colectomy for colon cancer. N Engl J Med. 2004;350:2050-2059. Toàn văn Tóm lược)) ((Colon Cancer Laparoscopic or Open Resection Study Group, Buunen M, Veldkamp R, Hop WC, et al. Survival after laparoscopic surgery versus open surgery for colon cancer: long-term outcome of a randomised clinical trial. Lancet Oncol. 2009;10:44-52. Tóm lược)) ((Green BL, Marshall HC, Collinson F, et al. Long-term follow-up of the Medical Research Council CLASICC trial of conventional versus laparoscopically assisted resection in colorectal cancer. Br J Surg. 2013;100:75-82. Toàn văn Tóm lược)) ((Kennedy RH, Francis EA, Wharton R, et al. Multicenter randomized controlled trial of conventional versus laparoscopic surgery for colorectal cancer within an enhanced recovery programme: EnROL. J Clin Oncol. 2014;32:1804-1811. Toàn văn Tóm lược))
Phẫu thuật hồi sức nhanh ngày càng được sử dụng rộng rãi, kết hợp với các nguyên tắc của chương trình Phục hồi tích cực sau phẫu thuật (ERAS). Phương pháp này đã được chứng minh là giảm biến chứng chung cuộc và thời gian nằm viện sau khi phẫu thuật đại trực tràng.[101] [102] Ngoài ra, có thêm bằng chứng rằng các đơn vị phẫu thuật thực hiện nhiều ca phẫu thuật hơn đạt kết quả tốt hơn.[103]
Điều trị ung thư trực tràng (được phân loại là bất kỳ ung thư nào có bờ xa từ 15 cm trở xuống tính từ mép hậu môn bằng cách sử dụng ống nội soi đại tràng sigma cứng) khác với ung thư đại tràng. Điều trị phẫu thuật ung thư trực tràng khác nhau tùy theo giai đoạn bệnh và vị trí của ung thư. Cắt bỏ toàn bộ mạc treo trực tràng là thủ thuật phẫu thuật tiêu chuẩn quốc tế trong ung thư trực tràng đoạn thấp. Cắt bỏ mạc treo trực tràng có bóc tách hạch bên là thủ thuật chuẩn tại Nhật Bản. Dữ liệu đã công bố gợi ý rằng biện pháp tiếp cận này có tỉ lệ mắc bệnh trong thời gian ngắn sau phẫu thuật, nhưng thử nghiệm đã không có dữ liệu kết quả.[104]
Cắt bỏ trực tràng qua nội soi có lợi ích tương tự như cắt bỏ đại tràng qua nội soi, và đã được chứng minh là không nhược điểm đối với kết quả về mặt ung thư,((Anderson C, Uman G, Pigazzi A. Oncologic outcomes of laparoscopic surgery for rectal cancer: a systematic review and meta-analysis of the literature. Eur J Surg Oncol. 2008;34:1135-1142. Tóm lược)) ((Ng SS, Lee JF, Yiu RY, et al. Long-term oncologic outcomes of laparoscopic versus open surgery for rectal cancer: a pooled analysis of 3 randomized controlled trials. Ann Surg. 2014;259:139-147. Tóm lược)) ((Vennix S, Pelzers L, Bouvy N, et al. Laparoscopic versus open total mesorectal excision for rectal cancer. Cochrane Database Syst Rev. 2014;(4):CD005200. Toàn văn Tóm lược)) ((Bonjer HJ, Deijen CL, Abis GA, et al. A randomized trial of laparoscopic versus open surgery for rectal cancer. N Engl J Med. 2015;372:1324-1332. Toàn văn Tóm lược)) ((Jeong SY, Park JW, Nam BH, et al. Open versus laparoscopic surgery for mid-rectal or low-rectal cancer after neoadjuvant chemoradiotherapy (COREAN trial): survival outcomes of an open-label, non-inferiority, randomised controlled trial. Lancet Oncol. 2014;15:767-774. Tóm lược)) mặc dù trong thực tế, cắt bỏ trực tràng đòi hỏi kỹ thuật cao hơn so với cắt bỏ đại tràng. Tuy nhiên, trong một nghiên cứu, cắt bỏ trực tràng qua nội soi đã không đáp ứng tiêu chí để được xem xét là có kết quả về mặt mô học tương đương với phẫu thuật mở.[110] Các tác giả kết luận rằng kết quả không ủng hộ việc sử dụng cắt bỏ bằng nội soi ở bệnh nhân ung thư trực tràng giai đoạn II và III.
Kỹ thuật cắt bỏ trực tràng bằng robot đã nhận được rất nhiều sự quan tâm. Một nghiên cứu năm 2014 đã xem xét tài liệu hiện có liên quan đến kết cục ngắn hạn và dài hạn của cắt bỏ ung thư trực tràng bằng robot.[111] Nói chung, các nghiên cứu chỉ ra rằng phương pháp sử dụng robot ít phải chuyển sang phẫu thuật mở hơn và thời gian phẫu thuật tương tự như phương pháp nội soi. Kết cục về mặt ung thư tương tự nhau giữa hai phương pháp. Phương pháp sử dụng robot tốn kém hơn, và nhiều nhóm cho rằng có lợi ích thấp về thời gian phẫu thuật và tỷ lệ chuyển sang phẫu thuật mở không đáng so với chi phí phải bỏ thêm.
Ung thư trực tràng giai đoạn I (T1 và T2)
Có thể loại bỏ một số ung thư giai đoạn đầu ở trực tràng qua cắt bỏ khối u qua hậu môn (TART) đối với ung thư trực tràng đoạn thấp, vi phẫu thuật nội soi qua hậu môn (TEM) hoặc phẫu thuật xâm lấn tối thiểu qua hậu môn. Cắt bỏ ung thư trực tràng tại chỗ có thể phù hợp đối với các ung thư có nguy cơ thấp đáp ứng tất cả các tiêu chí sau:
- Đường kính <3 cm
- Ảnh hưởng tới <30% chu vi ruột
- Mô bệnh học biệt hóa mức trung bình hoặc cao
Khu trú (T1, N0, M0).
Đối với ung thư đã biết, tiếp cận qua hậu môn là biện pháp lý tưởng để biết độ dày đầy đủ. Tuy nhiên, có nhiều kỹ thuật đã công bố cho biết mọi thông tin từ đoạn cắt một phần đến cắt niêm mạc (tùy theo mức độ xâm lấn niêm mạc) và thậm chí là bao gồm cả mẫu mạc treo trực tràng. Chống chỉ định tiêu chuẩn đối với cắt bỏ tại chỗ bao gồm:
- Đường kính >3 cm
- Biệt hóa kém
- Xâm lấn mạch bạch huyết hoặc quanh thần kinh
- Xâm lấn cơ vòng hậu môn.
Một thử nghiệm so sánh tiến cứu về cắt bỏ TEM so với phẫu thuật triệt căn cho thấy tỉ lệ mắc bệnh thấp hơn, khả năng tái phát tại chỗ và tỷ lệ sống sót tương tự so với cắt bỏ triệt căn, nhưng không đủ số liệu để đưa ra kết luận xác định.[112] [113] Phân tích tổng hợp các dữ liệu có sẵn cho thấy TEM có ít biến chứng hơn, nhưng tỷ lệ tái phát tại chỗ cao hơn so với phẫu thuật tiêu chuẩn và không kỹ thuật nào cho thấy lợi ích về khả năng sống sót.[114] Có thể cần phẫu thuật xác định hoặc xạ trị sau đó sau khi cắt bỏ khối ung thư tại chỗ nếu diện cắt dương tính, nếu mô bệnh học cho thấy giai đoạn pT2 hoặc nếu khối u được phân loại là pT1 nhưng có đặc điểm mô bệnh học bất lợi. Tuy nhiên, chiến lược an toàn nhất trong những ca bệnh này vẫn là phẫu thuật xác định (cắt dỏ qua đường bụng – đáy chậu hoặc cắt trước thấp).
Những khối u T1 không thích hợp cho cắt tại chỗ và khối u T2 ở phần ba trên trực tràng được xử trí bằng cắt trước có bảo tồn cơ vòng và mở thông đại trực tràng. Đối với những khối u không thể cắt tại chỗ nằm ở phần ba giữa và dưới của trực tràng, cần cắt bỏ bằng thủ thuật cắt trước thấp(LAR) và mở thông đại tràng-hậu môn, trong một số trường hợp có túi đại tràng hoặc tạo hình đại tràng để cải thiện chức năng. Mở thông thấp thường được làm giảm chức năng bằng thủ thuật mở thông hồi tràng tạm thời nhằm làm giảm tỷ lệ mắc rò rỉ vị trí mở thông.[115]
Cần phải cắt bỏ qua đường bụng – đáy chậu (APR) nếu khối u xâm lấn vào sàn chậu, cơ vòng hoặc ống hậu môn. APR đòi hỏi phải thực hiện thủ thuật mở thông hồi tràng vĩnh viễn.
Ung thư trực tràng giai đoạn II đến III
Biện pháp điều trị cho các bệnh nhân mắc ung thư trực tràng lâm sàng giai đoạn II và III ở nhiều trung tâm là xạ trị trước khi phẫu thuật đồng thời hóa trị liệu dựa trên fluoropyrimidine, sau đó là LAR hoặc APR bảo tồn cơ vòng, tùy theo vị trí của khối u so với cơ thắt hậu môn.
Hóa xạ trị liệu tân hỗ trợ tại Hoa Kỳ bao gồm xạ trị 50,4Gy trong 5 tuần đồng thời hóa trị liệu dựa trên fluoropyrimidine, và chủ yếu dựa trên các kết quả của Thử nghiệm nhóm nghiên cứu ung thư trực tràng Đức. Các nghiên cứu khác cho thấy kết quả tương tự giữa hóa-xạ trị liệu tân hỗ trợ và hỗ trợ, với khả năng tái phát tại chỗ thấp nhưng tỷ lệ sống sót không mắc bệnh và lâu dài tương tự. Với kết quả là chức năng sau phẫu thuật cũng như khả năng dung nạp điều trị của bệnh nhân được cải thiện khi dùng xạ trị trước phẫu thuật, đây là biện pháp chăm sóc tiêu chuẩn cho bệnh ung thư trực tràng giai đoạn lâm sàng II và II tại Hoa Kỳ.
Bổ sung hóa trị liệu fluoropyrimidine vào phác đồ trước phẫu thuật làm giảm khả năng tái phát tại chỗ,[116] nhưng không cải thiện tỷ lệ sống sót,[117] và có tác động xấu lên chất lượng cuộc sống.[118] Bổ sung oxaliplatin vào lịch trình hóa-xạ trị liệu không cung cấp thêm lợi ích nào cho tiêu chí đánh giá ngắn hạn ở 1 trong 3 nghiên cứu.[119] [120] [121] Tuy nhiên, nó lại làm gia tăng biến chứng dẫn đến giảm liều lượng và gián đoạn điều trị.[122] [123]Phân tích tổng hợp 6 thử nghiệm cho thấy bổ sung hóa trị liệu vào xạ trị tân hỗ trợ làm giảm tỷ lệ tái phát tại chỗ, nhưng tăng độc tính và không có sự khác biệt về bảo tồn cơ thắt hậu môn hoặc tỷ lệ sống sót chung.[124] Tại Hoa Kỳ, hiện nay tiêu chuẩn chăm sóc cho điều trị tân hỗ trợ ung thư trực tràng giai đoạn II hoặc III bao gồm hóa trị liệu đồng thời.
Tại nhiều quốc gia khác, xạ trị tân hỗ trợ ngắn hạn đã trở thành tiêu chuẩn chăm sóc đối với ung thư trực tràng lâm sàng giai đoạn II và III. Liệu trình là 25Gy chia thành năm liều chiếu trong 1 tuần. Khi so sánh với hóa-xạ trị liệu lâu dài truyền thống, tỷ lệ đáp ứng bệnh học hoàn toàn của xạ trị ngắn hạn thấp hơn, nhưng kết cục lâu dài có vẻ như nhau.[125] [126] [127] [128] Phương pháp này thường dùng cho tổn thương nhỏ, không lớn và không lan rộng hoặc xâm lấn đến lớp cân của mạc treo trực tràng. Lợi ích chính của chiến lược này là có thể tránh được phẫu thuật mở thông hồi tràng và rút ngắn đáng kể thời gian điều trị.
Ở một số trung tâm, khuyến cáo điều trị tân hỗ trợ trước phẫu thuật tùy thuộc một cách chọn lọc vào mức độ của khối u và khoảng cách đến bờ cắt. Lý do để lựa chọn phù hợp nằm trong hướng dẫn lâm sàng về ung thư đại trực tràng của Viện Y tế và Chăm sóc Quốc gia.[129]
Khi áp dụng xạ trị hoặc hóa-xạ trị liệu trước phẫu thuật, lợi ích của hóa trị liệu hỗ trợ sau phẫu thuật bằng fluoropyrimidine sau đó chưa được xác nhận và vẫn còn là vấn đề gây tranh cãi.[130] [131] [132] Khi không dùng xạ trị hoặc hóa-xạ trị liệu trước phẫu thuật, có thể dùng biện pháp điều trị hỗ trợ kết hợp trong giai đoạn sau phẫu thuật nếu phát hiện đặc điểm mô bệnh học bất lợi và cần chỉ định sớm nhất có thể cho những bệnh nhân cần cắt bỏ qua đường bụng-đáy chậu.[133] Xạ trị đơn thuần sau phẫu thuật hiện đã lỗi thời.
Ung thư trực tràng giai đoạn IV kèm di căn có thể cắt bỏ
Khoảng 15% đến 25% bệnh nhân ung thư đại trực tràng biểu hiện di căn đồng thời ở gan, phổi và phúc mạc. Cắt bỏ khối di căn phổi hoặc gan với bờ cắt khối u sạch làm thay đổi đáng kể tiên lượng. Tỷ lệ sống sót trong năm năm sau khi cắt bỏ di căn ung thư đại trực tràng nằm trong khoảng 50% so với tỷ lệ sống sót gần như bằng 0% ở những bệnh nhân không phẫu thuật.[134] Không nên thực hiện cắt bỏ khối di căn gan khi có bệnh không thể cắt bỏ ở khu vực ngoài gan. Tiêu chuẩn xác định khả năng cắt bỏ đang gia tăng và không còn chỉ giới hạn ở số lượng, kích thước, bờ cắt và vị trí của tổn thương gan, mà phản ánh khả năng đạt được phẫu thuật R0 và bảo tồn ít nhất 30% chức năng gan, và duy trì khả năng dẫn lưu đường mật và mạch đầy đủ.
Biện pháp thay thế cho bệnh nhân bị khối di căn gan có thể cắt bỏ là cắt bỏ theo giai đoạn hoặc đồng thời khối di căn gan và khối u nguyên phát kèm hóa trị liệu sau phẫu thuật có hoặc không có xạ trị vùng chậu (tùy thuộc vào giai đoạn T và N của khối u); hoặc chỉ hóa trị liệu trước phẫu thuật hoặc hóa-xạ trị liệu sau đó là cắt bỏ theo giai đoạn hoặc đồng thời khối di căn gan và khối u trực tràng kèm điều trị hỗ trợ sau phẫu thuật tùy thuộc vào giai đoạn T và N của khối u trực tràng. Lựa chọn thứ nhất có thể thích hợp hơn ở bệnh nhân có di căn rõ ràng có thể cắt bỏ và lựa chọn thứ hai thích hợp ở bệnh nhân có ranh giới hoặc bệnh ban đầu không thể cắt bỏ.[135]
Ung thư đại tràng giai đoạn I đến III
Đối với bệnh nhân không có di căn, biện pháp điều trị chính là cắt bỏ đại tràng kèm loại bỏ toàn bộ hạch vùng. Phạm vi cắt bỏ đại tràng tùy thuộc vào việc cắt bỏ phần đại tràng và chuỗi động mạch chứa hạch vùng. Cần cắt bỏ và đánh giá tối thiểu 12 hạch để xác định chính xác giai đoạn. [136] [137] Có thể kiểm soát ung thư gây tắc nghẽn bằng cắt bỏ kèm chuyển lưu tạm thời, hoặc trong trường hợp hiếm gặp và cực kỳ cụ thể, đặt ống thông qua nội soi tạm thời sau đó cắt bỏ.
Bệnh nhân có bệnh ở giai đoạn III cần được chỉ định hóa trị liệu hỗ trợ.[138] Các nghiên cứu ban đầu đánh giá trị liệu sau phẫu thuật bằng fluorouracil và axit folinic cho biết lợi ích về thời gian sống sót chung cuộc và không tiến triển khi theo dõi, nhưng bổ sung oxaliplatin vào fluorouracil và axit folinic ở những bệnh nhân bị bệnh giai đoạn III mang lại lợi ích rõ ràng về thời gian sống sót từ 6 năm đến 10 năm.[139] [140] [141] Ngoài ra, việc kết hợp fluorouracil và axit folinic cộng với oxaliplatin (FOLFOX) cho thấy hiệu quả tương đương đối với capecitabine cộng với oxaliplatin (CAPEOX hoặc XELOX), tương tự như trong trường hợp di căn.[91] Mặc dù có hoạt tính trong trường hợp di căn, irinotecan, bevacizumab và cetuximab lại không cho thấy cải thiện đáng kể ở tỷ lệ sống sót hoặc không bệnh khi được cho dùng trong trường hợp hỗ trợ, và vì vậy không nên được sử dụng.[142] [143] [144] [145] [146] Mặc dù chưa được đánh giá trong trường hợp hỗ trợ, panitumumab không được khuyến cáo khi etuximab thiếu hiệu quả trong điều trị hỗ trợ. Khi cho dùng liệu pháp hỗ trợ, cần bắt đầu trong vòng 8 tuần kể từ khi phẫu thuật.[147] Phân tích tổng hợp đã chỉ ra rằng tăng thời gian hóa trị liệu hỗ trợ thêm 4 tuần làm giảm đáng kể tỷ lệ sống sót không bệnh và thời gian sống chung cuộc.[148] Liệu pháp hỗ trợ được cho dùng trong 6 tháng và không có vai trò rõ ràng khi sử dụng liệu pháp sau đó ở bệnh nhân không tái phát.
Trong khi tất cả bệnh nhân ung thư biểu mô tuyến đại tràng giai đoạn III được khuyến cáo chỉ định hóa trị liệu hỗ trợ, vai trò của hóa trị liệu hỗ trợ ở bệnh nhân giai đoạn II lại không rõ ràng. Tuy nhiên, phân tích nhóm nhỏ gợi ý rằng liệu pháp hỗ trợ cũng có ích cho bệnh nhân giai đoạn II có nguy cơ cao, mặc dù ở mức độ thấp hơn.[139] Hiệp hội Ung thư Lâm sàng Hoa Kỳ kết luận việc sử dụng liệu pháp có thể hợp lý ở những bệnh nhân mắc bệnh giai đoạn II nguy cơ cao, bao gồm bệnh nhân lấy mẫu hạch không đầy đủ (<12 hạch), tổn thương T4, bị thủng hoặc mô học biệt hóa kém.[149] Mạng lưới Ung thư Toàn diện Quốc gia cũng gợi ý rằng xâm lấn mạch bạch huyết và quanh thần kinh cho thấy đặc điểm của nguy cơ cao, và hóa trị liệu hỗ trợ có thể có ích cho những bệnh nhân này. Hóa trị liệu hỗ trợ cho bệnh nhân giai đoạn II là tương tự như fluorouracil, axit folinic và oxaliplatin, hoặc capecitabine và oxaliplatin được khuyến cáo ở bệnh nhân giai đoạn III, ngoại trừ những bệnh nhân trên 70 tuổi mắc bệnh giai đoạn II, d khi đó việc bổ sung oxaliplatin có lợi cho những bệnh nhân này hay không vẫn còn gây tranh cãi.[150] [151] Trái với những bệnh nhân có nguy cơ cao, những bệnh nhân bị ung thư đại tràng giai đoạn II có mức bất ổn vi vệ tinh cao (MSI cao) hoặc lỗi sửa chữa bắt cặp sai (dMMR) có tiên lượng chung tốt và có thể ảnh hưởng đến thời gian sống toàn bộ nếu điều trị bằng hóa trị liệu hỗ trợ.[152]
Ung thư đại tràng giai đoạn IV có khối di căn có thể cắt bỏ
Việc điều trị bệnh nhân có khối di căn có thể cắt bỏ tuân theo các nguyên tắc tương tự như đối với bệnh nhân ung thư trực tràng và có khối di căn có thể cắt bỏ, biểu hiện ở cả thời gian phẫu thuật liên quan đến hóa trị liệu và phác đồ hóa trị liệu tối ưu.
Ung thư đại trực tràng giai đoạn IV có khối di căn không thể cắt bỏ hoặc không thể phẫu thuật
Trong trường hợp này, điều trị là một phần của phương pháp giảm nhẹ chứ không có tác dụng chữa trị và mục tiêu của điều trị là kéo dài thời gian sống và duy trì chất lượng cuộc sống. Trong khi trị liệu toàn thân là biện pháp điều trị chính, có thể sử dụng các cơ chế thay thế như diệt khối u bằng vi sóng, tiêm truyền vào động mạch gan, nút hóa chất động mạch hoặc nút mạch phóng xạ, mặc dù dữ liệu đối chứng ngẫu nhiên đánh giá tác động tổng thể vẫn còn hạn chế.[153] [154] [155] Ở bệnh nhân bị ung thư trực tràng, có thể cần các biện pháp điều trị bổ sung tập trung vào khối u nguyên phát để kiểm soát triệu chứng. Những biện pháp này bao gồm đặt ống thông nội soi cho khối u gây tắc nghẽn, xạ trị, tái tạo dòng chảy bằng laser, mở thông hồi tràng ra ngoài hoặc phẫu thuật cắt bỏ khối u nguyên phát nếu bệnh nhân phù hợp về mặt y tế. Thời gian sống ước tính cho bệnh nhân bị bệnh lan tỏa nhận được chăm sóc hỗ trợ tốt nhất là khoảng 6 tháng. Sử dụng fluorouracil/axit folinic có thể tăng thời gian sống sót đến khoảng 10 đến 12 tháng trong khi oxaliplatin kết hợp với fluorouracil/axit folinic và irinotecan kết hợp với fluorouracil/axit folinic có thể tăng thời gian sống lên 20 đến 21 tháng.[156] [157] Bổ sung tác nhân sinh học vào biện pháp chính này kéo dài thời gian sống khoảng 27 đến 33 tháng.[158]
Phần lớn bệnh nhân có chỉ định liệu pháp toàn thân cho ung thư đại trực tràng giai đoạn IV không thể cắt bỏ sẽ áp dụng liệu pháp hóa trị liệu bằng 2 loại thuốc và một tác nhân sinh học. Liệu pháp hóa trị liệu chính thường là fluorouracil/axit folinic với oxaliplatin (FOLFOX hoặc FLOX) hoặc irinotecan (FOLFIRI). Capecitabine có thể thay thế cho fluorouracil/axit folinic với hiệu quả tương đương khi dùng kết hợp với oxaliplatin,[159] [160] nhưng biến cố bất lợi quan sát được ở các thử nghiệm lâm sàng capecitabine và irinotecan lại cản trở sự kết hợp này.[156] Có hai loại tác nhân sinh học chính dùng để điều trị ung thư đại trực tràng di căn: chất ức chế yếu tố tăng trưởng nội mạc mạch máu (VEGF) và chất đối kháng thụ thể yếu tố tăng trưởng nội mạc (EGFR). Bevacizumab là chất ức chế VEGF-A cho thấy lợi ích khi kết hợp với cả phác đồ chứa oxaliplatin và irinotecan trong điều trị bước đầu và sau đó, bao gồm khi tiếp tục dùng bevacizumab dựa trên phác đồ chứa bevacizumabkhi bệnh tiến triển. [161] [162] [163] [164] Hai chất ức chế VEGF khác, aflibercept và ramucirumab, được chấp thuận sử dụng kết hợp với FOLFIRI dựa trên phác đồ chứa oxaliplatin sau khi bệnh tiến triển, kèm hoặc không kèm bevacizumab.[165] [166] Cuối cùng, regorafenib là chất ức chế nhiều kinase đường uống có các đặc tính chống VEGF đã chứng minh là có cải thiện khiêm tốn về thời gian sống sót ở dạng đơn chất, so với giả dược, sau khi bệnh tiến triển dựa trên tất cả các hướng điều trị.[167] Có hai loại chất ức chế EGFR được chấp thuận sử dụng ở các bệnh nhân ung thư đại tràng di căn – cetuximab và panitumumab. Trong khi các nghiên cứu ban đầu về các chất ức chế EGFR này được tiến hành ở quần thể không chọn lọc, các phân tích hồi cứu chỉ ra rằng lợi ích của các thuốc này giới hạn ở những bệnh nhân không có đột biến exon KRAS 2.[168] [169] Các phân tích bổ sung gợi ý rằng lợi ích còn giới hạn ở những bệnh nhân không có đột biến exon KRAS hoặc NRAS 2, 3 hoặc 4.[170] [171] [172] Trong quần thể NRAS và KRAS loại tự nhiên, có thể sử dụng cả cetuximab và panitumumab kết hợp với các phác đồ chứa oxaliplatin và irinotecan như biện pháp bước đầu hoặc sau đó, và dưới dạng đơn chất sau khi bệnh tiến triển dựa trên ít nhất một hướng điều trị toàn thân.[168] [170] [171] [172] [173]
Các nghiên cứu chỉ ra rằng bệnh nhân có thể được điều trị bằng phác đồ chứa oxaliplatin hoặc irinotecan kèm bevacizumab hoặc cetuximab mà không có bất kỳ khác biệt nào có ý nghĩa thống kê về thời gian sống sót hoặc không tiến triển bệnh.[158] [174]
Hơn nữa, kết hợp fluorouracil, axit folinic, oxaliplatin và irinotecan (FOLFOXIRI) với bevacizumab đã được chứng minh là cải thiện thời gian sống không tiến triển bệnh mà không cải thiện thời gian sống có ý nghĩa thống kê so với FOLFIRI và bevacizumab dùng trong điều trị bước đầu. Tuy nhiên, kết hợp này lại gây ra độc tính đáng kể và chỉ dành cho những bệnh nhân phù hợp nhất.[175] Liệu pháp bước đầu dành cho bệnh nhân mắc ung thư đại trực tràng di căn thường sử dụng nhất tại Hoa Kỳ là FOLFOX hoặc CAPEOX kèm bevacizumab. Thời gian dùng liệu pháp tùy thuộc vào khả năng dung nạp, nhưng các nghiên cứu ủng hộ việc sử dụng liệu pháp duy trì (fluorouracil/axit folinic hoặc capecitabine và bevacizumab) sau 6 đến 8 đợt FOLFOX hoặc CAPEOX kèm bevacizumab có tái bổ sung oxaliplatin khi bệnh tiến triển.[176] [177] Ngoài ra, liệu pháp tấn công và liệu pháp duy trì không được chứng minh là vượt trội hơn so với liệu pháp tấn công sau các đợt nghỉ điều trị.[178] [179] [180]
Khi bệnh tiến triển trên phác đồ chứa oxaliplatin và bevacizumab, nếu bệnh nhân tiếp tục duy trì thể trạng, bệnh nhân sẽ được đổi sang FOLFIRI và bevacizumab; ngoài ra, bevacizumab có thể thay thế cho aflibercept hoặc ramucirumab, hoặc cetuximab hoặc panitumumab nếu bệnh nhân có loại KRAS và NRAS tự nhiên. Tiếp tục liệu pháp này cho đến khi bệnh tiến triển, ở điều trị duy trì hoặc sau các đợt nghỉ điều trị như trên. Khi bệnh tiến triển, xem xét dùng liệu pháp kháng EGFR, nếu chưa từng dùng, hoặc regorafenib.
Tổng quan về các chi tiết điều trị
Tham khảo cơ sở dữ liệu dược địa phương của quý vị để biết thông tin toàn diện về thuốc, bao gồm các chống chỉ định, tương tác giữa các loại thuốc, và liều dùng thay thế. ( xem Tuyên bố miễn trách nhiệm )
| Cấp tính (tóm tắt) | ||
| Ung thư trực tràng, phù hợp để phẫu thuật | ||
|
1 | Cắt bỏ khối u tại chỗ hoặc cắt bỏ triệt căn |
|
1 | Cắt bỏ triệt căn |
| bổ sung | Xạ trị ± hóa trị liệu trước phẫu thuật | |
|
1 | Cắt bỏ triệt căn |
| thêm | Hóa-xạ trị liệu trước phẫu thuật | |
| thêm | Hóa trị liệu sau phẫu thuật | |
|
1 | Phẫu thuật cắt bỏ |
| thêm | Hóa-xạ trị liệu | |
| Ung thư trực tràng, không phù hợp để phẫu thuật | ||
|
1 | Hóa trị liệu |
| bổ sung | Kháng thể đơn dòng | |
| bổ sung | Đặt cầu nối | |
| 2 | Phác đồ hóa trị liệu thay thế | |
| bổ sung | Đặt cầu nối | |
| Ung thư đại tràng, phù hợp để phẫu thuậ | ||
|
1 | Phẫu thuật cắt bỏ |
| thêm | Hóa trị liệu sau phẫu thuật | |
|
1 | Phẫu thuật cắt bỏ sau khi hóa trị liệu trước phẫu thuật |
| thêm | Hóa trị liệu trước phẫu thuật | |
| bổ sung | Kháng thể đơn dòng | |
| 1 | Phẫu thuật cắt bỏ tức thì | |
| thêm | Hóa trị liệu sau phẫu thuật | |
| thêm | Kháng thể đơn dòng | |
| Ung thư đại tràng, không phù hợp để phẫu thuật | ||
|
1 | Hóa trị liệu |
| thêm | Kháng thể đơn dòng | |
| bổ sung | Đặt cầu nối | |
| 2 | Phác đồ hóa trị liệu thay thế | |
| bổ sung | Đặt cầu nối | |
Các lựa chọn điều trị
| Cấp tính | ||
| Ung thư trực tràng, phù hợp để phẫu thuật | ||
|
1 | Cắt bỏ khối u tại chỗ hoặc cắt bỏ triệt căn |
| » Khối u giai đoạn I là T1-2, N0, M0. » Khi khối u T1 có tính chất khu trú, không tổn thương hạch bạch huyết, bệnh nhân có thể phù hợp với phương pháp cắt bỏ tại chỗ hoàn toàn, mặc dù bệnh nhân cần được cho biết rằng tỷ lệ tái phát cao hơn so với cắt bỏ triệt căn.[181] Nhìn chung, không nên cắt bỏ tại chỗ khối u T2. Nếu khối u này được cắt bỏ tại chỗ, cần điều trị bổ sung bằng hóa-xạ trị liệu.[182] Cắt bỏ tại chỗ khối u giai đoạn I được ghi nhận là không có khả năng lấy hạch bạch huyết để quan sát mô bệnh học Tỷ lệ di căn hạch bạch huyết ẩn cũng được ghi nhận là tăng khi tăng giai đoạn T. Ví dụ, tỷ lệ di căn hạch bạch huyết ở tổn thương T1 là khoảng 10%, tăng lên 20% ở khối u T2. Vấn đề này cần phải được thảo luận với bệnh nhân khi cân nhắc lựa chọn trước khi phẫu thuật. » Trong khi cắt bỏ triệt căn (cắt trước), bảo tồn cơ thắt là lựa chọn đem lại nguy cơ tái phát thấp nhất cả ở ung thư trực tràng giai đoạn đầu và giai đoạn tiến triển hơn. Phương pháp này cho phép quan sát mô bệnh học mạc treo trực tràng và nếu hạch bạch huyết thực sự âm tính, nó giúp tránh dùng hóa trị liệu và xạ trị bổ sung. Việc thảo luận phương pháp cắt bỏ triệt căn trong ung thư trực tràng giai đoạn đầu ngày càng trở nên phức tạp khi khối u có nguy cơ thấp và cắt bỏ triệt căn không thể bảo tồn cơ vòng và cần cắt bỏ qua đường bụng-đáy chậu kèm mở thông hồi tràng vĩnh viễn. » Bổ sung hóa trị liệu và xạ trị làm giảm tỷ lệ tái phát bệnh tại chỗ ở ung thư trực tràng giai đoạn đầu được cắt bỏ tại chỗ và là điều bắt buộc khi đưa ra quyết định cắt khối u T2 tại chỗ. Dữ liệu liên quan đến bổ sung hóa trị liệu và xạ trị cho khối u T1 cắt bỏ tại chỗ vẫn còn gây nhiều tranh cãi. » Yếu tố hạn chế của phương pháp cắt bỏ qua hậu môn bằng các dụng cụ thường quy chính là khả năng tiếp cận và biện pháp này thường bị giới hạn ở vị trí trực tràng cách hậu môn 8 cm (cắt bỏ khối u qua hậu môn [TART]). » Vi phẫu nội soi qua hậu môn (TEM) cho phép tiếp cận tổn thương tốt hơn ở vị trí trực tràng gần so với các phương pháp thường quy bằng cách sử dụng một thiết bị bơm cacbon dioxit vào trực tràng, duy trì độ phồng và cho phép hút và rửa bằng nước. Bờ quanh khối u được đánh dấu bằng dao đốt, tổn thương bị cắt và khâu vết thương. Không cần điều trị thêm nếu bờ sạch trên mẫu mô cắt với mức mô bệnh học T1 (pT1) và không có đặc điểm bất lợi (biệt hóa kém, xâm lấn mạch bạch huyết). Phân tích tổng hợp các dữ liệu có sẵn cho thấy TEM có ít biến chứng hơn, nhưng tỷ lệ tái phát tại chỗ cao hơn so với phẫu thuật tiêu chuẩn và không kỹ thuật nào cho thấy lợi ích về khả năng sống sót.[114] » Phẫu thuật xâm lấn tối thiểu qua hậu môn là thủ thuật bảo tồn cơ quan, được thực hiện hoàn toàn thông qua lỗ mở tự nhiên của cơ thể. Phương pháp phục hồi không sẹo này cho phép lấy lại chức năng ruột thông thường nhanh hơn so với TEM hoặc TART.[183] [184] |
||
|
1 | Cắt bỏ triệt căn |
| » Khối u giai đoạn I là T1-2, N0, M0. » Bệnh nhân ung thư trực tràng không đáp ứng với phương pháp cắt khối u tại chỗ cần được điều trị bằng cắt bỏ qua đường bụng có bảo tồn cơ thắt hậu môn nếu có thể. » Khối u ở phần ba phía trên của trực tràng được loại bỏ bằng phương pháp cắt trước cao, trong đó trực tràng và mạc treo trực tràng được cắt đến 5 cm phía dưới khối u, và nối thông đại -trực tràng. » Khối u ở phần ba giữa và dưới cần phải cắt trước thấp với loại bỏ tất cả trực tràng và mạc treo trực tràng, bằng cách sử dụng phương pháp cắt toàn bộ mạc treo trực tràng cũng như toàn bộ bao mô mềm quanh trực tràng. Thực hiện mở thông trực tràng-hậu môn, ở một số trường hợp tạo túi trực tràng hoặc tái tạo đại tràng để cải thiện chức năng. Mở thông thhấp nư vậy thường được làm giảm chức năng bằng thủ thuật mở thông hồi tràng tạm thời, điều này làm giảm tỷ lệ rò rỉ miệng nối và nhu cầu phẫu thuật khẩn cấp sau khi cắt bỏ chọn lọc.[115] » Cần phải cắt bỏ qua đường bụng-đáy chậu kèm mở thông hồi tràng vĩnh viễn nếu khối u xâm lấn vào sàn chậu, cơ thắt hoặc ống hậu môn. » Khối u T2N0 thấp được xem là có ‘nguy cơ cao’ tái phát tại chỗ. Nếu thực hiện phẫu thuật cắt tại chỗ qua đường hậu môn, cần thực hiện hóa-xạ trị liệu hỗ trợ.[182] |
||
| bổ sung | Xạ trị ± hóa trị liệu trước phẫu thuật | |
| » Xạ trị bổ trợ trước phẫu thuật liệu trình kinh điển 50,4Gy trong 5 tuần. » Xạ trị thời gian ngắn trước phẫu thuật làm giảm tỷ lệ tái phát tại chỗ trong trường hợp ung thư trực tràng có thể phẫu thuật, nhưng có thể ảnh hưởng đến khả năng lành vết thương và tăng tỷ lệ mất tự chủ đại tiện và rối loạn chức năng tình dục.[149] Phương pháp này phổ biến ở châu Âu hơn Bắc Mỹ. Liệu trình được sử dụng là 25 Gy, chia 5 liều chiếu xạ trong 1 tuần và bố trí lịch phẫu thuật trong vòng 10 ngày kể từ liều chiếu cuối cùng » Tại Hoa Kỳ, phác đồ chuẩn là dùng đồng thời hóa trị liệu dựa trên fluorouracil (kèm axit folinic) hoặc capecitabine. Phác đồ này giảm tỷ lệ tái phát tại chỗ và có ít biến chứng hơn là điều trị sau phẫu thuật. |
||
|
1 | Cắt bỏ triệt căn |
| » Khối u giai đoạn II-III từ T3-4, N0, M0 đến T bất kỳ, N1-2, M0. » Thực hiện phẫu thuật cắt bỏ từ 6 đến 10 tuần sau khi kết thúc điều trị hỗ trợ. Bệnh nhân cần được điều trị bằng phương pháp cắt thấp trước hoặc cắt qua đường bụng-đáy chậu tùy theo vị trí của khối u liên quan đến cơ vòng hậu môn và nếu có thể bảo tồn cơ vòng. » Đối với các tổn thương nằm ở phần ba trên trực tràng, điều trị lựa chọn là cắt trước trên và nối thông đại – trực tràng. Các tổn thương phần ba giữa và dưới trực tràng cần cắt trước thấp với cắt toàn bộ mạc treo trực tràng và nối thông đại tràng-hậu môn có tạo hình túi đại tràng hoặc tạo hình đại tràng để cải thiện chức năng. Nối thông thấp cần hỗ trợ bằng phẫu thuật mở thông hồi tràng làm giảm chức năng tạm thời. Cắt bỏ qua đường bụng-đáy chậu nếu khối u xâm lấn vào sàn chậu, cơ vòng hoặc ống hậu môn. |
||
| thêm | Hóa-xạ trị liệu trước phẫu thuật | |
| Các lựa chọn sơ cấp » fluorouracil -và- » folinic acid HOẶC » capecitabine » Thời gian sống của bệnh nhân có hạch được cải thiện bằng xạ trị ngắn ngày (5 x 5 Gy), nhưng gây ra độc tính và nguy cơ cao hơn mắc bệnh ác tính thứ phát.[125] So sánh trực tiếp xạ trị và hóa-xạ trị liệu ngắn ngày trước phẫu thuật cho kết quả ban đầu là như nhau.[126] [127] [128] » Bổ sung hóa trị liệu fluoropyrimidine vào phác đồ trước phẫu thuật làm giảm khả năng tái phát tại chỗ,[116] nhưng không cải thiện tỷ lệ sống sót,[117] và không có hiệu quả cải thiện chất lượng cuộc sống.[118] Bổ sung oxaliplatin vào phác độ hóa-xạ đã đem lại lợi ích đối với tiêu chí đánh giá ngắn hạn chỉ ở một số nghiên cứu.[119] [120] [121] [122] [123] » Ở một số trung tâm, điều trị bổ trợ trước phẫu thuật tùy thuộc vào mức độ của khối u và khoảng cách đến bơ cắt Lý do để lựa chọn phù hợp dựa trên hướng dẫn lâm sàng về ung thư đại trực tràng của Viện Y tế và Chăm sóc Quốc gia (NICE).[129] » Khi đã áp dụng xạ trị hoặc hóa-xạ trị liệu trước phẫu thuật, lợi ích của hóa trị liệu hỗ trợ bằng fluoropyrimidin sau phẫu thuật chưa được khẳng định và vẫn còn là vấn đề gây tranh cãi.[130] [131] [132] Khi không dùng xạ trị hoặc hóa-xạ trị trước phẫu thuật, có thể dùng biện pháp điều trị hỗ trợ kết hợp sau phẫu thuật nếu có dấu hiệu mô bệnh học bất lợi và cần áp dụng sớm nhất có thể cho những bệnh nhân cắt bỏ qua đường bụng-đáy chậu.[133] Xạ trị đơn thuần sau phẫu thuật hiện đã lỗi thời. » Tham khảo phác đồ của chuyên gia khu vực để biết về hướng dẫn sử dụng liều lượng hóa-xạ trị liệu. |
||
| thêm | Hóa trị liệu sau phẫu thuật | |
| Các lựa chọn sơ cấp » fluorouracil -và- » folinic acid HOẶC » oxaliplatin -và- » folinic acid -và- » fluorouracil HOẶC » capecitabine HOẶC » capecitabine -và- » oxaliplatin » No trial has demonstrated conclusively that adjuvant chemotherapy improves outcome in patients who have received preoperative chemoradiotherapy. Tuy nhiên, hướng dẫn của Mạng lưới Ung thư Toàn diện Quốc gia, chủ yếu dựa trên dữ liệu hồi cứu và lợi ích của hóa trị liệu hỗ trợ trong ung thư đại tràng, khuyến cáo hóa trị liệu sau phẫu thuật ở tất cả các bệnh nhân nhận đã áp dụng liệu pháp trước phẫu thuật bất kể giai đoạn mô bệnh học ở mẫu bệnh phẩm cắt bỏ.[185]» Các lựa chọn bao gồm fluorouracil và axit folinic, FOLFOX (oxaliplatin, axit folinic và fluorouracil), và capecitabine có hoặc không có oxaliplatin. Sử dụng FOLFOX và capecitabine (có hoặc không có oxaliplatin) dựa trên dữ liệu ngoại suy từ các nghiên cứu ung thư đại tràng và, cũng như trong ung thư đại tràng, phác đồ có oxaliplatin là lựa chọn ưu tiên để hỗ trợ trị liệu ở ung thư trực tràng. » Tham khảo hướng dẫn của chuyên gia khu vực về hướng dẫn sử dụng liều hóa trị liệu. |
||
|
1 | Phẫu thuật cắt bỏ |
| » Khối u giai đoạn IV là T bất kỳ, N bất kỳ, M1. » Những bệnh nhân ung thư trực tràng di căn có thể cắt bỏ thường chỉ định biện pháp kết hợp giữa hóa trị liệu toàn thân, hóa-xạ trị liệu cho khối u nguyên phát và phẫu thuật đối với tổn thương nguyên phát và di căn. Tuy nhiên, trình tự điều trị tối ưu chưa được xác định. » Nhìn chung, thường bắt đầu bằng hóa trị liệu kết hợp đường toàn thân. Bước tiếp theo có thể là hóa- xạ trị liệu đối với tổn thương nguyên phát và đồng thời cắt bỏ khối u nguyên phát và tổn thương di căn. Tuy nhiên, thường gặp hơn là cắt bỏ nhiều thì, có nghĩa là cắt bỏ tổn thương di căn, sau đó là hóa-xạ trị liệu khối u nguyên phát, và tiếp theo là cắt bỏ khối u nguyên phát hoặc hóa-xạ trị liệu cho khối u nguyên phát, cắt bỏ khối u nguyên phát, và cuối cùng là cắt bỏ tổn thương di căn. Ngoài ra, cũng có thể tiến hành hóa-xạ trị liệu tại vị trí nguyên phát sau khi phẫu thuật. Tiếp theo, hóa trị liệu kết hợp đường toàn thân cũng thường được tiến hành sau phẫu thuật. |
||
| thêm | Hóa-xạ trị liệu | |
| » Các lựa chọn hóa trị liệu đường toàn thân bao gồm fluorouracil ± axit folinic, capecitabine, FOLFOX (dựa trên oxaliplatin, axit folinic và fluorouracil), FOLFIRI (irinotecan, axit folinic và fluorouracil), hoặc CapeOX (oxaliplatin và capecitabine). Vai trò của các phác đồ hóa trị liệu kết hợp này chưa được thử nghiệm rộng rãi ở liệu pháp tân hỗ trợ hoặc hỗ trợ trong ung thư trực tràng di căn có thể cắt bỏ, nhưng chúng lại được khuyến cáo trong hướng dẫn của Viện Y tế và Chăm sóc Quốc gia (NICE).[186] » Một nhóm chuyên gia đã kết luận dùng riêng phác đồ fluorouracil/axit folinic hiếm khi phù hợp và nên hợp với oxaliplatein (phác đồ FOLFOX) hoặc irinotecan (phác đồ FOLFIRI) kèm hoặc không có bevacizumab trong 4 đến 6 tháng.[178] » Có thể tăng cường FOLFOX, FOLFIRI và CapeOX bằng cách bổ sung bevacizumab, một kháng thể đơn dòng kháng lại yếu tố tăng trưởng nội mạc mạch máu VEGF), hoặc cetuximab hoặc panitumumab (kháng thể’ đơn dòng kháng thụ thể’ yếu tố tăng trưởng biểu bì) có thể’ hiệu quả ở những bệnh nhân có khối u không chứa đột biến ở exon KRAS hoặc NRAS 2, 3 và 4. Thông thường, việc kết hợp hóa trị liệu và hóa- xạ trị liệu trước và sau phẫu thuật mất khoảng 6 tháng, và thứ tự dùng liệu pháp phụ thuộc vào từng bệnh nhân. | ||
| Ung thư trực tràng, không phù hợp để phẫu thuật | ||
|
1 | Hóa trị liệu |
| Các lựa chọn sơ cấp » oxaliplatin -vଠ» fluorouracil -vଠ» folinic acid HOẶC » irinotecan -vଠ» fluorouracil -vଠ» folinic acid HOẶC » capecitabine -và- » oxaliplatin HOẶC » fluorouracil -và- » folinic acid HOẶC» capecitabine » Khối u giai đoạn I là T1-2, N0, M0; khối u giai đoạn II-III là T3-4, N0, M0 đến T bất kỳ, N1-2, M0. Khối u giai đoạn IV là T bất kỳ, N bất kỳ, M1. » Hóa trị liệu hàng đầu, FOLFOX (oxaliplatin, axit folinic và fluorouracil) và FOLFIRI (irinotecan, axit folinic và fluorouracil) có hiệu quả tương tự nhau. Có thể’ ưu tiên dùng FOLFIRI nếu có bệnh lý thần kinh có trước đó vì khả năng gây độc thần kinh của oxaliplatin. Hướng dẫn của NCCN cũng khuyến cáo thay thế fluorouracil/axit folinic bằng capecitabine và oxaliplatin (CapeOX). Kết hợp sử dụng chính là fluoropyrimidine (fluorouracil hoặc capecitabine) cùng với oxaliplatin hoặc irinotecan cho thấy hiệu quả nhiều hơn so với fluoropyrimidine đơn chất, và có thể dùng cả cho bệnh nhân cao tuổi.[187] » Đối với những bệnh nhân không phù hợp với điều trị tăng cường, fluorouracil/axit folinic hoặc capecitabine có thể là lựa chọn phù hợp. » Hóa trị liệu thành từng đợt hay liên tục vẫn còn là vấn đề gây tranh cãi.[178] [188] » Tham khảo hướng dẫn của chuyên gia khu vực để biết về hướng dẫn sử dụng liều. |
||
| bổ sung | Kháng thể đơn dòng | |
| Các lựa chọn sơ cấp » bevacizumab Các lựa chọn thứ cấp » cetuximab HOẶC » panitumumab » Bổ sung bevacizumab vào các phác đồ này làm tăng tỷ lệ đáp ứng của khối u, kéo dài thời gian trước khi bệnh tiến triển cũng như kéo dài thời gian sống sót thêm từ 2 đến 6 tháng.[189] [163] » Một số nghiên cứu đã thử nghiệm vai trò của cetuximab hoặc panitumumab dùng như điều trị bậc một (chất ức chế thụ thể yếu tố tăng trưởng biểu bì [EGFR]) kèm irinotecan hoặc oxaliplatin kết hợp với fluoropyrimidine. Nghiên cứu chỉ ra đối với bệnh nhân có gen KRAS hoặc NRAS loại tự nhiên (ví dụ: không có đột biến ở exon KRAS hoặc NRAS 2, 3 và 4), có lợi ích khi dùng cetuximab hoặc panitumumab nhưng cho đến nay, các kết quả vẫn còn mâu thuẫn và dường như phụ thuộc vào việc liệu bệnh nhân sử dụng hóa trị liệu kết hợp irinotecan hay oxaliplatin.[190] » Tuy nhiên, các nghiên cứu khác cho thấy có thể kết hợp chất ức chế EGFR (cetuximab hoặc panitumumab) hoặc bevacizumab với phác đồ có oxaliplatin hoặc irinotecan với hiệu quả tương đương khi sử dụng như biện pháp điều trị bậc một.[158] » Chất ức chế EGFR chỉ có hiệu quả ở bệnh ung thư đại trực tràng có KRAS hoặc NRAS loại tự nhiên, và luôn cần đánh giá điều này trước khi bắt đầu điều trị bằng panitumumab hoặc cetuximab. Những chất chỉ điểm này không liên quan đến bevacizumab.[191]» Tại Anh, Viện Y tế và Chăm sóc Quốc gia (NICE) đã kết luận rằng bevacizumab không được coi là chi phí hiệu quả khi kết hợp với hóa trị liệu như biện pháp điều trị bậc một đối với bệnh ung thư đại trực tràng di căn,[186] nhưng cetuximab có thể dùng như phác đồ bậc một iiính đến chi phí – hiệu quả[192] » Tham khảo hướng dẫn của chuyên gia khu vực để biết về hướng dẫn sử dụng liều. |
||
| bổ sung | Đặt cầu nối | |
| » Tạo cầu nối (stent) có thể phù hợp ở một số bệnh nhân bị khối u gây tắc nghẽn trực tràng. | ||
| 2 | Phác đồ hóa trị liệu thay thế | |
| Các lựa chọn sơ cấp » irinotecan -và- » folinic acid -và- » fluorouracil HOẶC » irinotecan -và- » folinic acid -và- » fluorouracil –VÀ– » bevacizumab -hoặc- » aflibercept -hoặc- » ramucirumab -hoặc- » cetuximab -hoặc- » panitumumab HOẶC » cetuximab HOẶC » panitumumab HOẶC » oxaliplatin -và- » folinic acid -và-» fluorouracil HOẶC » oxaliplatin -và- » folinic acid -và- » fluorouracil –VÀ– » bevacizumab -hoặc- » cetuximab -hoặc- » panitumumab HOẶC » oxaliplatin -và- » capecitabine HOẶC » oxaliplatin -và- » capecitabine –VÀ– » bevacizumab -hoặc- » cetuximab -hoặc- » panitumumab » Khối u giai đoạn I là T1-2, N0, M0; khối u giai đoạn II-III là T3-4, N0, M0 đến T bất kỳ, N1-2, M0. Khối u giai đoạn IV là T bất kỳ, N bất kỳ, M1. » Ở những bệnh nhân được xem là không phù hợp để phẫu thuật, không thể xác định chính xác giai đoạn của khối u. Như vậy, tất cả điều trị đều là giảm nhẹ và có thể tạo cầu nối cho khối u tắc nghẽn. » Lựa chọn điều trị cho những bệnh nhân tiến triển khi dùng liệu pháp ban đầu với phác đồ dựa trên FOLFOX hoặc CapeOX bao gồm FOLFIRI có hoặc không có bevacizumab, aflibercept hoặc ramucirumab ở tất cả bệnh nhân hoặc ở bệnh nhân có KRAS và NRAS loại tự nhiên là cetuximab hoặc panitumumab đơn thuần hoặc kết hợp với FOLFIRI.[193] [194] Có thể sử dụng aflibercept hoặc ramucirumab thay thế bevacizumab kết hợp với phác đồ có irinotecan nếu liệu pháp ban đầu là phác đồ bao gồm cả oxaliplatin. » Có thể xem xét FOLFOX hoặc CapeOX kèm hoặc không kèm bevacizumab ở những bệnh nhân được điều trị ban đầu bằng phác đồ FOLFIRI thậm chí ngay cả khi đã sử dụng bevacizumab như liệu pháp hàng đầu. Đối với những bệnh nhân có gen KRAS hoặc NRAS loại tự nhiên, cũng có thể cân nhắc FOLFOX hoặc CapeOx kết hợp với cetuximab hoặc panitumumab, hoặc cetuximab hoặc panitumumab đơn chất.[185] » Tham khảo hướng dẫn của chuyên gia khu vực để biết về hướng dẫn sử dụng liều. |
||
| bổ sung | Đặt cầu nối | |
| » Tạo cầu nối (stent) có thể phù hợp ở một số bệnh nhân bị khối u gây tắc nghẽn trực tràng. | ||
| Ung thư đại tràng, phù hợp để phẫu thuậ | ||
|
1 | Phẫu thuật cắt bỏ |
| » Khối u giai đoạn I là T1-2, N0, M0; khối u giai đoạn II-III là T3-4, N0, M0 đến T bất kỳ, N1-2, M0. » Cắt từng thì là biện pháp điều trị chủ yếu ở những bệnh nhân bị ung thư đại tràng không di căn. Có thể điều trị tắc nghẽn do ung thư bằng cắt bỏ từng thì và nối thông ngay nếu có thể, hoặc tạo cầu nối trong đại tràng bằng nội soi cùng với phẫu thuật cắt bỏ bán lựa chọn. |
||
| thêm | Hóa trị liệu sau phẫu thuật | |
| Các lựa chọn sơ cấp » fluorouracil -và- » folinic acid -và- » oxaliplatin HOẶC » capecitabine -và- » oxaliplatin » Những bệnh nhân bị bệnh giai đoạn III cần được chỉ định hóa trị liệu.[138] Các thử nghiệm lâm sàng đối chứng cho thấy cải thiện thời gian sống sót ở bệnh nhân mắc ung thư đại tràng giai đoạn III (T1-4, N1-2, M0) khi được điều trị bằng hóa trị liệu hỗ trợ.[139] Nguy cơ độc tính do hóa trị liệu có thể tăng ở những bệnh nhân cao tuổi và những người mắc bệnh đồng thời, và quyết định trị liệu bổ trợ cần dựa trên đánh giá và thảo luận từng bệnh nhân. Nên bắt đầu hóa trị liệu hỗ trợ trong vòng 8 tuần sau phẫu thuật.[147] Phân tích tổng hợp đã chỉ ra rằng tăng thời gian hóa trị liệu hỗ trợ thêm 4 tuần làm giảm đáng kể tỷ lệ sống sót không bệnh và thời gian sống chung cuộc.[148] Fluorouracil/axit folinic cộng với oxaliplatin (FOLFOX) và capecitabine cộng với oxaliplatin (CapeOx) có hiệu quả tương đương nhau.[91] » Hóa trị liệu hỗ trợ cũng có hiệu quả trên bệnh nhân mắc bệnh giai đoạn II nguy cơ cao, mặc dù ở mức thấp hơn.[139] Hiệp hội Ung thư Lâm sàng Hoa Kỳ kết luận rằng hóa trị liệu hỗ trợ có thể phù hợp ở những bệnh nhân mắc bệnh giai đoạn II nguy cơ cao, bao gồm bệnh nhân lấy mẫu hạch không đầy đủ (<12), tổn thương T4, bị thủng hoặc mô học biệt hóa kém.[149] » Hướng dẫn của NCCN cũng chỉ ra xâm lấn bạch mạch và quanh thần kinh là những đặc điểm của nguy cơ cao và vì vậy hóa trị liệu hỗ trợ có thể có ích cho những bệnh nhân này. » Liệu việc bổ sung oxaliplatin có hiệu quả trên những bệnh nhân bị bệnh giai đoạn II và những người trên 70 tuổi hay không vẫn còn là vấn đề gây tranh cãi.[150] [151] Không có tác nhân đích nào (ví dụ: cetuximab, bevacizumab, panitumumab) hoặc irinotecan được chứng minh là hiệu quả trong điều trị hỗ trợ ở bệnh ung thư đại tràng, và vì vậy không nên sử dụng. [143] [144] [145] [142] [146] » Những bệnh nhân tổn thương giai đoạn II và có đặc điểm tiên lượng tốt, như vi vệ tinh cao hoặc thiếu hụt protein sửa chữa bắt cặp sai bằng phương pháp hóa mô miễn dịch, có thể không hiệu quả khi dùng hóa trị liệu hỗ trợ và vì vậy không nên sử dụng sau phẫu thuật.[152] » Tham khảo hướng dẫn của chuyên gia khu vực để biết về hướng dẫn sử dụng liều. |
||
|
1 | Phẫu thuật cắt bỏ sau khi hóa trị liệu trước phẫu thuật |
| » Khối u giai đoạn IV là T bất kỳ, N bất kỳ, M1. » Sau khi hóa trị liệu trước phẫu thuật, tiến hành cắt bỏ đại tràng đồng thời hoặc theo thì và cắt bỏ phần di căn. Tại một số trung tâm, cắt bỏ đại tràng được thực hiện trước khi hóa trị liệu và cắt bỏ khối di căn. |
||
| thêm | Hóa trị liệu trước phẫu thuật | |
| Các lựa chọn sơ cấp » oxaliplatin -và- » folinic acid -và- » fluorouracil HOẶC» irinotecan -và- » folinic acid -và- » fluorouracil HOẶC » oxaliplatin -và- » capecitabine » Hóa trị liệu trước phẫu thuật bao gồm FOLFOX (oxaliplatin, axit folinic và fluorouracil), FOLFIRI (irinotecan, axit folinic và fluorouracil), hoặc CapeOX (oxaliplatin và capecitabine) có hoặc không kèm bevacizumab. » Tham khảo hướng dẫn của chuyên gia khu vực để biết về hướng dẫn sử dụng liều. |
||
| bổ sung | Kháng thể đơn dòng | |
| Các lựa chọn sơ cấp » bevacizumab Các lựa chọn thứ cấp » cetuximab HOẶC » panitumumab » Bevacizumab có đặc tính kháng tạo mạch, thay đổi hệ mạch máu để cải thiện việc cung cấp hóa chất trị liệu cho tế bào ung thư, và có thể trực tiếp ức chế sự tăng trưởng phụ thuộc vào yếu tố tăng trưởng nội mạc mạch máu của tế bào ung thư. » Cetuximab and panitumumab are antibodies directed against the epidermal growth factor receptor and are effective when combined with irinotecan- or oxaliplatin-containing regimens in the first line in patients whose tumours do not have a KRAS or NRAS exon 2, 3, or 4 mutation. Luôn phải đánh giá điều này trước khi bắt đầu điều trị bằng panitumumab hoặc cetuximab. Những chất chỉ điểm này không liên quan đến bevacizumab.[191] » Tham khảo hướng dẫn của chuyên gia khu vực để biết về hướng dẫn sử dụng liều. |
||
| 1 | Phẫu thuật cắt bỏ tức thì | |
| » Khối u giai đoạn IV là T bất kỳ, N bất kỳ, M1.
» Phẫu thuật tức thì không chờ điều trị hỗ trợ và sau đó là cắt bỏ, có thể là biện pháp phù hợp hơn ở bệnh nhân mắc ung thư đại tràng và di căn đến gan hoặc phổi có nguy cơ thấp (phù hợp về y tế, có 4 tổn thương trở xuống, ảnh hưởng đến một hoặc hai thùy)[195] |
||
| thêm | Hóa trị liệu sau phẫu thuật | |
| Các lựa chọn sơ cấp » folinic acid -và- » fluorouracil HOẶC » capecitabine HOẶC » oxaliplatin -và- » folinic acid -và- » fluorouracil HOẶC » irinotecan -và- » folinic acid -và- » fluorouracil HOẶC » oxaliplatin -và- » capecitabine » Hóa trị liệu sau phẫu thuật, có thể bao gồm fluorouracil, capecitabine, FOLFOX (oxaliplatin, axit folinic và fluorouracil), FOLFIRI (irinotecan, axit folinic và fluorouracil), hoặc CapeOX (oxaliplatin và capecitabine), được sử dụng trong 4 đến 6 tháng sau phẫu thuật. » Tham khảo hướng dẫn của chuyên gia khu vực để biết về hướng dẫn sử dụng liều. |
||
| thêm | Kháng thể đơn dòng | |
| Các lựa chọn sơ cấp » bevacizumab Các lựa chọn thứ cấp» cetuximab HOẶC » panitumumab » Bevacizumab có đặc tính kháng tạo mạch, thay đổi hệ mạch máu để’ cải thiện việc cung cấp hóa chất trị liệu cho tế bào ung thư, và có thể’ trực tiếp ức chế sự tăng trưởng phụ thuộc vào yếu tố tăng trưởng nội mạc mạch máu của tế bào ung thư. » Cetuximab and panitumumab are antibodies directed against the epidermal growth factor receptor and are effective when combined with irinotecan- or oxaliplatin-containing regimens in the first line in patients whose tumours do not have a KRAS or NRAS exon 2, 3, or 4 mutation. Luôn phải đánh giá điều này trước khi bắt đầu điều trị bằng panitumumab hoặc cetuximab.[172] [196] [170] Những chất chỉ điểm này không liên quan đến bevacizumab.[191] » Tham khảo hướng dẫn của chuyên gia khu vực để’ biết về hướng dẫn sử dụng liều. |
||
| Ung thư đại tràng, không phù hợp để phẫu thuật | ||
|
1 | Hóa trị liệu |
| Các lựa chọn sơ cấp » oxaliplatin -vଠ» folinic acid -vଠ» fluorouracil HOẶC » irinotecan -vଠ» folinic acid -vଠ» fluorouracil HOẶC» capecitabine -và- » oxaliplatin HOẶC » fluorouracil -và-» folinic acid HOẶC » capecitabine » Khối u giai đoạn I là T1-2, N0, M0; khối u giai đoạn II-III là T3-4, N0, M0 đến T bất kỳ, N1-2, M0. Khối u giai đoạn IV là T bất kỳ, N bất kỳ, M1. » Hóa trị liệu hàng đầu, FOLFOX (oxaliplatin, axit folinic và fluorouracil) và FOLFIRI (irinotecan, axit folinic và fluorouracil) có hiệu quả tương tự nhau. Có thể ưu tiên dùng FOLFIRI nếu có bệnh lý thần kinh có trước đó vì khả năng gây độc thần kinh của oxaliplatin. Hướng dẫn NCCN cũng khuyến cáo thay thế fluorouracil/axit folinic bằng capecitabine (CapeOX). Kết hợp fluoropyrimidine (fluorouracil hoặc capecitabine) cùng với oxaliplatin và kết hợp với fluorouracil/axit folinic cùng với irinotecan cho thấy hiệu quả nhiều hơn so với fluoropyrimidine đơn chất, và có thể chỉ định cho bệnh nhân cao tuổi.[187] » Đối với những bệnh nhân không phù hợp với điều trị tăng cường, fluorouracil/axit folinic hoặc capecitabine có thể là lựa chọn phù hợp. » Hóa trị liệu thành từng đợt hay liên tục vẫn còn là vấn đề gây tranh cãi.[178] [188] |
||
| thêm | Kháng thể đơn dòng | |
| Các lựa chọn sơ cấp » bevacizumab Các lựa chọn thứ cấp » cetuximab HOẶC » panitumumab » Bổ sung bevacizumab vào các phác đồ này làm tăng tỷ lệ đáp ứng của khối u, kéo dài thời gian trước khi bệnh tiến triển cũng như kéo dài thời gian sống sót thêm từ 2 đến 6 tháng.[189] [163] » Cetuximab and panitumumab are antibodies directed against the epidermal growth factor receptor and are effective when combined with irinotecan- or oxaliplatin-containing regimens in the first line in patients whose tumours do not have a KRAS or NRAS exon 2, 3, or 4 mutation. Luôn phải đánh giá điều này trước khi bắt đầu điều trị bằng panitumumab hoặc cetuximab.[172] [196] [170] Những chất chỉ điểm này không liên quan đến bevacizumab.[191]» Tại Anh, Viện Y tế và Chăm sóc Quốc gia (NICE) đã kết luận rằng bevacizumab không được coi là chi phí hiệu quả khi kết hợp với hóa trị liệu như biện pháp điều trị bậc một đối với bệnh ung thư đại trực tràng di căn,[186] nhưng cetuximab có thể dùng như phác đồ bậc một iiính đến chi phí – hiệu quả[192] » Tham khảo hướng dẫn của chuyên gia khu vực để biết về hướng dẫn sử dụng liều. |
||
| bổ sung | Đặt cầu nối | |
| » Đặt cầu nối có thể phù hợp ở một số bệnh nhân khối u tắc nghẽn đại tràng sigma. | ||
| 2 | Phác đồ hóa trị liệu thay thế | |
| Các lựa chọn sơ cấp » irinotecan -và- » folinic acid -và- » fluorouracil HOẶC » irinotecan -và- » folinic acid -và- » fluorouracil –VÀ– » bevacizumab -hoặc- » aflibercept -hoặc- » ramucirumab -hoặc- » cetuximab -hoặc- » panitumumab HOẶC » cetuximab HOẶC » panitumumab HOẶC » oxaliplatin -và- » folinic acid -và-» fluorouracil HOẶC » oxaliplatin -và- » folinic acid -và- » fluorouracil –VÀ– » bevacizumab -hoặc- » cetuximab -hoặc- » panitumumab HOẶC » oxaliplatin -và- » capecitabine HOẶC » oxaliplatin -và- » capecitabine –VÀ– » bevacizumab -hoặc- » cetuximab -hoặc- » panitumumab » Khối u giai đoạn I là T1-2, N0, M0; khối u giai đoạn II-III là T3-4, N0, M0 đến T bất kỳ, N1-2, M0. Khối u giai đoạn IV là T bất kỳ, N bất kỳ, M1. » Ở những bệnh nhân được xem là không phù hợp để phẫu thuật, không thể xác định chính xác giai đoạn của khối u. Như vậy, tất cả điều trị đều là giảm nhẹ và có thể tạo cầu nối cho khối u tắc nghẽn. » Lựa chọn điều trị cho những bệnh nhân này nếu bệnh tiến triển khi áp dụng liệu pháp ban đầu dựa trên FOLFOX hoặc CapeOX bao gồm FOLFIRI kèm hoặc không kèm bevacizumab, aflibercept hoặc ramucirumab ở tất cả bệnh nhân hoặc ở bệnh nhân có KRAS và NRAS loại tự nhiên là chỉ cetuximab hoặc panitumumab hoặc kết hợp với FOLFIRI.[193] [194] [170] [172] » Có thể xem xét FOLFOX hoặc CapeOX kèm hoặc không kèm bevacizumab ở những bệnh nhân được điều trị ban đầu bằng phác đồ FOLFIRI thậm chí ngay cả khi đã sử dụng bevacizumab như liệu pháp hàng đầu. Ở những bệnh nhân có gen KRAS hoặc NRAS loại tự nhiên, có thể xem xét FOLFOX hoặc CapeOx kết hợp với cetuximab hoặc panitumumab, hoặc cetuximab hoặc panitumumab đơn chất ở bệnh nhân được điều trị lần đầu bằng phác đồ dựa trên FOLFIRI.[185] » Tham khảo hướng dẫn của chuyên gia khu vực để biết về hướng dẫn sử dụng liều. |
||
| bổ sung | Đặt cầu nối | |
| » Đặt cầu nối có thể phù hợp ở một số bệnh nhân khối u tắc nghẽn đại tràng sigma. | ||
Giai đoạn đầu
T rifluridine/tipiracil
Trifluridine/tipiracil (cũng được biết đến là TAS-102) là thuốc kết hợp dùng đường uống chứa trifluridine, chất tương tự axit nucleic dựa trên thymidine hoạt động như thành phần gây độc tế bào của thuốc, và tipiracil, chất ức chế thymidine phosphorylase ngăn chặn việc phá vỡ trifluridine nhanh chóng. Trong thử nghiệm đối chứng giả dược, ngẫu nhiên giai đoạn III, trifluridine/tipiracil đã cho thấy tăng thời gian sống sót 1,6 tháng ở những bệnh nhân tiến triển đã sử dụng ít nhất hai phác đồ hóa trị liệu trước đó.[197] Điều này dẫn đến chấp thuận sử dụng trifluridine/tipiracil ở những bệnh nhân ung thư đại trực tràng di căn đã dùng fluoropyrimidine, oxaliplatin, irinotecan, ít nhất một chất ức chế VEGF và một chất ức chế EGFR nếu lRAS loại tự nhiên.
Vi cầu gắn đồng vị phóng xạ
Hình cầu rỗng, thường làm bằng protein phân hủy sinh học chứa Yttrium-90, được sử dụng trong thủ thuật điện quang can thiệp, được biết như liệu pháp xạ trị chiếu trong chọn lọc hoặc nghẽn mạch phóng xạ, nhắm các liều xạ trị cao trực tiếp vào khối di căn gan không thể cắt bỏ. Năm nghiên cứu ung thư đại trực tràng cho kết quả không giống nhau. Trong khi một số nghiên cứu cho thấy lợi ích là thời gian sống không có tiến triển bệnh và thời gian sống sót chung cuộc, các nghiên cứu khác lại chỉ ra không cải thiện tiến triển bệnh hoặc thời gian sống sót.[198] [199] [200] [201] [202] Các thử nghiệm khác về ung thư đại trực tràng đang được tiến hành.[198]
Chất ức chế kháng PD1
Pembrolizumab và nivolumab là các chất ức chế kháng thể kháng PD1. Chúng tác động bằng cách phong bế con đường dung nạp khối u.[203] Pembrolizumab và nivolumab đã được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) chấp thuận cao để điều trị bệnh nhân có khối u rắn không thể cắt bỏ hoặc di căn đã được xác định là có dấu ấn sinh học được gọi là bất ổn vi vệ tinh cao (MSI-H) hoặc thiếu khả năng sửa chữa ghép cặp sai (dMMR).[204] Những chấp thuận này là độc nhất vì chúng đánh dấu lần đầu tiên FDA chấp thuận cho điều trị ung thư dựa trên sự hiện diện của dấu ấn sinh học khối u chứ không phải là vị trí khối u trong cơ thể. Các thử nghiệm giai đoạn I và II về tính hiệu quả của pembrolizumab và nivolumab đối với bệnh ung thư đại trực tràng hiện đang được tiến hành.[205] [206] [207] [208] [209]
Liên lạc theo dõi
Khuyến nghị
Giám sát
Theo dõi bệnh nhân ung thư đại tràng và trực tràng đã điều trị là như nhau. Mục đích của theo dõi là giám sát các biến chứng liên quan đến điều trị, phát hiện bệnh tái phát ở vị trí nguyên phát, phát hiện và loại bỏ polyp đại trực tràng mới, và giám sát di căn có thể cắt bỏ ở những bệnh nhân phù hợp.
Hướng dẫn của Mạng lưới Ung thư Toàn diện Quốc gia khuyến cáo đánh giá lâm sàng bệnh nhân mỗi 3 đến 6 tháng một lần trong 2 năm đầu và sau đó là hàng năm cho đến 5 năm sau điều trị.((National Comprehensive Cancer Network. Clinical practice guidelines in oncology: rectal cancer. 2017. http:// www.nccn.org (last accessed 19 July 2017).)) ((National Comprehensive Cancer Network. Clinical practice guidelines in oncology: colon cancer. 2017. http:// www.nccn.org (last accessed 19 July 2017).)) ((Meyerhardt JA, Mangu PB, Flynn PJ, et al; American Society of Clinical Oncology. Follow-up care, surveillance protocol, and secondary prevention measures for survivors of colorectal cancer: American Society of Clinical Oncology clinical practice guideline endorsement. J Clin Oncol. 2013;31:4465-4470. Toàn văn Tóm lược)) ((Glynne-Jones L, Wyrwicz E, Tiret G, et al. Rectal cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28(suppl 4):iv22-iv40. Toàn văn)) ((Primrose JN, Perera R, Gray A, et al; FACS Trial Investigators. Effect of 3 to 5 years of scheduled CEA and CT follow-up to detect recurrence of colorectal cancer: the FACS randomized clinical trial. JAMA. 2014;311:263-270. Toàn văn Tóm lược)) Đối với ung thư giai đoạn I, cần thực hiện nội soi đại tràng 1 năm sau phẫu thuật, lặp lại sau 3 năm và một lần nữa sau 5 năm. Đối với ung thư giai đoạn II và III, khuyến cáo nên kết hợp khám lâm sàng và tiền sử, kháng nguyên ung thư biểu mô bào thai (carcinoembryonic), CT và nội soi đại tràng ở các khoảng thời gian khác nhau.((National Comprehensive Cancer Network. Clinical practice guidelines in oncology: rectal cancer. 2017. http:// www.nccn.org (last accessed 19 July 2017).)) ((National Comprehensive Cancer Network. Clinical practice guidelines in oncology: colon cancer. 2017. http:// www.nccn.org (last accessed 19 July 2017).)) ((Meyerhardt JA, Mangu PB, Flynn PJ, et al; American Society of Clinical Oncology. Follow-up care, surveillance protocol, and secondary prevention measures for survivors of colorectal cancer: American Society of Clinical Oncology clinical practice guideline endorsement. J Clin Oncol. 2013;31:4465-4470. Toàn văn Tóm lược)) ((Glynne-Jones L, Wyrwicz E, Tiret G, et al. Rectal cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28(suppl 4):iv22-iv40. Toàn văn)) ((Primrose JN, Perera R, Gray A, et al; FACS Trial Investigators. Effect of 3 to 5 years of scheduled CEA and CT follow-up to detect recurrence of colorectal cancer: the FACS randomized clinical trial. JAMA. 2014;311:263-270. Toàn văn Tóm lược))
Hướng dẫn dành cho bệnh nhân
Các biến chứng
| Các biến chứng | Khung thời gian | Khả năng |
| Ức chế tủy xương do hóa trị liệu | ngắn hạn | cao |
| Giảm bạch cầu trung tính, giảm tiểu cầu và thiếu máu có thể gặp trong hóa trị liệu điều trị ung thư đại trực tràng. Xử trí bằng cách tạm ngừng dùng thuốc và điều trị hỗ trợ cho đến khi phục hồi chức năng tủy xương. | ||
| Độc gan liên quan đến oxaliplatin | ngắn hạn | cao |
| Tăng men gan trong huyết thanh thường gặp trong điều trị. Hiếm gặp, có bằng chứng về bệnh tắc nghẽn tĩnh mạch gan biểu hiện bằng HTN (tăng áp lực) tĩnh mạch cửa hoặc xét nghiệm sinh hóa gan bất thường kéo dài . | ||
| Triệu chứng đường tiêu hóa liên quan đến hóa trị liệu (tiêu chảy, buồn nôn, nôn, đau bụng) | ngắn hạn | cao |
| Thường xảy ra với các tác nhân hóa trị liệu. Điều trị triệu chứng với loperamide, thuốc chống nôn mửa và thuốc giảm đau. | ||
| Rụng tóc liên quan đến hóa trị liệu | ngắn hạn | cao |
| Tác dụng bất lợi của hóa trị liệu. | ||
| Phát ban liên quan đến cetuximab | dài hạn | cao |
| Phát ban dạng trứng cá rất thường gặp và đặc biệt xảy ra trên mặt và thân trên. Tình trạng này thường cải thiện khi tiếp tục điều trị và có thể khỏi. Liên quan đến tăng cơ hội đáp ứng điều trị và độc lập với tình trạng K-RAS. | ||
| Đại tiện không tự chủ liên quan đến xạ trị | dài hạn | cao |
| Phân lỏng, mót đại tiện và mất tự chủ đại tiệnhường gặp sau khi xạ trị ung thư trực tràng. | ||
| Rối loạn chức năng bàng quang sau khi cắt bỏ trực tràng | dài hạn | thấp |
| Rối loạn chức năng bàng quang xảy ra do tổn thương dây thần kinh vùng chậu trong phẫu thuật ung thư trực tràng.
Các triệu chứng có thể bao gồm tiểu gấp, tiểu không tự chủ và bí tiểu. Đôi khi có thể cần đặt ống thông tiểu để giảm bí tiểu. |
||
| Rối loạn chức năng cương dương sau khi cắt bỏ trực tràng | dài hạn | thấp |
| Rối loạn chức năng cương dương có thể xảy ra do tổn thương dây thần kinh vùng chậu. | ||
| Hội chứng cắt bỏ trước thấp sau khi cắt bỏ phía trước | dài hạn | thấp |
| Hội chứng cắt bỏ trước thấp bao gồm các triệu chứng như tiểu tiện không tự chủ hoặc tiểu gấp, và tiểu không hết, có thể xảy ra sau khi cắt bỏ trực tràng đoạn dưới. | ||
| Xơ phổi liên quan đến oxaliplatin | dài hạn | thấp |
| Xơ phổi xảy ra ở <1% bệnh nhân và có biểu hiện ho khan, khó thở, tiếng ran đáy phổi và hình ảnh thâm nhiễm phổi trên chụp CXR hoặc CT ngực. | ||
| Bệnh lý thần kinh liên quan đến oxaliplatin | biến thiên | cao |
| Độc thần kinh là tác dụng phụ phổ biến của oxaliplatin, thường biểu hiện dưới dạng bệnh lý thần kinh ngoại biên. Bệnh có 2 dạng: cấp tính và mạn tính. Dạng cấp tính phát triển ở >90% bệnh nhân và có thể bắt đầu trong hoặc ngay sau vài liều thuốc đầu tiên. Các triệu chứng bao gồm dị cảm và rối loạn cảm giác bàn tay, bàn chân và vùng quanh miệng và có thể nặng hơn khi trời lạnh. Bệnh tự khỏi.
Dạng mạn tính là bệnh lý thần kinh sợi trục cảm giác lũy tích và có thể liều giới hạn Bệnh lý thần kinh có thể khỏi ở hầu hết các bệnh nhân sau khi ngừng điều trị. Không can thiệp nào đã được chứng minh là có thể ngăn ngừa được độc tính thần kinh. |
||
Tiên lượng
Đã có ghi chép về tăng thời gian sống sót ở những bệnh nhân bị ung thư đại trực tràng. Cải thiện này là nhờ kỹ thuật phẫu thuật, tăng sử dụng liệu pháp tân hỗ trợ và hỗ trợ, và tầm soát các cá nhân không có triệu chứng.
Tiên lượng ung thư đại trực tràng phụ thuộc vào giai đoạn bệnh tại thời điểm chẩn đoán. Khoảng một nửa bệnh nhân biểu hiện các triệu chứng có bệnh tiến triển cục bộ (giai đoạn III) hoặc di căn (giai đoạn IV) khi chẩn đoán.[80] [81] [210] Ngược lại, ung thư được phát hiện nhờ tầm soát thường là ở giai đoạn đầu (hầu hết ở giai đoạn I đến II).[80] [81] Tỷ lệ sống sót của ung thư trực tràng cũng khác nhau theo từng quốc gia. Tại châu Âu, tỷ lệ sống sót sau 5 năm đối với ung thư đại tràng ở Anh , Đan Mạch và các quốc gia Đông Âu thấp hơn so với tỷ lệ trung bình ở châu Âu là khoảng 50%.[211] Phân tích dữ liệu của EUROCARE gợi ý rằng thời gian sống sót ngắn hơn tại Anh là do biểu hiện và chẩn đoán ở giai đoạn muộn chứ không phải điều trị kém ở cùng giai đoạn.[212]
Nói chung, tỷ lệ sống sau 5 năm đối với ung thư đại trực tràng là 93% đến 97% đối với bệnh giai đoạn I, 72% đến 85% đối với bệnh giai đoạn II, 44% đến 83% (tùy thuộc vào tổn thương hạch) ở giai đoạn III và <8% ở giai đoạn IV.[213] [214]
Ca lâm sàng
Bệnh sử
Bệnh nhân nữ 66 tuổi, là điều dưỡng đã về hưu, đến nhờ tư vấn bác sĩ đa khoa của cô do cảm giác mệt mỏi 4 tháng nay, hơi khó thở khi gắng sức và sụt cân từ 71kg xuống còn 65kg. Bệnh nhân ăn uống bình thường, không buồn nôn hay nôn ói, nhưng cách đây 2 tháng bệnh nhân thay đổi thói quen đi tiêu với táo bón xen kẽ các lần đi tiêu bình thường. Bệnh nhân không thấy máu trong phân và không đau bụng. Bệnh nhân không chảy máu sau mãn kinh. Tiền sử gia đình bình thường, bệnh nhân hiện không uống bất kỳ thuốc gì.
Bệnh nhân hút 20 điếu thuốc mỗi ngày trong suốt 48 năm và uống 20-28 đơn vị rượu một tuần.
Khám lâm sàng
Bệnh nhân khá xanh xao nhưng nhìn chung vẫn khỏe. Không phát hiện bệnh lý hạch bạch huyết. Khám vú, tuyến giáp, tim, ngực, bụng, thăm trực tràng đều bình thường. Huyết áp 148/90 mmHg.
Cận lâm sàng
| Bình thường | ||
| Haemoglobin
Thể tích trung bình hồng cầu (MCV) Số lượng bạch cầu Số lượng tiểu cầu Natri Kali Creatinine |
10.1 g/dL
76 fL 4.9 X 109/L 277 X 109/L 142 mmol/L 4.4 mmol/L 5.2 mmol/L 106 pmol/L |
11.7-15.7g/dL
80-99fL 3.5-11.0 X 109/L 150-440 X 109/L 135-145mmol/L 3.5-5.0 mmol/L 2.5-6.7 mmol/L 70-120 pmol/L |
Tổng phân tích nước tiểu: không protein, không máu.
Màng mỏng phết máu cho thấy hình ảnh hồng cầu nhỏ (microcytic), nhược sắc ( hypochromic).
Câu hỏi
- Chẩn đoán phù hợp nhất là gì?
- Điều trị bệnh nhân bằng cách nào?
Trả lời
Công thức máu cho thấy thiếu máu hồng cầu nhỏ, nhược sắc. Ở phụ nữ tiền mãn kinh, nguyên nhân thiếu máu phổ biến nhất là do mất máu quá nhiều trong chu kỳ kinh nguyệt. Ở đàn ông và phụ nữ sau mãn kinh, nguyên nhân thiếu máu phổ biến nhất là xuất huyết tiêu hóa. Bệnh nhân này thay đổi thói quen đi tiêu, gợi ý bệnh lý đường tiêu hóa dưới, chẩn đoán ung thư biểu mô đại tràng sẽ giải thích lý do sụt cân. Thụt batrium cho thấy một khối tăng sinh trong đại tràng sigma, chẩn đoán xác định nhờ nội soi đại tràng và sinh thiết. Chụp Xquang ngực và siêu âm bụng lần lượt không thấy di căn phổi và không phù hạch bạch huyết trong ổ bụng hoặc di căn gan.
Bệnh nhân được cắt đại tràng sigma và nối tận-tận, thường xuyên theo dõi nhằm phát hiện bất kỳ bằng chứng tái phát nào. Mô phôi học cho thấy u độ I.
Ung thư biểu mô đại tràng có tần suất tăng dần. Nếu xuất hiện trong giai đoạn sớm, thì tiên lượng chữa khỏi khá tốt. Chảy máu trực tràng, thay đổi thói quen đi tiêu hơn 1 tháng trong bất kỳ giai đoạn nào hoặc thiếu máu thiếu sắt ở đàn ông hay phụ nữ sau mãn kinh đều là các dấu hiệu bệnh đường tiêu hóa. Ở người trẻ tuổi, có thể một yếu tố di truyền sẽ gây ung thư biểu mô đại tràng.
Hút thuốc lá là yếu tố nguy cơ ung thư biểu mô đại tràng.
Ý chính
- Ung thư biểu mô đại tràng có thể biểu hiện vài triệu chứng hoặc thậm chí không có trên đường tiêu hóa.
- Thiếu máu thiếu sắt không giải thích được phải khám kỹ đường tiêu hóa trên và dưới.
Hướng dẫn
Hướng dẫn chẩn đoán
Châu Âu
Rectal cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up
Nhà xuất bản: European Society for Medical Oncology
Xuất bản lần cuối: 2017
Bowel cancer screening
Nhà xuất bản: Public Health England
Xuất bản lần cuối: 2017
Quantitative faecal immunochemical tests to guide referral for colorectal cancer in primary care
Diagnosis and management of colorectal cancer: a national clinical guideline
Colorectal cancer: the diagnosis and management of colorectal cancer
Nhà xuất bản: National Institute for Health and Care Excellence
Xuất bản lần cuối: 2014
Familial risk-colorectal cancer: ESMO clinical practice guidelines
Nhà xuất bản: European Society for Medical Oncology
Xuất bản lần cuối: 2013
Early colon cancer: ESMO clinical practice guidelines
Nhà xuất bản: European Society for Medical Oncology
Xuất bản lần cuối: 2013
European guidelines for quality assurance in colorectal cancer screening and diagnosis. First
edition: colonoscopic surveillance following adenoma removal Nhà xuất bản: International Agency for Research on Cancer, Health Programme of the European Union
Xuất bản lần cuối: 2012
Brain metastases
Nhà xuất bản: European Federation of Neurological Societies
Xuất bản lần cuối: 2011
Guidelines for colorectal cancer screening and surveillance in moderate and high risk groups
Nhà xuất bản: British Society of Gastroenterology; Association of Coloproctology for Great Britain and Ireland
Xuất bản lần cuối: 2010
Guidelines for the management of colorectal cancer, 3rd ed Nhà xuất bản: Association of Coloproctology of Great Britain and Ireland
Xuất bản lần cuối: 2007
Bắc Mỹ
NCCN clinical practice guidelines in oncology: colorectal cancer screening
Nhà xuất bản: National Comprehensive Cancer Network
Xuất bản lần cuối: 2017
NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: colorectal
Nhà xuất bản: National Comprehensive Cancer Network
Xuất bản lần cuối: 2017
Screening for colorectal cancer: US Preventive Services Task Force recommendation statement
Nhà xuất bản: US Preventive Services Task Force
Xuất bản lần cuối: 2016
Bowel preparation before colonoscopy
Nhà xuất bản: American Society for Gastrointestinal Endoscopy
Xuất bản lần cuối: 2015
The role of endoscopy in the patient with lower GI bleeding
Nhà xuất bản: American Society for Gastrointestinal Endoscopy
Xuất bản lần cuối: 2014
Practice parameters for the management of rectal cancer (revised)
Nhà xuất bản: American Society of Colon and Rectal Surgeons
Xuất bản lần cuối: 2013
Screening for colorectal cancer: a guidance statement from the American College of Physicians
Nhà xuất bản: American College of Physicians
Xuất bản lần cuối: 2012
Screening and surveillance for the early detection of colorectal cancer and adenomatous polyps, 2008
Nhà xuất bản: American Cancer Society; US Multi-Society Task Force on
Xuất bản lần cuối: 2008 Colorectal Cancer; American College of Radiology
Practice parameter for the detection of colorectal neoplasms: an interim report (revised)
Nhà xuất bản: American Society of Colon and Rectal Surgeons
Xuất bản lần cuối: 2006
ASCO 2006 update of recommendations for the use of tumor markers in gastrointestinal cancer
Nhà xuất bản: American Society of Clinical Oncology
Xuất bản lần cuối: 2006
Revised Bethesda guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability
Nhà xuất bản: National Cancer Institute
Xuất bản lần cuối: 2004
AGA technical review on hereditary colorectal cancer and genetic testing
Nhà xuất bản: American Gastroenterology Association
Xuất bản lần cuối: 2001
Hướng dẫn điều trị
Châu Âu
Rectal cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up
Nhà xuất bản: European Society for Medical Oncology
Xuất bản lần cuối: 2017
ESMO consensus guidelines for management of patients w
ith colon and rectal cancer
Nhà xuất bản: European Society for Medical Oncology
Xuất bản lần cuối: 2016
Diagnosis and management of colorectal cancer: a national clinical guideline
Nhà xuất bản: Scottish Intercollegiate Guidelines Network
Xuất bản lần cuối: 2016
Guidelines for diagnosis and treatment of metastatic colorectal cancer
Colorectal cancer: the diagnosis and management of colorectal cancer
Erythropoiesis-stimulating agents (epoetin and darbepoetin) for treating anaemia in people
with cancer having chemotherapy (including review of TA142)
Nhà xuất bản: National Institute for Health and Care Excellence
Xuất bản lần cuối: 2014
Metastatic colorectal cancer: ESMO clinical practice guidelines for treatment
Nhà xuất bản: European Society for Medical Oncology
Xuất bản lần cuối: 2014
Early colon cancer: ESMO clinical practice guidelines
Nhà xuất bản: European Society for Medical Oncology
Xuất bản lần cuối: 2013
Familial risk-colorectal cancer: ESMO clinical practice guidelines
Nhà xuất bản: European Society for Medical Oncology
Xuất bản lần cuối: 2013
Bevacizumab and cetuximab for the treatment of metastatic colorectal cancer
Nhà xuất bản: National Institute for Health and Care Excellence
Xuất bản lần cuối: 2012
Microwave ablation for the treatment of metastases in the liver
Nhà xuất bản: National Institute for Health and Care Evidence
Xuất bản lần cuối: 2011
Brain metastases
Nhà xuất bản: European Federation of Neurological Societies
Xuất bản lần cuối: 2011
Primary colon cancer: ESMO clinical practice guidelines for diagnosis, adjuvant treatment
and follow-up
Nhà xuất bản: European Society for Medical Oncology
Xuất bản lần cuối: 2010
Châu Âu
Radiofrequency ablation for the treatment of colorectal liver metastases
Nhà xuất bản: National Institute for Health and Care Excellence
Xuất bản lần cuối: 2009
Cetuximab for the first line treatment of metastatic colorectal cancer
Nhà xuất bản: National Institute for Health and Care Excellence Xuất bản lần cuối: 2009
Guidelines for the management of colorectal cancer, 3rd ed Nhà xuất bản: Association of Coloproctology of Great Britain and Ireland
Xuất bản lần cuối: 2007
Laparoscopic surgery for colorectal cancer
Nhà xuất bản: National Institute for Health and Care Excellence
Xuất bản lần cuối: 2006
Guidelines for resection of colorectal cancer liver metastases
Capecitabine and oxaliplatin in the adjuvant treatment of stage III (Dukes’ C) colon cancer
Clinical effectiveness and cost-effectiveness of laparoscopic surgery for colorectal cancer:
systematic reviews and economic evaluation
Nhà xuất bản: Health Technology Assessment NHS R&D HTA Programme
Xuất bản lần cuối: 2006
The clinical and cost-effectiveness of oxaliplatin and capecitabine for the adjuvant treatment
of colon cancer: systematic review and economic evaluation Nhà xuất bản: Health Technology Assessment NHS R&D HTA Programme
Xuất bản lần cuối: 2006
Bắc Mỹ
NCCN clinical practice guidelines in oncology: rectal cancer Nhà xuất bản: National Comprehensive Cancer Network
Xuất bản lần cuối: 2017
NCCN clinical practice guidelines in oncology: colon cancer Nhà xuất bản: National Comprehensive Cancer Network
Xuất bản lần cuối: 2017
Colonoscopy surveillance after colorectal cancer resection Nhà xuất bản: American College of Gastroenterology
Xuất bản lần cuối: 2016
Bowel preparation before colonoscopy
Nhà xuất bản: American Society for Gastrointestinal Endoscopy
Xuất bản lần cuối: 2015
Practice guideline for the surveillance of patients after curative treatment of colon and rectal cancer
Nhà xuất bản: American Society of Colon and Rectal Surgeons
Xuất bản lần cuối: 2015
Colorectal cancer survivorship care guidelines Nhà xuất bản: American Cancer Society Xuất bản lần cuối: 2015
Guideline on the diagnosis and management of Lynch syndrome Nhà xuất bản: American Gastroenterological Association Institute
Xuất bản lần cuối: 2015
ACR appropriateness criteria: multiple brain metastases Nhà xuất bản: American College of Radiology
Xuất bản lần cuối: 2014
ACR appropriateness criteria: follow-up and retreatment of brain metastases
Practice parameters for the management of rectal cancer (revised)
Guidelines for laparoscopic resection of curable colon and rectal cancer
Nhà xuất bản: Society of American Gastrointestinal and Endoscopic Surgeons
Xuất bản lần cuối: 2012
Clinical practice guideline update: use of chemotherapy and radiation therapy protectants
Nhà xuất bản: American Society of Clinical Oncology
Xuất bản lần cuối: 2009
Nutrition and physical activity during and after cancer treatment: an American Cancer
Society guide for informed choices Nhà xuất bản: American Cancer Society
Xuất bản lần cuối: 2006
ASCO 2006 update of recommendations for the use of tumor markers in gastrointestinal cancer
Nhà xuất bản: American Society of Clinical Oncology
Xuất bản lần cuối: 2006
Các bài báo chủ yếu
- Thorne K, Hutchings HA, Elwyn G. The effects of the two-week rule on NHS colorectal cancer diagnostic services: a systematic literature review. BMC Health Serv Res. 2006;6:43-47. Toàn văn Tóm lược
- Howlader N, Noone AM, Krapcho M, et al; National Cancer Institute. SEER Cancer statistics review, 1975-2008. 2011. http://seer.cancer.gov (last accessed 19 July 2017). Toàn văn
- Anderson C, Uman G, Pigazzi A. Oncologic outcomes of laparoscopic surgery for rectal cancer: a systematic review and meta-analysis of the literature. Eur J Surg Oncol. 2008;34:1135-1142. Tóm lược
- Fiorica F, Cartei F, Licata A, et al. Can chemotherapy concomitantly delivered with radiotherapy improve survival of patients with resectable rectal cancer? A meta-analysis of literature data. Cancer Treat Rev. 2010;36:539-549. Tóm lược
- Tiv M, Puyraveau M, Mineur L, et al. Long-term quality of life in patients with rectal cancer treated with preoperative (chemo)-radiotherapy within a randomized trial. Cancer Radiother. 2010;14:530-534. Tóm lược
- Gérard JP, Azria D, Gourgou-Bourgade S, et al. Comparison of two neoadjuvant chemoradiotherapy regimens for locally advanced rectal cancer: results of the phase III trial ACCORD 12/0405-Prodige 2. J Clin Oncol. 2010;28:1638-1644. Tóm lược
- Pettersson D, Cedermark B, Holm T, et al. Interim analysis of the Stockholm III trial of preoperative radiotherapy regimens for rectal cancer. Br J Surg. 2010;97:580-587. Tóm lược
- National Institute for Health and Care Excellence. Colorectal cancer: the diagnosis and management of colorectal cancer. December 2014. http://guidance.nice.org.uk (last accessed 19 July 2017). Toàn văn
- Bujko K, Glynne-Jones R, Bujko M. Does adjuvant fluoropyrimidine-based chemotherapy provide a benefit for patients with resected rectal cancer who have already received neoadjuvant radiochemotherapy? A systematic review of randomised trials. Ann Oncol. 2010;21:1743-1750. Toàn văn Tóm lược
- Jones C, Badger SA, Ellis G. The role of microwave ablation in the management of hepatic colorectal metastases. Surgeon. 2011;9:33-37. Tóm lược
- Labianca R, Sobrero A, Isa L, et al; Italian Group for the Study of Gastrointestinal Cancer-GISCAD. Intermittent versus continuous chemotherapy in advanced colorectal cancer: a randomised ‘GISCAD’ trial. Ann Oncol. 2011;22:1236-1242. Tóm lược
- National Comprehensive Cancer Network. Clinical practice guidelines in oncology: rectal cancer. 2017. http:// www.nccn.org (last accessed 19 July 2017).
- National Comprehensive Cancer Network. Clinical practice guidelines in oncology: colon cancer. 2017. http:// www.nccn.org (last accessed 19 July 2017).
Câu hỏi lâm sàng
Bệnh nhân nam, 37 tuổi, đi khám vì khám sức khỏe định kỳ. Anh ấy khỏe mạnh và không có triệu chứng nào là đáng kể. Anh ta có tiền sử hút thuốc 30 gói.năm. Bệnh nhân không sử dụng rượu hoặc ma túy. Cha của anh được chẩn đoán mắc bệnh ung thư đại tràng ở tuổi 50 và được điều trị bằng phương pháp cắt bỏ đại tràng (colectomy). Anh cả của anh được chẩn đoán mắc bệnh ung thư phổi không tế bào nhỏ ở tuổi 50. Mẹ anh mắc bệnh Graves và ông ngoại của anh mắc bệnh động mạch vành. Xét nghiệm sàng lọc ban đầu nào sau đây là thích hợp nhất cho bệnh nhân này?
- Nội soi đại tràng ở tuổi 40
- Nội soi đại tràng ở tuổi 50
- Điện tâm đồ gắng sức
- CT scan ngực liều thấp
- Xét nghiệm tế bào học trong đàm
- Đo nồng độ Thyroid-stimulating hormone level
Bệnh nhân nam 37 tuổi, đi khám sức khỏe
- Khỏe mạnh
- Tiền căn:
- Cha: ung thư đại tràng năm 50 tuổi
- BN hút thuốc lá 30 gói.năm + anh bị ung thư tế bào không nhỏ
- Mẹ: bệnh Graves
- Ông ngoại: bệnh mạch vành
Hỏi: Xét nghiệm sàng lọc ban đầu nào sau đây là thích hợp nhất cho bệnh nhân này?
Đáp án: A: Nội soi đại tràng ở tuổi 40
The United States Preventive Services Task Force (USPSTF) khuyến khích mạnh mẽ việc sàng lọc ung thư đại tràng định kỳ ở tất cả bệnh nhân > 50 tuổi; ; the American Cancer Society khuyến nghị sàng lọc bắt đầu từ tuổi 45. Các phương pháp sàng lọc bao gồm:
- Xét nghiệm phân có độ nhạy cao (ví dụ: xét nghiệm tìm máu ẩn trong phân [FOBT] hoặc xét nghiệm hóa miễn dịch trong phân [fecal immunochemical testing – FIT] hàng năm)
- Các kỹ thuật quan sát trực tiếp (ví dụ: nội soi đại tràng 10 năm một lần, soi đại tràng sigma ống mềm 5 năm một lần).
- Kết hợp (ví dụ, soi đại tràng sigma ống mềm 10 năm một lần với FIT hàng năm).
Những chiến lược này làm giảm tỷ lệ tử vong do ung thư đại tràng. Nội soi đại tràng là xét nghiệm đặc hiệu và nhạy cảm nhất, nhưng cũng tốn kém nhất và phụ thuộc vào chuyên môn
Nội soi đại tràng ở tuổi 50 phù hợp với những bệnh nhân có nguy cơ ung thư đại tràng trung bình dựa trên các khuyến cáo của USPSTF (Lựa chọn B). Tuy nhiên, tiền sử gia đình của bệnh nhân này khiến anh ta có nguy cơ cao và anh ta cần được sàng lọc ở độ tuổi sớm hơn. Bệnh nhân có tiền sử ung thư đại tràng ở người thân cấp 1 nên được sàng lọc ở tuổi 40 hoặc 10 năm trước tuổi chẩn đoán của người thân (tùy theo thời điểm nào đến trước). Cha của bệnh nhân này được chẩn đoán mắc bệnh ung thư đại tràng ở tuổi 50 và anh ta nên bắt đầu tầm soát từ năm 40 tuổi.
(Lựa chọn C) Kiểm tra điện tâm đồ gắng sức là một xét nghiệm chẩn đoán hữu ích ở những bệnh nhân có nguy cơ mắc bệnh động mạch vành trung bình dựa trên các triệu chứng và yếu tố nguy cơ. Mặc dù bệnh nhân này có các yếu tố nguy cơ mắc bệnh động mạch vành, nhưng hiện tại anh ta không có triệu chứng và sẽ không có lợi khi đo điện tâm đồ gắng sức vào thời điểm này.
(Lựa chọn D và E) Bệnh nhân này có tiền sử hút thuốc nhiều và tiền sử gia đình mắc bệnh ung thư phổi có nguy cơ mắc ung thư phổi cao hơn. Xét nghiệm tế bào học trong đàm không sàng lọc hiệu quả ung thư phổi hoặc giảm tỷ lệ tử vong do căn bệnh này. CT ngực liều thấp được khuyến nghị hàng năm để sàng lọc ung thư phổi ở những bệnh nhân trong độ tuổi 55-80, có tiền sử hút thuốc >30 gói.năm và hiện đang hút hoặc bỏ thuốc trong vòng 15 năm qua. Bệnh nhân này có tiền sử dùng 30 gói.năm (ví dụ: 2 gói.ngày trong 15 năm), nhưng chỉ nên tầm soát ung thư phổi ở độ tuổi 55-80.
(Lựa chọn F) Các hướng dẫn của USPSTF kết luận rằng hiện tại không có đủ bằng chứng về việc sàng lọc bệnh tuyến giáp ở những bệnh nhân không có triệu chứng có tiền sử gia đình mắc bệnh tuyến giáp.
Kết luận:
Bệnh nhân có nguy cơ phát triển ung thư đại tràng trung bình nên bắt đầu sàng lọc ở tuổi 50 bằng xét nghiệm phân có độ nhạy cao hoặc kỹ thuật trực quan (ví dụ: nội soi đại tràng 10 năm một lần). Bệnh nhân có người thân cấp 1 bị bệnh nên bắt đầu sàng lọc ở tuổi 40 hoặc 10 năm trước tuổi chẩn đoán của người thân (tùy theo thời điểm nào đến trước).
Tài liệu tham khảo
- Toms JR, ed. CancerStats monograph 2004. London: Cancer Research; 2004.
- Aster VB, Coller FA. The prognostic significance of direct extension of carcinoma of the colon and rectum. Ann Surg. 1954;139:846-852. Tóm lược
- Edge S, Byrd DR, Compton CC, et al, eds; American Joint Committee on Cancer. AJCC Cancer Staging Manual. 7th ed. New York, NY: Springer; 2010.
- Thorne K, Hutchings HA, Elwyn G. The effects of the two-week rule on NHS colorectal cancer diagnostic services: a systematic literature review. BMC Health Serv Res. 2006;6:43-47. Toàn văn Tóm lược
- Howlader N, Noone AM, Krapcho M, et al; National Cancer Institute. SEER Cancer statistics review, 1975-2008. 2011. http://seer.cancer.gov (last accessed 19 July 2017). Toàn văn
- Cancer Research UK. Bowel cancer deaths drop by a third in 20 years. August 2017. http:// www.cancerresearchuk.org/ (last accessed 6 September 2017). Toàn văn
- US Cancer Statistics Working Group. United States cancer statistics: 1999-2014 incidence and mortality web-based report. 2017. https://nccd.cdc.gov/ (last accessed 13 July 2017). Toàn văn
- Fedewa SA, Flanders WD, Ward KC, et al. Racial and ethnic disparities in interval colorectal cancer incidence: a population-based cohort study. Ann Intern Med. 2017;166:857-866. Tóm lược
- American Cancer Society. Colorectal cancer facts & figures, 2017-2019. http://www.cancer.org/ (last accessed 25 July 2017). Toàn văn
- Matanoski G, Tao X, Almon L, et al. Cancer. Demographics and tumor characteristics of colorectal cancers in the United States, 1998-2001. 2006;107(5 Suppl):1112-1120. Toàn văn Tóm lược
- Dunlop MG. Guidance on large bowel surveillance for people with two first degree relatives with colorectal cancer or one first degree relative diagnosed with colorectal cancer under 45 years. Gut. 2002;51:17-20. Toàn văn Tóm lược
- Cancer Genome Atlas Network. Comprehensive molecular characterization of human colon and rectal cancer. Nature. 2012;487:330-337. Toàn văn Tóm lược
- Martinez ME, Giovannucci E, Spiegelman D, et al. Leisure-time physical activity, body size, and colon cancer in women. Nurses’ Health Study Research Group. J Natl Cancer Inst. 1997;89:948-955. Toàn văn Tóm lược
- Calle EE, Rodriguez C, Walker-Thurmond K, et al. Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults. N Engl J Med. 2003 Apr 24;348(17):1625-38. Toàn văn Tóm lược
- Mao Y, Pan S, Wen SW, et al. Physical inactivity, energy intake, obesity and the risk of rectal cancer in Canada. Int J Cancer. 2003;105:831-837. Tóm lược
- Wolin KY, Yan Y, Colditz GA, Lee IM. Physical activity and colon cancer prevention: a meta-analysis. Br J Cancer. 2009;100:611-616. Toàn văn Tóm lược
- Ferguson LR, Harris PJ. The dietary fibre debate: more food for thought. Lancet. 2003;361:1487-1488. Tóm lược
- Chao A, Thun MJ, Connell CJ, et al. Meat consumption and risk of colorectal cancer. JAMA. 2005;293:172-182. Toàn văn Tóm lược
- Norat T, Bingham S, Ferrari P, et al. Meat, fish, and colorectal cancer risk: the European Prospective Investigation into cancer and nutrition. J Natl Cancer Inst. 2005;97:906-916. Toàn văn Tóm lược
- Willett WC, Stampfer MJ, Colditz GA, et al. Relation of meat, fat, and fiber intake to the risk of colon cancer in a prospective study among women. N Engl J Med. 1990;323:1664-1672. Tóm lược
- Arnold CN, Goel A, Blum HE, et al. Molecular pathogenesis of colorectal cancer. Cancer. 2005;104:2035-2047. Toàn văn Tóm lược
- Sundermeyer ML, Meropol NJ, Rogatko A, et al. Changing patterns of bone and brain metastases in patients with colorectal cancer. Clin Colorectal Cancer. 2005;5:108-113. Tóm lược
- Petersen GM, Slack J, Nakamura Y. Screening guidelines and premorbid diagnosis of familial adenomatous polyposis using linkage. Gastroenterology. 1991;100:1658-1664. Tóm lược
- Vasen HF, Moslem G, Alonso A, Bernstein I, et al. Guidelines for the clinical management of Lynch syndrome (hereditary non-polyposis cancer). J Med Genet. 2007;44:353-362. Toàn văn Tóm lược
- De Jong AE, Morreau H, Van Puijenbroek M, et al. The role of mismatch repair gene defects in the development of adenomas in patients with HNPCC. Gastroenterology. 2004;126:42-48. Tóm lược
- Giardiello FM, Bresinger JD, Tersmette AC, et al. Very high risk of cancer in familial Peutz-Jeghers syndrome. Gastroenterology. 2000;119:1447-1453. Tóm lược
- Greenstein AJ, Sachar DB, Smith H, et al. Cancer in universal and left-sided ulcerative colitis: factors determining risk. Gastroenterology. 1979;77:290-294. Tóm lược
- Sugita A, Sachar DB, Bodian C, et al. Colorectal cancer in ulcerative colitis. Influence of anatomical extent and age at onset on colitis-cancer interval. Gut. 1991;32:167-169. Tóm lược
- Gillen CD, Walmsley RS, Prior P, et al. Ulcerative colitis and Crohn’s disease: a comparison of the colorectal cancer risk in extensive colitis. Gut. 1994;35:1590-1592. Toàn văn Tóm lược
- Gilat T, Fireman Z, Grossman A, et al. Colorectal cancer in patients with ulcerative colitis. A population study in central Israel. Gastroenterology. 1988;94:870-877. Tóm lược
- Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut. 2001;48:526-535. Toàn văn Tóm lược
- Ford ES. Body mass index and colon cancer in a national sample of adult U.S. men and women. Am J Epidemiol. 1999;150:390-398. Toàn văn Tóm lược
- Murphy TK, Calle EE, Rodriguez C, et al. Body mass index and colon cancer mortality in a large prospective study. Am J Epidemiol. 2000;152:847-854. Toàn văn Tóm lược
- Bianchini F, Kaaks R, Vainio H. Overweight, obesity, and cancer risk. Lancet Oncol. 2002;3:565-574. Tóm lược
- Renehan AG, O’Dwyer ST, Shalet SM. Screening colonoscopy for acromegaly in perspective. Clin Endocrinol (Oxf). 2001;55:731-733. Tóm lược
- Kruk J, Aboul-Enein HY. Physical activity and cancer prevention: updating the evidence. The role of oxidative stress in carcinogenesis. Curr Cancer Ther Rev. 2007;3:81-95.
- Bingham SA, Day NE, Luben R, et al. Dietary fibre in food and protection against colorectal cancer in the European Prospective Investigation into Cancer and Nutrition (EPIC): an observational study. Lancet. 2003;361:1496-1501. Tóm lược
- Bibbins-Domingo K; US Preventive Services Task Force. Aspirin use for the primary prevention of cardiovascular disease and colorectal cancer: US Preventive Services Task Force recommendation statement. Ann Intern Med. 2016;164:836-845. Toàn văn Tóm lược
- Rostom A, Dube C, Lewin G, et al. Nonsteroidal anti-inflammatory drugs and cyclooxygenase-2 inhibitors for primary prevention of colorectal cancer: a systematic review prepared for the U.S. Preventive Services Task Force. Ann Intern Med. 2007;146:376-389. Toàn văn Tóm lược
- Baron JA, Beach M, Mandel JS, et al, for The Calcium Polyp Prevention Study Group. Calcium supplements for the prevention of colorectal adenomas. N Engl J Med. 1999;340:101-107. Toàn văn Tóm lược
- Zauber AG, Winawer SJ, O’Brien MJ, et al. Colonoscopic polypectomy and long-term prevention of colorectal- cancer deaths. N Engl J Med. 2012;366:687-696. Toàn văn Tóm lược
- Cook NR, Lee IM, Zhang SM, et al. Alternate-day, low-dose aspirin and cancer risk: long-term observational follow-up of a randomized trial. Ann Intern Med. 2013;159:77-85. Toàn văn Tóm lược
- Rockey DC, Cello JP. Evaluation of the gastrointestinal tract in patients with iron-deficiency anemia. N Engl J Med. 1993;329:1691-1695. Toàn văn Tóm lược
- Raje D, Mukhtar H, Oshowo A, et al. What proportion of patients referred to secondary care with iron deficiency anemia have colon cancer? Dis Colon Rectum. 2007;50:1211-1214. Tóm lược
- Atkin W, Dadswell E, Wooldrage K, et al; SIGGAR Investigators. Computed tomographic colonography versus colonoscopy for investigation of patients with symptoms suggestive of colorectal cancer (SIGGAR): a multicentre randomised trial. Lancet. 2013;381:1194-1202. Tóm lược
- Halligan S, Wooldrage K, Dadswell E, et al; SIGGAR investigators. Computed tomographic colonography versus barium enema for diagnosis of colorectal cancer or large polyps in symptomatic patients (SIGGAR): a multicentre randomised trial. Lancet. 2013;381:1185-1193. Tóm lược
- Holme 0, Bretthauer M, Fretheim A, et al. Flexible sigmoidoscopy versus faecal occult blood testing for colorectal cancer screening in asymptomatic individuals. Cochrane Database Syst Rev. 2013;(9):CD009259. Toàn văn Tóm lược
- Bressler B, Paszat LF, Chen Z, et al. Rates of new or missed colorectal cancers after colonoscopy and their risk factors: a population-based analysis. Gastroenterology. 2007;132:96-102. Tóm lược
- Levin TR, Zhao W, Conell C, et al. Complications of colonoscopy in an integrated health care delivery system. Ann Intern Med. 2006;145:880-886. Tóm lược
- ASGE Standards of Practice Committee, Fisher DA, Shergill AK, et al. Role of endoscopy in the staging and management of colorectal cancer. Gastrointest Endosc. 2013;78:8-12. Toàn văn Tóm lược
- Ganeshan A, Upponi S, Uberoi R, et al. Minimal-preparation CT colon in detection of colonic cancer, the Oxford experience. Age Ageing. 2007;36:48-52. Toàn văn Tóm lược
- Kealey SM, Dodd JD, MacEneaney PM, et al. Minimal preparation computed tomography instead of barium enema/colonoscopy for suspected colon cancer in frail elderly patients: an outcome analysis study. Clin Radiol. 2004;59:44-52. Tóm lược
- Al-Sukhni E, Milot L, Fruitman M, et al. Diagnostic accuracy of MRI for assessment of T category, lymph node metastases, and circumferential resection margin involvement in patients with rectal cancer: a systematic review and meta-analysis. Ann Surg Oncol. 2012;19:2212-2223. Tóm lược
- Watson AJ, Lolohea S, Robertson GM, et al. The role of positron emission tomography in the management of recurrent colorectal cancer: a review. Dis Colon Rectum. 2007;50:102-114. Tóm lược
- Zhang C, Chen Y, Xue H, et al. Diagnostic value of FDG-PET in recurrent colorectal carcinoma: a meta-analysis. Int J Cancer. 2009;124:167-173. Tóm lược
- Facey K, Bradbury I, Laking G, et al. Overview of the clinical effectiveness of positron emission tomography imaging in selected cancers. Health Technol Assess. 2007;11:iii-iv;xi-267. Toàn văn Tóm lược
- Moulton CA, Gu CS, Law CH, et al. Effect of PET before liver resection on surgical management for colorectal adenocarcinoma metastases: a randomized clinical trial. JAMA. 2014;311:1863-1869. Toàn văn Tóm lược
- Flamen P, Hoekstra OS, Homans F, et al. Unexplained rising carcinoembryonic antigen (CEA) in the postoperative surveillance of colorectal cancer: the utility of positron emission tomography (PET). Eur J Cancer. 2001;37:862-869. Tóm lược
- Royal College of Physicians. Evidence-based indications for the use of PET-CT in the United Kingdom 2016. https://www.rcplondon.ac.uk/ (last accessed 19 July 2017). Toàn văn
- Macdonald JS. Carcinoembryonic antigen screening: pros and cons. Semin Oncol. 1999;26:556-560. Tóm lược
- Butterworth AS, Higgins JP, Pharoah P. Relative and absolute risk of colorectal cancer for individuals with a family history: a meta-analysis. Eur J Cancer. 2006;42:216-227. Tóm lược
- du Toit J, Hamilton W, Barraclough K. Risk in primary care of colorectal cancer from new onset rectal bleeding: 10 year prospective study. BMJ. 2006;333:69-70. Tóm lược
- McSherry CK, Cornell GN, Glenn F. Carcinoma of the colon and rectum. Ann Surg. 1969;169:502-509. Tóm lược
- Shallow TA, Wagner FB, Colcher RE. Clinical evaluation of 750 patients with colon cancer. Diagnostic survey and follow up covering a 15 year period. Ann Surg. 1955;142:164-175. Tóm lược
- Kanellos D, Kitsios G, Kanellos I, et al. Anemia as a symptom of right colon cancer. Tech Coloproctol. 2004;8:62-64. Tóm lược
- Lieberman DA, Weiss DG, Bond JH, et al. Use of colonoscopy to screen asymptomatic adults for colorectal cancer. N Engl J Med. 2000;343:162-168. Toàn văn Tóm lược
- Luning T, Keemers-Gels M, Barendregt W, et al. Colonoscopic perforations: a review of 30,366 patients. Surg End. 2007;21:994-997. Tóm lược
- Gluecker TM, Johnson CD, Harmsen WS, et al. Colorectal cancer screening with CT colonography, colonoscopy, and double-contrast barium enema examination: prospective assessment of patient perceptions and preferences. Radiology. 2003;227:378-484. Tóm lược
- Bosworth HB, Rockey DC, Paulson EK, et al. Prospective comparison of patient experience with colon imaging tests. Am J Med. 2006;119: 791-799. Tóm lược
- Vora P, Chapman A. Complications from radiographer-performed double contrast barium enemas. Clin Rad. 2004;59:364-368. Tóm lược
- Rockey RC, Paulson E, Niedzwiecki D, et al. Analysis of air contrast barium enema, computed tomographic colonography, and colonoscopy: prospective comparison. Lancet. 2005;365:305-311. Tóm lược
- Mulhall BP, Veerappan GR, Jackson JL. Meta-analysis: computed tomographic colonography. Ann Intern Med. 2005;142:635-650. Toàn văn Tóm lược
- Thoeni RF. Colorectal cancer. Radiologic staging. Radiol Clin North Am. 1997;35:457-485. Tóm lược
- Battersby NJ, How P, Moran B, et al. Prospective validation of a low rectal cancer magnetic resonance imaging staging system and development of a local recurrence risk stratification model: The MERCURY II Study. Ann Surg. 2016;263:751-760. Tóm lược
- Kwok H, Bissett IP, Hill GL. Preoperative staging of rectal cancer. Int J Colorectal Dis. 2000;15:9-20. Tóm lược
- Locker GY, Hamilton S, Harris J, et al. ASCO 2006 update of recommendations for the use of tumor markers in gastrointestinal cancer. J Clin Oncol. 2006;24:5313-5327. Toàn văn Tóm lược
- Tan E, Gouvas N, Nicholls RJ, et al. Diagnostic precision of carcinoembryonic antigen in the detection of recurrence of colorectal cancer. Surg Oncol. 2009;18:15-24. Tóm lược
- Drossman DA, Camilleri M, Mayes FA. AGA technical review on irritable bowel syndrome. Gastroenterology. 2002 Dec;123(6):2108-31. Tóm lược
- Malila N, Oivanen T, Malminiemi O, et al. Test, episode, and programme sensitivities of screening for colorectal cancer as a public health policy in Finland: experimental design. BMJ. 2008;337:a2261. Toàn văn Tóm lược
- Heresbach D, Manfredi S, D’halluin PN, et al. Review in depth and meta-analysis of controlled trials on colorectal cancer screening by faecal occult blood test. Eur J Gastroenterol Hepatol. 2006;18:427-433. Tóm lược
- Burch JA, Soares-Weiser K, St John DJ, et al. Diagnostic accuracy of faecal occult blood tests used in screening for colorectal cancer: a systematic review. J Med Screen. 2007;14:132-137. Toàn văn Tóm lược
- Hewitson P, Glasziou P, Watson E, et al. Cochrane systematic review of colorectal cancer screening using the fecal occult blood test (hemoccult): an update. Am J Gastroenterol. 2008;103:1541-1549. Tóm lược
- Rabeneck L, Rumble RB, Thompson F, et al. Fecal immunochemical tests compared with guaiac fecal occult blood tests for population-based colorectal cancer screening. Can J Gastroenterol. 2012;26:131-147. Toàn văn Tóm lược
- American Cancer Society. Colorectal cancer screening tests. July 2017. http://www.cancer.org/ (last accessed 19 July 2017). Toàn văn
- Hol L, van Leerdam ME, van Ballegooijen M, et al. Screening for colorectal cancer: randomised trial comparing guaiac-based and immunochemical faecal occult blood testing and flexible sigmoidoscopy. Gut. 2010;59:62-68. Tóm lược
- US Preventive Services Task Force; Bibbins-Domingo K, Grossman DC, Curry SJ, et al. Screening for colorectal cancer: US Preventive Services Task Force recommendation statement. JAMA. 2016;315:2564-2575. Toàn văn Tóm lược
- Rex DK, Johnson DA, Anderson JC, et al; American College of Gastroenterology. American College of Gastroenterology guidelines for colorectal cancer screening 2009 [corrected] Am J Gastroenterol. 2009;104:739-750. Tóm lược
- Qaseem A, Denberg TD, Hopkins RH Jr, et al. Screening for colorectal cancer: a guidance statement from the American College of Physicians. Ann Intern Med. 2012;156:378-386. Toàn văn Tóm lược
- Canadian Task Force on Preventive Health Care; Bacchus CM, Dunfield L, Gorber SC, et al. Recommendations on screening for colorectal cancer in primary care. CMAJ. 2016;188:340-348. Toàn văn Tóm lược
- Public Health England. Bowel cancer screening: programme overview. August 2017. https://www.gov.uk/ (last accessed 6 September 2017). Toàn văn
- Haller DG, Tabernero J, Maroun J, et al. Capecitabine plus oxaliplatin compared with fluorouracil and folinic acid as adjuvant therapy for stage III colon cancer. J Clin Oncol. 2011;29:1465-1471. Tóm lược
- Atkin WS, Edwards R, Kralj-Hans I, et al; UK Flexible Sigmoidoscopy Trial Investigators. Once-only flexible sigmoidoscopy screening in prevention of colorectal cancer: a multicentre randomised controlled trial. Lancet. 2010;375:1624-1633. Tóm lược
- Cairns SR, Scholefield JH, Steele RJ, et al; British Society of Gastroenterology; Association of Coloproctology for Great Britain and Ireland. Guidelines for colorectal cancer screening and surveillance in moderate and high risk groups (update from 2002). Gut. 2010;59:666-689. Toàn văn Tóm lược
- Giardiello FM, Brensinger JK, Petersen GM. AGA technical review on hereditary colorectal cancer and genetic testing. Gastroenterology. 2001;121:198-213. Tóm lược
- Crispens MA. Endometrial and ovarian cancer in Lynch syndrome. Clin Colon Rectal Surg. 2012;25:97-102. Toàn văn Tóm lược
- Jenkins PJ, Fairclough PD. Screening guidelines for colorectal cancer and polyps in patients with acromegaly. Gut. 2002;51(suppl V):v13-v14. Tóm lược
- Clinical Outcomes of Surgical Therapy Study Group. A comparison of laparoscopically assisted and open colectomy for colon cancer. N Engl J Med. 2004;350:2050-2059. Toàn văn Tóm lược
- Colon Cancer Laparoscopic or Open Resection Study Group, Buunen M, Veldkamp R, Hop WC, et al. Survival after laparoscopic surgery versus open surgery for colon cancer: long-term outcome of a randomised clinical trial. Lancet Oncol. 2009;10:44-52. Tóm lược
- Green BL, Marshall HC, Collinson F, et al. Long-term follow-up of the Medical Research Council CLASICC trial of conventional versus laparoscopically assisted resection in colorectal cancer. Br J Surg. 2013;100:75-82. Toàn văn Tóm lược
- Kennedy RH, Francis EA, Wharton R, et al. Multicenter randomized controlled trial of conventional versus laparoscopic surgery for colorectal cancer within an enhanced recovery programme: EnROL. J Clin Oncol. 2014;32:1804-1811. Toàn văn Tóm lược
- Spanjersberg WR, Reurings J, Keus F, et al. Fast track surgery versus conventional recovery strategies for colorectal surgery. Cochrane Database Syst Rev. 2011;(2):CD007635. Toàn văn Tóm lược
- van der Pas MH, Haglind E, Cuesta MA, et al. Laparoscopic versus open surgery for rectal cancer (COLOR II): short-term outcomes of a randomised, phase 3 trial. Lancet Oncol. 2013;14:210-218. Tóm lược
- van Gijn W, Gooiker GA, Wouters MW, et al. Volume and outcome in colorectal cancer surgery. Eur J Surg Oncol. 2010;36(suppl 1):S55-S63. Tóm lược
- Fujita S, Akasu T, Mizusawa J, et al. Postoperative morbidity and mortality after mesorectal excision with and without lateral lymph node dissection for clinical stage II or stage III lower rectal cancer (JCOG0212): results from a multicentre, randomised controlled, non-inferiority trial. Lancet Oncol. 2012;13:616-621. Tóm lược
- Anderson C, Uman G, Pigazzi A. Oncologic outcomes of laparoscopic surgery for rectal cancer: a systematic review and meta-analysis of the literature. Eur J Surg Oncol. 2008;34:1135-1142. Tóm lược
- Ng SS, Lee JF, Yiu RY, et al. Long-term oncologic outcomes of laparoscopic versus open surgery for rectal cancer: a pooled analysis of 3 randomized controlled trials. Ann Surg. 2014;259:139-147. Tóm lược
- Vennix S, Pelzers L, Bouvy N, et al. Laparoscopic versus open total mesorectal excision for rectal cancer. Cochrane Database Syst Rev. 2014;(4):CD005200. Toàn văn Tóm lược
- Bonjer HJ, Deijen CL, Abis GA, et al. A randomized trial of laparoscopic versus open surgery for rectal cancer. N Engl J Med. 2015;372:1324-1332. Toàn văn Tóm lược
- Jeong SY, Park JW, Nam BH, et al. Open versus laparoscopic surgery for mid-rectal or low-rectal cancer after neoadjuvant chemoradiotherapy (COREAN trial): survival outcomes of an open-label, non-inferiority, randomised controlled trial. Lancet Oncol. 2014;15:767-774. Tóm lược
- Fleshman J, Branda M, Sargent DJ, et al. Effect of laparoscopic-assisted resection vs. open resection of stage II or III rectal cancer on pathologic outcomes: the ACOSOG Z6051 randomized clinical trial. JAMA. 2015;314:1346-1355. Tóm lược
- Aly EH. Robotic colorectal surgery: summary of the current evidence. Int J Colorectal Dis. 2014;29:1-8. Tóm lược
- Winde G, Nottberg H, Keller R, et al. Surgical cure for early rectal carcinomas (T1). Transanal endoscopic microsurgery vs. anterior resection. Dis Colon Rectum. 1996;39:969-976. Tóm lược
- Suppiah A, Maslekar S, Alabi A, et al. Transanal endoscopic microsurgery in early rectal cancer: time for a trial? Colorectal Dis. 2008;10:314-327. Tóm lược
- Sgourakis G, Lanitis S, Gockel I, et al. Transanal endoscopic microsurgery for T1 and T2 rectal cancers: a meta-analysis and meta-regression analysis of outcomes. Am Surg. 2011;77:761-772. Tóm lược
- Montedori A, Cirocchi R, Farinella E, et al. Covering ileo- or colostomy in anterior resection for rectal carcinoma. Cochrane Database Syst Rev. 2010;(5):CD006878. Toàn văn Tóm lược
- Sauer R, Liersch T, Merkel S, et al. Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase III trial after a median follow-up of 11 years. J Clin Oncol. 2012;30:1926-1933. Tóm lược
- Fiorica F, Cartei F, Licata A, et al. Can chemotherapy concomitantly delivered with radiotherapy improve survival of patients with resectable rectal cancer? A meta-analysis of literature data. Cancer Treat Rev. 2010;36:539-549. Tóm lược
- Tiv M, Puyraveau M, Mineur L, et al. Long-term quality of life in patients with rectal cancer treated with preoperative (chemo)-radiotherapy within a randomized trial. Cancer Radiother. 2010;14:530-534. Tóm lược
- Aschele C, Cionini L, Lonardi S, et al. Primary tumor response to preoperative chemoradiation with or without oxaliplatin in locally advanced rectal cancer: pathologic results of the STAR-01 randomized phase III trial. J Clin Oncol. 2011;29:2773-2780. Tóm lược
- Gérard JP, Azria D, Gourgou-Bourgade S, et al. Comparison of two neoadjuvant chemoradiotherapy regimens for locally advanced rectal cancer: results of the phase III trial ACCORD 12/0405-Prodige 2. J Clin Oncol. 2010;28:1638-1644. Tóm lược
- Gérard JP, Azria D, Gourgou-Bourgade S, et al. Clinical outcome of the ACCORD 12/0405 PRODIGE 2 randomized trial in rectal cancer. J Clin Oncol. 2012;30:4558-4565. Tóm lược
- Rodel C, Liersch T, Becker H, et al. Preoperative chemoradiotherapy and postoperative chemotherapy with fluorouracil and oxaliplatin versus fluorouracil alone in locally advanced rectal cancer: initial results of the German CAO/ARO/AIO-04 randomised phase 3 trial. Lancet Oncol. 2012;13:679-687. Tóm lược
- De Caluwé L, Van Nieuwenhove Y, Ceelen WP. Preoperative chemoradiation versus radiation alone for stage II and III resectable rectal cancer. Cochrane Database Syst Rev. 2013;(2):CD006041. Toàn văn Tóm lược
- McCarthy K, Pearson K, Fulton R, et al. Pre-operative chemoradiation for non-metastatic locally advanced rectal cancer. Cochrane Database Syst Rev. 2012;(12):CD008368. Toàn văn Tóm lược
- van Gijn W, Marijnen CA, Nagtegaal ID, et al; Dutch Colorectal Cancer Group. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomised controlled TME trial. Lancet Oncol. 2011;12:575-582. Tóm lược
- Pettersson D, Cedermark B, Holm T, et al. Interim analysis of the Stockholm III trial of preoperative radiotherapy regimens for rectal cancer. Br J Surg. 2010;97:580-587. Tóm lược
- Ngan SY, Burmeister B, Fisher RJ, et al. Randomized trial of short-course radiotherapy versus long-course chemoradiation comparing rates of local recurrence in patients with T3 rectal cancer: trans-tasman radiation oncology group trial 01.04. J Clin Oncol. 2012;30:3827-3833. Tóm lược
- Bujko K, Nowacki MP, Nasierowska-Guttmejer A, et al. Sphincter preservation following preoperative radiotherapy for rectal cancer: report of a randomised trial comparing short-term radiotherapy vs. conventionally fractionated radiochemotherapy. Radiother Oncol. 2004;72:15-24. Tóm lược
- National Institute for Health and Care Excellence. Colorectal cancer: the diagnosis and management of colorectal cancer. December 2014. http://guidance.nice.org.uk (last accessed 19 July 2017). Toàn văn
- Bujko K, Glynne-Jones R, Bujko M. Does adjuvant fluoropyrimidine-based chemotherapy provide a benefit for patients with resected rectal cancer who have already received neoadjuvant radiochemotherapy? A systematic review of randomised trials. Ann Oncol. 2010;21:1743-1750. Toàn văn Tóm lược
- Wong RK, Berry S, Spithoff K, et al; Gastrointestinal Cancer Disease Site Group. Preoperative or postoperative therapy for stage II or III rectal cancer: an updated practice guideline. Clin Oncol (R Coll Radiol). 2010;22:265-271. Tóm lược
- Bosset JF, Calais G, Mineur L, et al; EORTC Radiation Oncology Group. Fluorouracil-based adjuvant chemotherapy after preoperative chemoradiotherapy in rectal cancer: long-term results of the EORTC 22921 randomised study. Lancet Oncol. 2014;15:184-190. Toàn văn Tóm lược
- Kim TW, Lee JH, Lee JH, et al. Randomized trial of postoperative adjuvant therapy in stage II and III rectal cancer to define the optimal sequence of chemotherapy and radiotherapy: 10-year follow-up. Int J Radiat Oncol Biol Phys. 2011;81:1025-1031. Tóm lược
- Choti MA, Sitzmann JV, Tiburi MF, et al. Trends in long term survival following liver resection for hepatic colorectal metastases. Ann Surg. 2002;235:759-766. Toàn văn Tóm lược
- Pozzo C, Basso M, Cassano A, et al. Neoadjuvant treatment of unresectable liver disease with irinotecan and 5- fluorouracil plus folinic acid in colorectal cancer patients. Ann Oncol. 2004;15:933-939. Toàn văn Tóm lược
- Maak M, Simon I, Nitsche U, et al. Independent validation of a prognostic genomic signature (ColoPrint) for patients with stage II colon cancer. Ann Surg. 2013;257:1053-1058. Tóm lược
- Venook AP, Niedzwiecki D, Lopatin M, et al. Biologic determinants of tumor recurrence in stage II colon cancer: validation study of the 12-gene recurrence score in cancer and leukemia group B (CALGB) 9581. J Clin Oncol. 2013;31:1775-1781. Toàn văn Tóm lược
- Jonker DJ, Spithoff K, Maroun J; Gastrointestinal Cancer Disease Site Group of Cancer Care Ontario’s Program in Evidence-based Care. Adjuvant systemic chemotherapy for stage II and III colon cancer after complete resection: an updated practice guideline. Clin Oncol (R Coll Radiol). 2011;23:314-322. Tóm lược
- André T, Boni C, Navarro M, et al. Improved overall survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage II or III colon cancer in the MOSAIC trial. J Clin Oncol. 2009;27:3109-3116. Toàn văn Tóm lược
- André T, de Gramont A, Vernerey D, et al. Adjuvant fluorouracil, leucovorin, and oxaliplatin in stage II to III colon cancer: updated 10-Year survival and outcomes according to BRAF mutation and mismatch repair status of the MOSAIC study. J Clin Oncol. 2015;33:4176-4187. Tóm lược
- Schmoll HJ, Tabernero J, Maroun J, et al. Capecitabine plus oxaliplatin compared with fluorouracil/folinic acid as adjuvant therapy for stage III colon cancer: final results of the NO16968 randomized controlled phase III trial. J Clin Oncol. 2015;33:3733-3740. Toàn văn Tóm lược
- Saltz LB, Niedzwiecki D, Hollis D, et al. Irinotecan fluorouracil plus leucovorin is not superior to fluorouracil plus leucovorin alone as adjuvant treatment for stage III colon cancer: results of CALGB 89803. J Clin Oncol. 2007;25:3456-3461. Toàn văn Tóm lược
- Allegra CJ, Yothers G, O’Connell MJ, et al. Phase III trial assessing bevacizumab in stages II and III carcinoma of the colon: results of NSABP protocol C-08. J Clin Oncol. 2011;29:11-16. Tóm lược
- de Gramont A, Van Cutsem E, Schmoll HJ, et al. Bevacizumab plus oxaliplatin-based chemotherapy as adjuvant treatment for colon cancer (AVANT): a phase 3 randomised controlled trial. Lancet Oncol. 2012;13:1225-1233. Tóm lược
- Allegra CJ, Yothers G, O’Connell MJ, et al. Bevacizumab in stage II-III colon cancer: 5-year update of the National Surgical Adjuvant Breast and Bowel Project C-08 trial. J Clin Oncol. 2013;31:359-364. Toàn văn Tóm lược
- Taieb J, Tabernero J, Mini E, et al. Oxaliplatin, fluorouracil, and leucovorin with or without cetuximab in patients with resected stage III colon cancer (PETACC-8): an open-label, randomised phase 3 trial. Lancet Oncol. 2014;15:862-873. Tóm lược
- Des Guetz G, Nicolas P, Perret GY, et al. Does delaying adjuvant chemotherapy after curative surgery for colorectal cancer impair survival? A meta-analysis. Eur J Cancer. 2010;46:1049-1055. Tóm lược
- Biagi JJ, Raphael MJ, Mackillop WJ, et al. Association between time to initiation of adjuvant chemotherapy and survival in colorectal cancer. JAMA. 2011;305:2335-2342. Tóm lược
- Figueredo A, Coombes ME, Mukherjee S. Adjuvant therapy for completely resected stage II colon cancer. Cochrane Database Syst Rev. 2008;(3):CD005390. Tóm lược
- Blanke CD, Bot BM, Thomas DM, et al. Impact of young age on treatment efficacy and safety in advanced colorectal cancer: a pooled analysis of patients from nine first-line phase III chemotherapy trials. J Clin Oncol. 2011;29:2781-2786. Tóm lược
- Tournigand C, André T, Bonnetain F, et al. Adjuvant therapy with fluorouracil and oxaliplatin in stage II and elderly patients (between ages 70 and 75 years) with colon cancer: Subgroup analyses of the multicenter international study of oxaliplatin, fluorouracil, and leucovorin in the adjuvant treatment of colon cancer trial. J Clin Oncol. 2012;30:3353-3360. Tóm lược
- Sargent DJ, Marsoni S, Monges G, et al. Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil-based adjuvant therapy in colon cancer. J Clin Oncol. 2010;28:3219-3226. Toàn văn Tóm lược
- Clark ME, Smith RR. Liver-directed therapies in metastatic colorectal cancer. J Gastrointest Oncol. 2014;5:374-387. Toàn văn Tóm lược
- De Groote K, Prenen H. Intrahepatic therapy for liver-dominant metastatic colorectal cancer. World J Gastrointest Oncol. 2015;7:148-152. Toàn văn Tóm lược
- Jones C, Badger SA, Ellis G. The role of microwave ablation in the management of hepatic colorectal metastases. Surgeon. 2011;9:33-37. Tóm lược
- Fuchs CS, Marshall J, Barrueco J. Randomized, controlled trial of irinotecan plus infusional, bolus, or oral fluoropyrimidines in first-line treatment of metastatic colorectal cancer: updated results from the BICC-C study. J Clin Oncol. 2008;26:689-690. Tóm lược
- Tournigand C, Cervantes A, Figer A, et al. OPTIMOX1: a randomized study of FOLFOX4 or FOLFOX7 with oxaliplatin in a stop-and-Go fashion in advanced colorectal cancer – a GERCOR study. J Clin Oncol. 2006;24:394-400. Toàn văn Tóm lược
- Venook AP, Niedzwiecki D, Lenz H-J, et al. CALGB/SWOG 80405: Phase III trial of irinotecan/5-FU/leucovorin (FOLFIRI) or oxaliplatin/5-FU/leucovorin (mFOLFOX6) with bevacizumab (BV) or cetuximab (CET) for patients (pts) with KRAS wild-type (wt) untreated metastatic adenocarcinoma of the colon or rectum (MCRC). ASCO Meeting Abstracts 2014;32(suppl 18):LBA3. Toàn văn
- Cassidy J, Clarke S, Díaz-Rubio E, et al. Randomized phase III study of capecitabine plus oxaliplatin compared with fluorouracil/folinic acid plus oxaliplatin as first-line therapy for metastatic colorectal cancer. J Clin Oncol. 2008;26:2006-2012. Toàn văn Tóm lược
- Rothenberg ML, Cox JV, Butts C, et al. Capecitabine plus oxaliplatin (XELOX) versus 5-fluorouracil/folinic acid plus oxaliplatin (FOLFOX-4) as second-line therapy in metastatic colorectal cancer: a randomized phase III noninferiority study. Ann Oncol. 2008;19:1720-1726. Toàn văn Tóm lược
- Fuchs CS, Marshall J, Mitchell E, et al. Randomized, controlled trial of irinotecan plus infusional, bolus, or oral fluoropyrimidines in first-line treatment of metastatic colorectal cancer: results from the BICC-C Study. J Clin Oncol. 2007;25:4779-4786. Toàn văn Tóm lược
- Saltz LB, Clarke S, Díaz-Rubio E, et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first- line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol. 2008;26:2013-2019. Tóm lược
- Giantonio BJ, Catalano PJ, Meropol NJ, et al.; Eastern Cooperative Oncology Group Study E3200. Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol. 2007;25:1539-1544. Tóm lược
- Bennouna J, Sastre J, Arnold D, et al. Continuation of bevacizumab after first progression in metastatic colorectal cancer (ML18147): a randomised phase 3 trial. Lancet Oncol. 2013;14:29-37. Tóm lược
- Van Cutsem E, Tabernero J, Lakomy R, et al. Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol. 2012;30:3499-3506. Tóm lược
- Tabernero J, Yoshino T, Cohn AL, et al. Ramucirumab versus placebo in combination with second-line FOLFIRI in patients with metastatic colorectal carcinoma that progressed during or after first-line therapy with bevacizumab, oxaliplatin, and a fluoropyrimidine (RAISE): a randomised, double-blind, multicentre, phase 3 study. Lancet Oncol. 2015;16:499-508. Tóm lược
- Grothey A, Van Cutsem E, Sobrero A, et al; CORRECT Study Group. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2013;381:303-312. Tóm lược
- Amado RG, Wolf M, Peeters M, et al. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol. 2008;26:1626-1634. Toàn văn Tóm lược
- Karapetis CS, Khambata-Ford S, Jonker DJ, et al. K-ras mutations and benefit from cetuximab in advanced colorectal cancer. N Engl J Med. 2008;359:1757-1765. Toàn văn Tóm lược
- Douillard JY, Oliner KS, Siena S, et al. Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer. N Engl J Med. 2013;369:1023-1034. Toàn văn Tóm lược
- Bokemeyer C, Kohne C-H, Ciardiello F, et al. Treatment outcome according to tumor RAS mutation status in OPUS study patients with metastatic colorectal cancer (mCRC) randomized to FOLFOX4 with/without cetuximab. ASCO Meeting Abstracts 2014;32(15_suppl):3505.
- Van Cutsem E, Lenz HJ, Kohne C2, et al. Fluorouracil, leucovorin, and irinotecan plus cetuximab treatment and RAS mutations in colorectal cancer. J Clin Oncol. 2015;33:692-700. Toàn văn Tóm lược
- Peeters M, Oliner KS, Price TJ, et al. Analysis of KRAS/NRAS mutations in phase 3 study 20050181 of panitumumab (pmab) plus FOLFIRI versus FOLFIRI for second-line treatment (tx) of metastatic colorectal cancer (mCRC). ASCO Meeting Abstracts 2014;32(3_suppl):LBA387.
- Venook AP, Niedzwiecki D, Lenz HJ, et al. Effect of first-line chemotherapy combined with cetuximab or bevacizumab on overall survival in patients with KRAS wild-type advanced or metastatic colorectal cancer: a randomized clinical trial. JAMA. 2017;317:2392-2401. Tóm lược
- Loupakis F, Cremolini C, Masi G, et al. Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer. N Engl J Med. 2014;371:1609-1618. Toàn văn Tóm lược
- Grothey A, Hart LL, Rowland KM, et al. Intermittent oxaliplatin (oxali) administration and time-to-treatment- failure (TTF) in metastatic colorectal cancer (mCRC): Final results of the phase III CONcePT trial. ASCO Meeting Abstracts 2008;26(15_suppl):4010.
- Yalcin S, Uslu R, Dane F, et al. Bevacizumab + capecitabine as maintenance therapy after initial bevacizumab + XELOX treatment in previously untreated patients with metastatic colorectal cancer: phase III ‘Stop and Go’ study results – a Turkish Oncology Group Trial. Oncology. 2013;85:328-335. Toàn văn Tóm lược
- Labianca R, Sobrero A, Isa L, et al; Italian Group for the Study of Gastrointestinal Cancer-GISCAD. Intermittent versus continuous chemotherapy in advanced colorectal cancer: a randomised ‘GISCAD’ trial. Ann Oncol. 2011;22:1236-1242. Tóm lược
- Adams RA, Meade AM, Seymour MT, et al. Intermittent versus continuous oxaliplatin and fluoropyrimidine combination chemotherapy for first-line treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet Oncol. 2011;12:642-653. Toàn văn Tóm lược
- Simkens LH, van Tinteren H, May A, et al. Maintenance treatment with capecitabine and bevacizumab in metastatic colorectal cancer (CAIRO3): a phase 3 randomised controlled trial of the Dutch Colorectal Cancer Group. Lancet. 2015;385:1843-1852. Tóm lược
- Althumairi AA, Gearhart SL. Local excision for early rectal cancer: transanal endoscopic microsurgery and beyond. J Gastrointest Oncol. 2015;6:296-306. Toàn văn Tóm lược
- Garcia-Aguilar J, Shi Q, Thomas CR Jr, et al. A phase II trial of neoadjuvant chemoradiation and local excision for T2N0 rectal cancer: preliminary results of the ACOSOG Z6041 trial. Ann Surg Oncol. 2012;19:384-391. Tóm lược
- Heidary B, Phang TP, Raval MJ, et al. Transanal endoscopic microsurgery: a review. Can J Surg. 2014;57:127-138. Toàn văn Tóm lược
- Rai V, Mishra N. Transanal approach to rectal polyps and cancer. Clin Colon Rectal Surg. 2016;29:65-70. Toàn văn Tóm lược
- National Comprehensive Cancer Network. Clinical practice guidelines in oncology: rectal cancer. 2017. http:// www.nccn.org (last accessed 19 July 2017).
- National Institute for Health and Care Excellence. Bevacizumab in combination with oxaliplatin and either fluorouracil plus folinic acid or capecitabine for the treatment of metastatic colorectal cancer. December 2010. http://guidance.nice.org.uk. (last accessed 19 July 2017). Toàn văn
- Seymour MT, Thompson LC, Wasan HS, et al; FOCUS2 Investigators; National Cancer Research Institute Colorectal Cancer Clinical Studies Group. Chemotherapy options in elderly and frail patients with metastatic colorectal cancer (MRC FOCUS2): an open-label, randomised factorial trial. Lancet. 2011;377:1749-1759. Tóm lược
- Adams RA, Meade AM, Seymour MT, et al; MRC COIN Trial Investigators. Intermittent versus continuous oxaliplatin and fluoropyrimidine combination chemotherapy for first-line treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet Oncol. 2011;12:642-653. Tóm lược
- Wagner AD, Arnold D, Grothey AA, et al. Anti-angiogenic therapies for metastatic colorectal cancer. Cochrane Database Syst Rev. 2009;(3):CD005392. Tóm lược
- Van Cutsem E, Kohne CH, Hitre E, et al. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med. 2009;360:1408-1417. Toàn văn Tóm lược
- Price TJ, Hardingham JE, Lee CK, et al. Impact of KRAS and BRAF gene mutation status on outcomes from the phase III AGITG MAX trial of capecitabine alone or in combination with bevacizumab and mitomycin in advanced colorectal cancer. J Clin Oncol. 2011;29:2675-2682. Tóm lược
- National Institute for Health and Care Excellence. Cetuximab for the first-line treatment of metastatic colorectal cancer. August 2009. http://www.nice.org.uk/ (last accessed 19 July 2017). Toàn văn
- Mocellin S, Baretta Z, Roqué I, et al. Second-line systemic therapy for metastatic colorectal cancer. Cochrane Database Syst Rev. 2017;(1):CD006875. Toàn văn Tóm lược
- Sobrero AF, Maurel J, Fehrenbacher L, et al. EPIC: phase III trial of cetuximab plus irinotecan after fluoropyrimidine and oxaliplatin failure in patients with metastatic colorectal cancer. J Clin Oncol. 2008;26:2311-2319. Tóm lược
- Poston GJ, Adam R, Alberts S, et al. OncoSurge: a strategy for improving resectability with curative intent in metastatic colorectal cancer. J Clin Oncol. 2005;23:7125-7134. Toàn văn Tóm lược
- Lièvre A, Bachet JB, Boige V, et al. KRAS mutations as an independent prognostic factor in patients with advanced colorectal cancer treated with cetuximab. J Clin Oncol. 2008;26:374-379. Tóm lược
- Mayer RJ, Van Cutsem E, Falcone A, et al.; RECOURSE Study Group. Randomized trial of TAS-102 for refractory metastatic colorectal cancer. N Engl J Med. 2015;372:1909-1919. Toàn văn Tóm lược
- Townsend AR, Chong LC, Karapetis C, et al. Selective internal radiation therapy for liver metastases from colorectal cancer. Cancer Treat Rev. 2016;50:148-154. Tóm lược
- van Hazel GA, Heinemann V, Sharma NK, et al. SIRFLOX: Randomized phase III trial comparing first-line mFOLFOX6 (plus or minus bevacizumab) versus mFOLFOX6 (plus or minus bevacizumab) plus selective internal radiation therapy in patients with metastatic colorectal cancer. J Clin Oncol. 2016;34:1723-1731. Toàn văn Tóm lược
- Van Hazel G, Blackwell A, Anderson J, et al. Randomised phase 2 trial of SIR-Spheres plus fluorouracil/leucovorin chemotherapy versus fluorouracil/leucovorin chemotherapy alone in advanced colorectal cancer. J Surg Oncol. 2004;88:78-85. Tóm lược
- Gray B, Van Hazel G, Hope M, et al. Randomised trial of SIR-Spheres plus chemotherapy vs. chemotherapy alone for treating patients with liver metastases from primary large bowel cancer. Ann Oncol. 2001;12:1711-1720. Tóm lược
- Hendlisz A, Van den Eynde M, Peeters M, et al. Phase III trial comparing protracted intravenous fluorouracil infusion alone or with yttrium-90 resin microspheres radioembolization for liver-limited metastatic colorectal cancer refractory to standard chemotherapy. J Clin Oncol. 2010;28:3687-3694. Toàn văn Tóm lược
- Wang X, Bao Z, Zhang X, et al. Effectiveness and safety of PD-1/PD-L1 inhibitors in the treatment of solid tumors: a systematic review and meta-analysis. Oncotarget. 2017 May 31 [Epub ahead of print]. Toàn văn Tóm lược
- US Food and Drug Administration. FDA approves first cancer treatment for any solid tumor with a specific genetic feature. May 2017. https://www.fda.gov/ (last accessed 18 July 2017). Toàn văn
- ClinicalTrials.gov. Study of pembrolizumab in combination with chemotherapy for patients with advanced colorectal cancer. March 2017. https://clinicaltrials.gov/ (last accessed 18 July 2017). Toàn văn
- ClinicalTrials.gov. Epacadostat in combination with pembrolizumab and azacitidine in subjects with metastatic colorectal cancer. June 2017. https://clinicaltrials.gov/ (last accessed 18 July 2017). Toàn văn
- ClinicalTrials.gov. Assess the efficacy of pembrolizumab plus radiotherapy or ablation in metastatic colorectal cancer patients. June 2017. https://clinicaltrials.gov/ (last accessed 18 July 2017). Toàn văn
- ClinicalTrials.gov. A study evaluating TAS-102 plus nivolumab in patients with MSS CRC. July 2017. https:// clinicaltrials.gov/ (last accessed 17 August 2017). Toàn văn
- ClinicalTrials.gov. Study of S 95005 in combination with oxaliplatin in metastatic colorectal cancer. April 2017. https://clinicaltrials.gov/ (last accessed 17 August 2017). Toàn văn
- O’Connell JB, Maggard MA, Ko CY. Colon cancer survival rates with the new American Joint Committee on Cancer sixth edition staging. J Natl Cancer Inst. 2004;96:1420-1425. Toàn văn Tóm lược
- Coleman MP, Gatta G, Verdecchia A, et al. EUROCARE-3 summary: cancer survival in Europe at the end of the 20th century. Ann Oncol. 2003;14:128-146. Tóm lược
- Gatta G, Capocaccia R, Sant M, et al. Understanding variations in survival for colorectal cancer in Europe: a EUROCARE high resolution study. Gut. 2000;47:533-538. Toàn văn Tóm lược
- Kerr J, Engel J, Eckel R, et al. Survival for rectal cancer patients and international comparisons. Ann Oncol. 2005;16:664-672. Toàn văn Tóm lược
- Gill S, Blackstock AW, Goldberg RM. Colorectal cancer. Mayo Clin Proc. 2007;82:114-129. Tóm lược
- National Comprehensive Cancer Network. Clinical practice guidelines in oncology: colon cancer. 2017. http:// www.nccn.org (last accessed 19 July 2017).
- Meyerhardt JA, Mangu PB, Flynn PJ, et al; American Society of Clinical Oncology. Follow-up care, surveillance protocol, and secondary prevention measures for survivors of colorectal cancer: American Society of Clinical Oncology clinical practice guideline endorsement. J Clin Oncol. 2013;31:4465-4470. Toàn văn Tóm lược
- Glynne-Jones L, Wyrwicz E, Tiret G, et al. Rectal cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28(suppl 4):iv22-iv40. Toàn văn
- Primrose JN, Perera R, Gray A, et al; FACS Trial Investigators. Effect of 3 to 5 years of scheduled CEA and CT follow-up to detect recurrence of colorectal cancer: the FACS randomized clinical trial. JAMA. 2014;311:263-270. Toàn văn Tóm lược
- Hua X, Phipps AI, Burnett-Hartman AN, et al. Timing of aspirin and other nonsteroidal anti-inflammatory drug use among patients with colorectal cancer in relation to tumor markers and survival. J Clin Oncol. 2017;35:2806-2813. Tóm lược
Hình ảnh


Những người có đóng góp
// Các tác giả:
David E. Stein, MD, FACS, FASCRS
Associate Dean Clinical Operations
Chief, Division of Colorectal Surgery, Drexel University College of Medicine, Philadelphia, PA
CÔNG KHAI THÔNG TIN: DES declares that he has no competing interests.
// Lời cảm ơn:
Dr David E. Stein would like to gratefully acknowledge Dr Najjia Mahmoud, Dr Emily Carter Paulson, Dr Gary Atkin, Dr Anne Ballinger, Dr Mark O’Hara, Dr Mark Harrison, and Dr Robert Glynne-Jones, previous contributors to this topic. NM, ECP, MOH, GA, and AB declare that they have no competing interests. MH is the chair of the Mount Vernon Upper GI Tumour Site Specific Group and a member of the National Cancer Research Institute anal, rectal, and advanced colorectal groups. He has also received honoraria for speaking and has been supported to attend international meetings in GI cancer from Roche. He has also received research funding from Pfizer for a trial in rectal cancer. RGJ is the chief medical adviser to the charity Bowel Cancer UK. He has received honoraria for lectures from Roche, Sanofi, and Pfizer. He has received funding for the EXTRA study, involving capecitabine and radiotherapy in anal cancer, published in the International Journal of Radiation Biology Physics. RGJ has also received funding and free cetuximab for an ongoing phase I/II study integrating cetuximab into chemoradiation in rectal cancer, and has an agreement from Roche to supply bevacizumab for 3 months to 60 patients in one randomised phase II study as neoadjuvant chemotherapy in rectal cancer (BACCHUS). He has also been supported by Roche to attend international meetings in GI cancer.
// Những Người Bình duyệt:
Susan Clark, BChir, MB
Consultant Colorectal Surgeon
St Mark’s Hospital and Academic Institute, Northwick Park, Middlesex, UK CÔNG KHAI THÔNG TIN: SC declares that she has no competing interests.
Steven Wexner, MD, FACS, FRCS, FRCS Ed, FASCRS, FAC
Chief of Staff
Chairman, Department of Colorectal Surgery, Cleveland Clinic, Weston, FL CÔNG KHAI THÔNG TIN: SW declares that he has no competing interests.
Xem thêm:
Viêm nội tâm mạc: Nguyên nhân, chẩn đoán và hướng dẫn điều trị theo BMJ

