Bệnh hô hấp
Viêm phổi bệnh viện: Nguyên nhân, triệu chứng, chẩn đoán và hướng dẫn điều trị theo BMJ
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nhà thuốc Ngọc Anh – Để tải bài viết Viêm phổi bệnh viên: Nguyên nhân, triệu chứng, chẩn đoán và hướng dẫn điều trị theo BMJ file PDF xin vui lòng click vào link ở đây.
Tóm tắt
◊ Hầu hết các ca bệnh do vi khuẩn gây ra, nhất là trực khuẩn hiếu khí gram âm, như các loài Pseudomonas
aeruginosa, Escherichia coli, Klebsiella pneumoniae, và Acinetobacter.
◊ Bệnh nhân bị viêm phổi mắc phải trong bệnh viện thường có biểu hiện kết hợp sốt (hoặc hạ thân nhiệt), tăng bạch cầu (hoặc giảm bạch cầu), tăng tiết dịch khí quản, và bão hoà oxy kém. Bóng phế nang trên ảnh chụp CXR hoặc CT hỗ trợ chẩn đoán.
◊ Cần có kết quả nuôi cấy dịch hô hấp dưới trước khi bắt đầu thuốc kháng sinh; cần sử dụng kết quả nuôi cấy để xuống thang thuốc kháng sinh và tập trung vào mầm bệnh gây bệnh.
◊ Ban đầu cần sử dụng thuốc kháng sinh phổ rộng cho bệnh nhân có các yếu tố nguy cơ có mầm bệnh đa kháng
thuốc
Thông tin cơ bản
Định nghĩa
Viêm phổi mắc phải từ bệnh viện (HAP) là nhiễm trùng đường hô hấp dưới cấp tính mà theo định nghĩa mắc phải sau khi nhập viện ít nhất 48 tiếng và không ủ bệnh khi nhập viện.[1] Biểu hiện HAP hiện khác với viêm phổi do thở máy (VAP), được định nghĩa là viêm phổi xảy ra sau khi đặt nội khí quản hơn 48 tiếng. Viêm phổi liên quan đến chăm sóc sức khỏe (HCAP) không còn được xem là dạng biểu hiện lâm sàng trong hướng dẫn gần đây nhất đối với HAP và VAP của Hội Bệnh Truyền Nhiễm và Hội lồng ngực Hoa Kỳ.
Dịch tễ học
Nhờ cải thiện những biện pháp phòng ngừa UTI ở bệnh viện, nay HAP và viêm phổi do thở máy (VAP) là các nhiễm khuẩn bệnh viện thường gặp nhất (chiếm 22% trong tổng số ca bệnh).[3] Khi HAP xảy ra trong ICU, chủ yếu là VAP.
Các báo cáo cho biết rằng từ 5 đến 10 trong 1000 bệnh nhân được nhập viện tiến triển HAP.[4] Đặt nội khí quản liên quan đến tỷ lệ cao hơn, và một nửa ca bệnh được kê thuốc kháng sinh trong ICU là để điều trị HAP hoặc VAP [5] HAP kéo dài thời gian nằm viện từ 7 đến 11 ngày.[6] [7] Hầu hết các ca bệnh được chẩn đoán trong vòng 5 ngày sau khi nhập viện là do vi khuẩn nhạy cảm, trừ khi bệnh nhân sử dụng thuốc kháng sinh trong vòng 90 ngày qua.[8] Bệnh nhân HAP được chẩn đoán sau 5 ngày thường bị viêm phổi do vi khuẩn kháng thuốc.[8] Tỷ lệ tử vong thô do HAP có thể cao từ 30% đến 70%, nhưng nhiều bệnh nhân tử vong do bệnh nền hơn là do chính HAP.[8] Tỷ lệ tử vong quy bổ vào khoảng 10%.[9] Tỷ lệ tử vong tăng cao liên quan đến nhiễm khuẩn huyết, nhất là do Acinetobacter hoặc Pseudomonas.[8] [10]
Điều này cũng liên quan đến vấn đề nội khoa, trái với ngoại khoa, bệnh tật và thuốc kháng sinh theo kinh nghiệm không hiệu quả.[10] Khoảng 10% đến 20% bệnh nhân bị bỏng có tổn thương do hít khói, dẫn đến VAP.[11]
Bệnh căn học
Vi khuẩn gây ra hầu hết các ca bệnh HAP và viêm phổi do thở máy (VAP), nhất là trực khuẩn hiếu khí gram âm như các loài Pseudomonas aeruginosa, Escherichia coli, Klebsiella pneumoniae, và Acinetobacter. Bên cạnh tụ cầu vàng nhạy cảm với methicillin (MSSA), cả hai chủng MRSA mắc phải tại bệnh viện và mắc phải trong cộng đồng đang ngày càng gây ra các ca bệnh HAP.[12] [13] Các vi khuẩn hội sinh họng hầu (liên cầu khuẩn nhóm viridans, tụ cầu khuẩn coagulase âm tính, các chủng Neisseria, và chủng Corynebacterium) và vi khuẩn yếm khí hiếm khi là nguyên nhân gây HAP. Bệnh nhân sử dụng thuốc kháng sinh hoặc tiếp cận cơ sở y tế bên ngoài bệnh viện chăm sóc cấp tính có thể nhiễm mầm bệnh đa kháng thuốc (MDR) khu trú và có nguy cơ nhiễm HAP do những mầm bệnh này (ví dụ như P aeruginosa và MRSA).[3] Mẫm bệnh MDR cũng có thể khu trú trong ICU; do đó, khuyến nghị tích cực theo dõi các ca nhiễm khuẩn trong ICU.[3] HAP ở bệnh nhân trong phòng bệnh có thể là do các mầm bệnh ít được biết là gây nhiễm khuẩn bệnh viện như các loài Streptococcus pneumoniae và Legionella.[14] HAP do Legionella pneumophila có tính rời rạc, nhưng thường gặp hơn với nhóm huyết thanh 1 khi có trong nguồn cấp nước hoặc đang có công trình xây dựng.[15] Căn nguyên vi-rút và nấm cũng hiếm gặp, nhưng tỷ lệ mắc bệnh cho từng nguyên nhân có thể khá cao (ví dụ như nếu đợt bùng phát bệnh cúm xảy ra hoặc có Aspergillus trong ống cho ăn đối với bệnh nhân bị ức chế miễn dịch).[16] [17]
Sinh lý bệnh học
Con đường đưa vi khuẩn vào phế nang thường gặp nhất là hít phải một lượng nhỏ mầm bệnh họng hầu hay rò rỉ chất tiết có chứa vi khuẩn quanh cuff ống nội khí quản.[18] Các con đường khác bao gồm hít sặc lượng lớn (ví dụ như chất nôn), hít phải, lan qua đường máu từ đường truyền tĩnh mạch bị nhiễm trùng, nhiễm trực tiếp (ví dụ như chọc dò màng phổi), và dịch chuyển từ đường tiêu hóa.[19] Các yếu tố quan trọng dẫn bệnh nhân đến những con đường nói trên bao gồm mức độ nghiêm trọng của bệnh nền, tình trạng phẫu thuật trước đây, sử dụng thuốc kháng sinh, các loại thuốc khác, và sử dụng các thiết bị và dụng cụ hô hấp xâm lấn ở bệnh nhân.[20] Nguồn mầm bệnh gây HAP bao gồm thiết bị chăm sóc sức khỏe (màng sinh học bị nhiễm bệnh trong ống nội khí quản), môi trường (không khí, nước, thiết bị, và đồ vật truyền bệnh), và truyền vi sinh vật từ bệnh nhân sang bệnh nhân khác thông qua nhân viên y tế (vệ sinh tay kém).[21] [22] Cuối cùng, xoang có thể là ổ chứa mầm liên quan đến chăm sóc sức khỏe góp phần vào HAP.[23] Khả năng bám dính của vi khuẩn là một bước quan trọng trong quá trình sinh bệnh.[24] Ở bệnh nhân HAP, quần thể vi khuẩn nội sinh của họ tiếp tục tạo nguồn khu trú đường thở trên. Có thể ưu tiên vi khuẩn gram âm vì lượng protease trong nước bọt tăng, do đó fibronectin từ bề mặt tế bào má bị mất, dẫn đến độ bám dính và khu trú niêm mạc đường thở với trực khuẩn gram âm tăng. Thông thường, các tế bào niêm mạc được phủ một lớp fibronectin, chọn lựa cho vi khuẩn gram dương bám dính.[24]
Phân loại
Hội lồng ngực Hoa Kỳ; Hội Bệnh Truyền Nhiễm Hoa Kỳ[1]
Viêm phổi mắc phải từ bệnh viện (HAP)
• Nhiễm trùng đường hô hấp dưới cấp tính mắc phải sau khi nhập viện 48 tiếng.
Viêm phổi do thở máy (VAP)
• Viêm phổi xảy ra từ >48 đến 72 giờ sau khi đặt nội khí quản.
Phòng ngừa
Ngăn ngừa sơ cấp
Có thể tập trung phòng ngừa những vấn đề liên quan đến việc kiểm soát nhiễm khuẩn, tránh các hủ thuật/phơi nhiễm nhất định, và các chiến lược điều trị đặc hiệu.
Kiểm soát nhiễm khuẩn
• Vệ sinh tay là chiến lược phòng ngừa ban đầu quan trọng nhất mà nhân viên y tế có thể thực hiện, vì chiến lược này giúp phòng ngừa lây truyền mầm bệnh đa kháng thuốc (MDR) gây HAP, như Acinetobacter.[30] [37] [38] • Cần sử dụng thường qui các biện pháp kiểm soát nhiễm khuẩn khác như hướng dẫn đào tạo cho nhân viên và cách ly để giảm nhiễm khuẩn chéo với các mầm bệnh MDR.[3] • Giám sát các ca nhiễm khuẩn trong ICU thực hiện với một vài công việc: nhận biết và định lượng mầm bệnh hiện hành dịch và mầm bệnh MDR mới, chuẩn bị đúng lúc dữ liệu để kiểm soát nhiễm khuẩn, và hướng dẫn điều trị kháng sinh thích hợp ở bệnh nhân nghi ngờ HAP.[3] • Nếu không áp dụng biện pháp phòng ngừa và kiểm soát nhiễm khuẩn, bệnh nhân có thể được nhập viện mà không bị nhiễm khuẩn và được xuất viện với bệnh rất nặng, hoặc thậm chí tử vong trước khi xuất viện. Quy trình bắt đầu từ vi khuẩn MDR cứ trú, tiến đến xâm lấn mô vô trùng (ví dụ như phổi, máu) của mầm bệnh khu trú, và kết thúc bằng bệnh (ví dụ như HAP, vãng khuẩn huyết) hoặc thậm chí tử vong.
Cần tránh
• Sử dụng thuốc kháng sinh không cần thiết giúp phòng ngừa vi khuẩn đề kháng thuốc kháng sinh do lưu trú trong ICU và khu trú trong bệnh nhân. Có thể ngăn đặt nội khí quản không cần thiết bằng thông khí áp lực dương không xâm lấn, đó là biện pháp cung cấp oxy và thông khí trung gian cho bệnh nhân giảm hô hấp nhưng không suy hô hấp, và không cần hỗ trợ trong thời gian dài. Một phân tích tổng hợp xem xét 16 thử nghiệm ngẫu nhiên/gẫn ngẫu nhiên và nhận thấy kết quả cải thiện: tỷ lệ viêm phổi do máy thở giảm (VAP), tỷ lệ tử vong thấp, thời gian lưu trú trong ICU ngắn hơn, và thời gian nằm viện ngắn hơn.[39] Phòng ngừa sử dụng thuốc an thần không cần thiết ngăn không đặt nội khí quản cho bệnh nhân chỉ để ‘bảo vệ đường thở của họ’. Gián đoạn sử dụng thuốc an thần cho thấy rút ngắn thời gian đặt nội khí quản, do đó làm giảm ca bệnh VAP.[40] Gián đoạn sử dụng thuốc an thần đòi hỏi phải có thêm nhân viên trong ICU, do đó cần dự kiến nguồn lực có sẵn trước khi thêm cách thức này vào phác đồ. [CDC: National Healthcare Safety Network] [CDC: Healthcare Infection Control Practices Advisory Committee] Chiến lược điều trị đặc hiệu
• Thay ống dẫn máy thở hàng tuần trở thành tiêu chuẩn chăm sóc, mặc dù có dữ liệu cho thấy không cần thiết thay ống dẫn thường qui.[41] [42] Cần duy trì áp lực cuff ở >20 cm H2O. Một cách thức khác thường gặp trong phương pháp ‘gói’ ICU là vệ sinh răng miệng với chlorhexidine.[43] [44]
• Tư thế nửa nằm nửa ngồi 45° cho thấy giảm đáng kể tỷ lệ mắc bệnh VAP được chẩn đoán lâm sàng hơn là tư thế 15° đến 30°.[45] Ống nội khí quản có thể phòng ngừa VAP bằng cách kết hợp các đặc điểm thiết kế giúp giảm vi khuẩn khu trú và hình thành màng sinh học, hoặc bằng cách hút dịch tiết dưới thanh môn mà bệnh nhân có thể hít phải.[46] [47] Các nghiên cứu cho thấy tỷ lệ mắc bệnh VAP khởi phát sơm, và các kết quả khác, giảm đáng kể, khi sử dụng ống nội khí quản chuyên biệt.[40] [46] [47] [48] Máy làm ẩm thụ động hoặc máy trao đổi nhiệt- độ ẩm giúp giảm vi khuẩn cư trú ống dẫn của máy thở không cho thấy giảm tỷ lệ mắc bệnh VAP một cách phù hợp.[49] Về men vi sinh, một phân tích tổng hợp 5 thử nghiệm ngẫu nhiên có đối chứng kết luận rằng khi sử dụng chúng giúp giảm tỷ lệ VAP và thời gian lưu trú tại ICU, nhưng không làm thay đổi tỷ lệ tử vong trong ICU hoặc trong bệnh viện hoặc thời gian thở máy.[50] Tuy nhiên, khử nhiễm tiêu hóa chọn lọc đang ngày càng phổ biến.[51] Ngoài thời gian truyền tĩnh mạch thuốc kháng sinh ngắn, kháng sinh bôi da được sử dụng vào họng-miệng và bao tử để cố gắng giảm thiểu tỷ lệ vi khuẩn gram âm đề kháng tăng quá nhanh, do đó giúp phòng ngừa nhiễm trùng mắc phải trong bệnh viện.
• Thuốc dự phòng điều trị loét do stress tốt nhất không được biết (sucralfate so với chất đối kháng thụ thể H2), nhưng một nghiên cứu lớn nhất từ năm 1998, ưu tiên chất đối kháng H2 (ranitidine) hơn sucralfate xét về số ca biến cố xuất huyết tiêu hóa quan trọng về mặt lâm sàng. Nghiên cứu không thấy có sự khác biệt đáng kể về tỷ lệ VAP giữa hai loại thuốc, mặc dù trong nhóm sucralfate ít có xu hướng xảy ra VAP hơn.[23] Một phân tích tổng hợp 10 nghiên cúu, nhằm xác định xem chất nào tốt hơn nhận thấy rằng những bệnh nhân sử dụng chất đối kháng thụ thể H2 có tỷ lệ cư trú dạ dày và VAP cao hơn.[28] Trong phân tích tổng hợp này, cả hai loại thuốc đều điều trị xuất huyết dạ dày rõ ràng như nhau.
• Cho ăn qua môn vị (trong ruột non trên) cho thấy liên quan đến VAP ít hơn đáng kể so với cho ăn qua dạ dày ở bệnh nhân thở máy.[52] Nhiều hoạt động phòng ngừa này được kết hợp với nhau trong ‘các gói’ để nhân viên y tế thực hành một cách toàn diện. Các gói đó bị chỉ trích là thiếu sự chăm sóc theo cá nhân và có thể dẫn đến việc thực hiện công việc có thể thật sự gây hại cho các bệnh nhân nhất định. Một nghiên cứu tiền cứu ở Hà Lan so sánh tỷ lệ tử vong giữa 52 khoa ICU tham gia chương trình gói nhiễm khuẩn huyết với 30 khoa ICU không tham gia.[53] Nghiên cứu cho thấy tỷ lệ tử vong trong bệnh viện giảm (tỷ suất OR được hiệu chỉnh trong một tháng = 0,992 [0,986-0,997]) tương đương 5,8% tỷ lệ tử vong giảm trong 3,5 năm tại ICU sử dụng chương trình gói nhiễm khuẩn huyết.
Ngăn ngừa thứ cấp
Có thể chỉ định vắc-xin cúm cho những bệnh nhân ở cơ sở đang xảy ra đợt bùng phát, hoặc những bệnh nhân đáp ứng tiêu chí địa phương. Viêm phổi do vi khuẩn có thể xảy ra sau khi cúm, do đó tiêm chủng rất quan trọng. Nếu chẩn đoán cúm, điều trị kháng vi-rút sớm với chất ức chế neuraminidase phòng ngừa lây lan cúm và viêm phổi trong cơ sở y tế.[3] [16] Tất cả các nhân viên y tế cần được tiêm vắc-xin cúm trừ khi chống chỉ định.[126] Không có chỉ định cụ thể vắc-xin polysaccharide ngừa phế cầu khuẩn (PPSV23) đối với bệnh nhân được nhập viện, nhưng có thể giúp phòng ngừa nhiễm trùng do Streptococcus pneumoniae ở bệnh nhân có bệnh đồng mắc. Vắc-xin ngừa phế cầu khuẩn có vỏ polysaccharide đã được tinh khiết từ 23 kháng nguyên và được chỉ định cho bệnh nhân trên 65 tuổi, hoặc có bệnh đồng mắc.[127] Chỉ định vắc-xin mới ngừa S pneumoniae, vắc-xin liên hợp phế cầu khuẩn (PCV13) cho người lớn trên 50 tuổi. [CDC: pneumococcal vaccination: who needs it?]
Chẩn đoán
Tiền sử ca bệnh
Tiền sử ca bệnh #1
Một bệnh nhân nam 55 tuổi có tiền sử bệnh mạch máu ngoại vi, có biểu hiện khó chịu do loét ở bàn chân phải và đau khi đi lại từng quãng ngắn, được phát hiện thấy hẹp vùng khoeo và được nhập viện để tái thông mạch. Bốn ngày sau khi nhập viện, vào ngày thứ 3 sau khi phẫu thuật, ông ấy xuất hiện thở nông, giảm oxy máu, và ho có đờm. Nghe phổi thấy giảm thông khí dưới nửa ngực phải của ông ấy. Số lượng bạch cầu vào buổi sáng của ông ấy hơi cao hơn ngày hôm trước và ở mức 11.000 tế bào/mL^3. XQ ngực thẳng theo hướng trước-sau tại giường bệnh cho thấy hình ảnh mờ ở thùy dưới bên phải.
Tiền sử ca bệnh #2
Một bệnh nhân nữ 88 tuổi sống ở viện dưỡng lão, thường không đến bệnh viện chăm sóc cấp tính, thường có UTI được bác sĩ tại viện dưỡng lão điều trị. Tại viện dưỡng lão, bà ấy tiến triển UTI do mầm bệnh đa kháng thuốc. Khi nhập viện, bà ấy có trạng thái tinh thần kém và đầu giường của bà ấy được nâng lên một góc chỉ 5°. Vào ngày thứ 4 nằm viện, XQ ngực thẳng cho thấy hình ảnh mờ ở thùy dưới bên phải.
Các bài trình bày khác
Bệnh nhân bị HAP thường có biểu hiện kết hợp sốt (hoặc hạ thân nhiệt), tăng bạch cầu (hoặc giảm bạch cầu), tăng tiết dịch khí quản, và bão hoà oxy kém. Hình ảnh mờ trên ảnh chụp CXR hoặc CT hỗ trợ chẩn đoán. Các nghiên cứu cho thấy rằng khi bắt đầu phác đồ kháng sinh chính xác sớm sẽ đem đến kết quả tốt hơn.[2] Đánh giá lại bệnh nhân để xác định chẩn đoán HAP nhằm xem việc cần điều trị kháng sinh là thích hợp. Nói chung, nhiều bệnh kết hợp làm diễn biến ở bệnh nhân HAP trở nên tệ hơn.
Cách tiếp cận chẩn đoán từng bước
Chẩn đoán HAP cần kết hợp bất thường trên hình ảnh cộng với 2 trong 3 đặc điểm lâm sàng: sốt >38°C (100,4°F), tăng bạch cầu hoặc giảm bạch cầu, hoặc đờm mủ.[1] Các triệu chứng khác có thể bao gồm ho, đau ngực, hoặc khó chịu. Các dấu hiệu khám lâm sàng có thể bao gồm nở ngực bất đối xứng, giảm cộng hưởng, nghe phổi bất thường (tiếng dê kêu, tiếng nói thì thầm ở ngực, tiếng ran nổ, hoặc tiếng ran ngáy), hoặc nhịp tim nhanh. Cần tối ưu hóa thông tin có được từ phim chụp, chọc dò màng phổi, bổ sung oxy, và nhuộm Gram.
Cần nghi ngờ HAP/viêm phổi do thở máy (VAP) cao vì tỷ lệ tử vong thấp hơn khi sớm bắt đầu điều trị chính xác sớm. Với nỗ lực ngăn ngừa việc bắt đầu và duy trì kháng sinh trong nhiều tuần, Điểm nhiễm trùng phổi lâm sàng (CPIS)[54] được tạo ra để cung cấp iệu trình kháng sinh đầy đủ, nhưng ngắn hơn.
Tiền sử và khám lâm sàng
Tiền sử cần xác định xem khi nào bệnh nhân có nguy cơ viêm phổi do mầm bệnh đa kháng thuốc (MDR) (ví dụ như Pseudomonas aeruginosa, Klebsiella pneumoniae, và MRSA) gây ra không. Đây là điều quan trọng cần xác lập, vì nó ảnh hưởng đến các lựa chọn kháng sinh theo kinh nghiệm. Những yếu tố nguy cơ đối với viêm phổi MDR là:• Liệu pháp kháng sinh trong 90 ngày trước đó
• Sốc nhiễm khuẩn tại thời điểm VAP
• Hội chứng suy hô hấp cấp tính trước khi VAP
• Nằm viện trong hơn 5 ngày gần đây
• Điều trị thay thận cấp tính trước khi khởi phát VAP.
Chụp ngực và chọc dò màng phổi chẩn đoán
Cần chụp ngực cho thấy hình ảnh mờ, khu trú hoặc lan toàn để chẩn đoán. Thường chụp XQ ngực thẳng cho tất cả bệnh nhân dù trong khoa bệnh viện hay trong ICU. Phim chụp sau-trước với ảnh chụp nhìn thấy phía bên được ưu tiên hơn. Có thể cần chụp CT, nhất là nếu ảnh chụp x-qung có chất lượng kém hoặc có độ mờ đục không rõ ràng.
Nếu nhìn thấy dịch màng phổi trên ảnh chụp XQ ngực thẳng và số lượng được xem là nhiều hơn mức tối thiểu, cần thực hiện chọc dò màng phổi chẩn đoán. Các xét nghiệm từ dịch màng phổi cho thấy rằng cần dẫn lưu khoang màng phổi là pH <7,20, mức glucose <2,2 mmol/L (<40 mg/dL), và mức LDH >1000 U/L.
Tình trạng bão hoà oxy
Phương pháp ưa dùng để xác định tình trạng bão hoà oxy là từ ABG. Độ bão hoà oxy lấy từ vị trí ngoại biên có thể cho cảm giác bổ sung oxy đầy đủ giả, nhất là khi có các dấu hiệu và triệu chứng HAP khi sự phân bổ mạch có thể bị co thắt ngoại biên. Lấy ABG trong khi bệnh nhân chưa được tăng FiO2 phản ánh chính xác hơn tình trạng bổ sung oxy, nhưng rõ ràng là không cần duy trì mức oxy tăng ở bất kỳ bệnh nhân không ổn định nào.
Nhuộm gram
Có thể nhuộm Gram từ dịch hút khí quản, dịch rửa phế quản-phế nang (BAL), hoặc chổi quét mẫu bệnh phẩm có bảo vệ.[56] Cũng có thể lấy mẫu nhuộm từ lần khạc đờm, nhưng không khuyến nghị sử dụng vì mẫu đường hô hấp được đề cập ở phần trên thích hợp hơn.[8] Nếu dự kiến soi phế quản nhưng cần sử dụng kháng sinh trước khi thực hiện thủ thuật, mà điều này có thể cản trở mầm bệnh phát triển khi nuôi cấy, cần lấy mẫu hút khí quản (dịch phế quản không soi phế quản) hoặc lần khạc đờm đê nuôi cấy. Một số bằng chứng gợi ý rằng điều trị dựa trên hút nội khí quản đem đến kết quả tương đương như dựa trên mẫu bệnh phẩm BAL.[57]
Xét nghiệm máu
Không cần chẩn đoán nhiễm trùng chỉ bằng số lượng bạch cầu, nhưng số lượng bạch cầu tăng kèm theo tăng bạch cầu hạt và tỷ lệ các dải có thể liên quan đến HAP khi có hình ảnh mờ đục trên XQ ngực thẳng và các dấu hiệu và triệu chứng khác. Giảm bạch cầu có thể cho thấy bệnh nặng hơn, hay thậm chí nhiễm khuẩn huyết.
Trong hướng dẫn của Hội Bệnh Truyền Nhiễm Hoa Kỳ và Hội lồng ngực Hoa Kỳ (IDSA/ATS) năm 2016 về HAP/ VAP đã giảm nhẹ vai trò của CRP, trong đó khuyến nghị rằng CRP hỗ trợ kiểm tra lâm sàng khi quyết định bắt đầu điều trị kháng sinh.[1]
procalcitonin
Procalcitonin mới xuất hiện như là dấu ấn sinh học triển vọng để chẩn đoán nhiễm khuẩn, do nó có xu hướng tăng trong các trường hợp nhiễm khuẩn nặng hơn so với nhiễm vi-rút. Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ đã phê duyệt sử dụng procalcitonin làm xét nghiệm để hướng dẫn điều trị kháng sinh ở những bệnh nhân bị nhiễm trùng đường hô hấp cấp. Xem xét Cochrane nhận thấy rằng procalcitonin có thể giúp quyết định về thuốc kháng sinh ở bệnh nhân HAP.[58] Hướng dẫn của IDSA/ATS năm 2016 về HAP/VAP nêu cụ thể rằng procalcitonin không hỗ trợ khi quyết định bắt đầu điều trị kháng sinh, nhưng cần sử dụng khi quyết định ngưng chất này (xuống thang) ở bệnh nhân mà chẩn đoán ban đầu dường như không có giá trị sau khoảng 3 ngày kể từ khi có thông tin lâm sàng mới.[1]
Các yếu tố nguy cơ
Mạnh kiểm soát nhiễm khuẩn/vệ sinh tay kém
• Các mầm bệnh gây HAP, như Acinetobacter baumannii, truyền từ tay của nhân viên y tế sang bệnh nhân.
đặt nội khí quản và thở máy; áp lực cuff nội khí quản <20 cm H2O
• Con đường đưa vi khuẩn vào phế nang thường gặp nhất là hít phải một lượng nhỏ mầm bệnh ở họng hầu hay rò rỉ chất tiết có chứa vi khuẩn quanh cuff ống nội khí quản.[18]
• Nguồn mầm bệnh gây HAP bao gồm thiết bị chăm sóc sức khỏe (màng sinh học bị nhiễm bệnh trong ống nội khí quản), môi trường (không khí, nước, thiết bị, và đồ vật truyền bệnh), và truyền vi sinh vật từ bệnh nhân này sang bệnh nhân khác thông qua nhân viên y tế.[21] [22]
• Đối với những bệnh nhân được đặt nội khí quản, tỷ lệ viêm phổi do máy thở (VAP) là 6 đến 20 bệnh nhân trong 1000 bệnh nhân được nhập viện. Tỷ lệ này cao hơn tỷ lệ HAP, là 5 đến 10 bệnh nhân trong 1000 bệnh nhân được nhập viện. Bệnh nhân được đặt nội khí quản đường mũi có nguy cơ cao hơn những bệnh nhân được đặt nội khí quản đường miệng.
Yếu đầu giường nâng một góc <30°
• Các nghiên cứu sử dụng kiểu cho ăn qua đường ruột được đánh dấu phóng xạ ở bệnh nhân thở máy nhận thấy rằng vị trí nằm ngửa đẩy nhanh sự hít phải dịch tiết.[25] Một nghiên cứu khác nhận thấy rằng tỷ lệ bệnh viêm phổi do máy thở (VAP) giảm đáng kể ở bệnh nhân được duy trì tư thế nửa nằm nửa ngồi so với những bệnh nhân nằm ngửa.[26] Do đó, Hội lồng ngực Hoa Kỳ, Hội Bệnh Truyền Nhiễm Hoa Kỳ, và Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh khuyến nghị nâng đầu giường, và ý kiến này được hầu hết các bác sĩ ủng hộ mặc dù có bằng chứng kém thuyết phục hỗ trợ cách thức này.[27] Vẫn có nhiều nỗ lực tiếp tục thu thập bằng chứng thuyết phục hơn.
Chất đối kháng H2 và sử dụng chất trung hòa axit dạ dày
• Có các nghiên cứu mâu thuẫn về việc sử dụng sucralfate để dự phòng loét do stress so với chất đối kháng H2 hoặc chất trung hòa axit dạ dày, nhưng có xu hướng ít xảy ra viêm phổi do máy thở (VAP) khi sử dụng sucralfate. Trong một nghiên cứu lớn nhất, từ năm 1998, những bệnh nhân bệnh nặng cần thở máy được cho dùng chất đối kháng H2 (ranitidine) hoặc sucralfate. Những bệnh nhân sử dụng ranitidine có tỷ lệ xuất huyết tiêu hóa quan trọng về mặt lâm sàng thấp hơn đáng kể so với bệnh nhân sử dụng sucralfate. Không có sự khác biệt đáng kể về tỷ lệ VAP, thời gian lưu trú trong đơn vị chăm sóc tích cực, hay tỷ lệ tử vong, mặc dù trong nhóm sucralfate ít có xu hướng xảy ra VAP hơn.[23] Phân tích tổng hợp kết luận rằng điều trị xuất huyết bằng chất đối kháng H2 hay sucralfate không có hiệu quả khác biệt, nhưng sucralfate có tỷ lệ khu trúi khuẩn lưu trú dạ dày và VAP thấp hơn.[28] Một nghiên cứu đoàn hệ lớn nhận thấy rằng chất đối kháng H2 liên quan đến nguy cơ viêm phổi ít hơn so với thuốc ức chế bơm proton ở bệnh nhân thở máy.[29]
Vệ sinh răng miệng kém
• CDC khuyến nghị thực hành vệ sinh răng miệng, dựa trên các nghiên cứu cho thấy rằng vệ sinh răng miệng giúp giảm HAP[3] [30] hoặc VAP.[31] Một phân tích tổng hợp đánh giá 11 nghiên cứu tiến cứu thảo luận về một vài vấn đề với các biện pháp của họ.[32] Hầu hết các bệnh nhân được phẫu thuật bắt cầu động mạch vành cho thấy vệ sinh răng miệng tốt.[33]
Không gián đoạn sử dụng thuốc an thần
• Gián đoạn sử dụng thuốc an thần cho thấy rút ngắn thời gian đặt nội khí quản, do đó làm giảm ca bệnh viêm phổi do máy thở (VAP).[34] [35] Gián đoạn sử dụng thuốc an thần đòi hỏi phải có thêm nhân viên trong ICU, do đó cần dự kiến nguồn lực có sẵn trước khi thêm cách thức này vào phác đồ.
Tái đặt nội khí quản
• Tái đặt nội khí quản là yếu tố nguy cơ tiến triển VAP. Mối liên quan mạnh hơn nếu rút ống ngoài dự kiến so với theo kế hoạch hoặc nếu bệnh nhân sau khi phẫu thuật tim.[36]
Các yếu tố về tiền sử và thăm khám
Các yếu tố chẩn đoán chủ yếu
Có các yếu tố nguy cơ (thường gặp)
• Yếu tố nguy cơ quan trọng bao gồm kiểm soát nhiễm trùng kém và đặt nội khí quản và thở máy; áp lực cuff nội khí quản <20 cm H2O
Khó thở (thường gặp)
• Một triệu chứng tại chỗ cũng có thể có nhiều chẩn đoán phân biệt, do đó mặc dù biểu hiện trong hầu hết các ca bệnh HAP, cần xem xét các chẩn đoán nghiêm trọng khác (ví dụ như thuyên tắc phổi).
Ho có đờm (thường gặp)
• Một triệu chứng khu trú có thể liên quan đến toàn trạng ho của bệnh nhân. Ví dụ như bệnh nhân với COPD thường bị ho có đờm trắng.
• HAP thường kèm theo ho có đờm đặc màu vàng hoặc màu xanh lá cây.
Sốt (thường gặp)
• Dấu hiệu toàn thân của nhiễm trùng có thể xảy ra, nhưng không đặc hiệu đối với HAP. Sốt có dộ đặc hiệu thấp và độ nhạy cảm cao đối với HAP. Bệnh nhân bệnh nặng có thể biểu hiện hạ thân nhiệt.
Các yếu tố chẩn đoán khác
Đau ngực (thường gặp)
• Một triệu chứng khu trú có thể biểu hiện do tổn thương màng phổi của HAP, hoặc thứ phát do sử dụng quá nhiều cơ liên sườn sau khi ho dai dẳng.
Nở ngực bất đối xứng (thường gặp)
• Điều này có thể được ghi nhận với chuyển động giảm ở một bên bị viêm phổi. Ít có khả năng nhận thấy dấu hiệu này trong viêm phổi hai bên.
Cộng hưởng giảm (thường gặp)
• Cộng hưởng cũng có thể bị giảm ở bên bị viêm phổi theo ghi nhận khi khám ngực của bệnh nhân trong khi họ nói ’99’. Ít có khả năng nhận thấy dấu hiệu này trong viêm phổi hai bên.
Tiếng dê kêu (thường gặp)
• Dấu hiệu khu trú nghe thấy ở vị trí phổi bị ảnh hưởng. Giọng nói của bệnh nhân thay đổi Khi được yêu cầu phát âm ‘eee’, nghe thấy như là ‘aaa’.
Tiếng nói thì thầm ở ngực (thường gặp)
• Dấu hiệu khu trú nghe thấy ở vị trí phổi bị ảnh hưởng. Nghĩ tới khi một tiếng thì thầm nghe được to và rõ khi khám nghe vùng phổi tổn thương.
Tiếng ran hoặc ran ngáy (thường gặp)
• Dấu hiệu khu trú nghe thấy ở vị trí phổi bị ảnh hưởng.
Nhịp tim nhanh (thường gặp)
• Có thể là một dấu hiệu khu trú hoặc toàn thể với tính đặc hiệu cao và độ nhạy cảm thấp đối với HAP. Sốt toàn thân có thể gây nhịp tim nhanh, nhưng nếu có biểu hiện tràn dịch màng tim liên quan đến HAP, nhịp tim nhanh có thể là do nguyên nhân khu trú hơn.
Tình trạng khó chịu/biếng ăn (thường gặp)
• Các triệu chứng toàn thân thường gặp trong HAP, nhưng không đặc hiệu.
Xét nghiệm thứ nhất cần yêu cầu
Xét nghiệm chẩn đoán
| Xét nghiệm Kết quả | |
| CXR
• Cần thực hiện khi có bất kỳ nghi ngờ nào đối với HAP. Ưu tiên phim sau- trước và phía bên hơn là nhìn từ trước-sau. Cần so sánh phim sớm hơn nếu có. • Tất cả ảnh chụp XQ ngực thẳng bị hạn chế do thiếu sự phân biệt giữa hình ảnh mờ đục phế nang và dịch phổi. • Có thể chỉ định chụp CT để chẩn đoán độ mờ đục và làm rõ xem có cần chỉ định thủ thuật không. [Fig-3] |
hình ảnh cơ hoành hoặc bờ tim mờ đục, không rõ nét |
| Đếm số lượng bạch cầu có đếm thành phần bạch cầu
• Có thể tăng với nhiễm trùng nói chung, nhưng thường không đặc hiệu. Tăng bạch cầu đa nhân trung tính chưa trưởng thành (dải băng) là mối quan ngại nếu trên 4%, và giảm bạch cầu là mối quan ngại khi có dưới 4.000 tế bào/ mL3. |
số lượng bạch cầu tăng hoặc giảm trên hoặc dưới giá trị bình thường của phòng xét nghiệm tại địa phương và/hoặc dải băng tăng % |
| đầu đo bão hòa oxy qua da
• Bão hoà oxy được đo bằng thiết bị đo độ bão hòa oxy có thể cao một cách sai lệch so với số đo có được bằng ABG. |
giá trị thấp; <88% đến <92% nói chung, nhưng liên quan đến bệnh lý ban đầu của bệnh nhân và oxy bổ sung |
| nuôi cấy bệnh phẩm đường hô hấp dưới
• Mẫu quét chổi bệnh phẩm có bảo vệ (thông qua soi phế quản) được xem là chính xác nhất, tiếp theo là rửa phế quản-phế nang, và hút nội khí quản thông qua ống nội khí quản, nhưng hiện nay lấy mẫu không xâm lấn (hút nội khí quản) với nuôi cấy bán định lượng cho thấy tốt hơn lấy mẫu xâm lấn hoặc không xâm lấn với nuôi cấy định lượng.[1] [57] • Kết quả nuôi cấy dương tính cần tương quan về mặt lâm sàng, vì chúng có thể chỉ đơn thuần là dương tính giả cho thấy bằng chứng khu trú khí quản hoặc âm tính giả sau khi điều trị kháng sinh trước đó. • Nuôi cấy định lượng cung cấp thông tin nhiều hơn mẫu bệnh phẩm định tính, và cần được sử dụng nếu có. |
>10^3 đơn vị hình thành khuẩn lạc (cfu)/ mL đối với mẫu quét chổi bệnh phẩm có bảo vệ; >104 cfu/mL đối với dịch rửa phế quản-phế nang (BAL); >106 cfu/mL đối với dịch hút nội khí quản; 10^4 hoặc 10^5 cfu/mL trong bối cảnh lâm sàng của viêm phổi do máy thở (VAP) |
Các xét nghiệm khác cần cân nhắc
| Xét nghiệm Kết quả | |
| ABG
• Nếu nghi ngờ HAP, ngưỡng làm ABG nên thấp để đảm bảo rằng bệnh nhân không thiếu oxy. • Không thể cung cấp giá trị đặc hiện vì tất cả các giá trị của ABG có thể cao hoặc thấp tùy theo bệnh (như HAP) và mức độ bù trừ của bệnh nhân. |
pO2 thấp; các bất thường giá trị ABG khác có thể có, như những giá trị phù hợp với nhiễm toan chuyển hoá (ví dụ như pH thấp, pCO2 cao) |
| chọc dò màng phổi chẩn đoán
• Cần chọc dò màng phổi nếu lượng dịch màng phổi được xem là cao hơn mức tối thiểu.[59] • Các xét nghiệm dịch màng phổi cho thấy rằng cần dẫn lưu khoang màng phổi là pH <7,20, mức glucose <2,2 mmol/L (<40 mg/dL), và mức LDH >1000 U/ L. |
nhuộm Gram hoặc nuôi cấy dương tính |
| Chụp CT ngực
• Có thể chỉ định chụp CT để chẩn đoán độ mờ đục và làm rõ xem có cần chỉ định thủ thuật không. |
có thể có hình ảnh mờ đục hoặc làm rõ kết quả nếu ảnh chụp x-quang có chất lượng kém |
| CRP
• Trong hướng dẫn của Hội Bệnh Truyền Nhiễm Hoa Kỳ và Hội lồng ngực Hoa Kỳ (IDSA/ATS) năm 2016 về HAP/VAP đã giảm nhẹ vai trò của CRP, trong đó khuyến nghị rằng CRP hỗ trợ đánh giá lâm sàng khi quyết định bắt đầu điều trị kháng sinh.[60] |
tăng |
| procalcitonin
• Một đánh giá Cochrane nhận thấy rằng procalcitonin có thể giúp quyết định về thuốc kháng sinh ở bệnh nhân HAP.[58] Hướng dẫn của IDSA/ATS năm 2016 về HAP/VAP nêu cụ thể rằng procalcitonin không hỗ trợ khi quyết định bắt đầu điều trị kháng sinh, nhưng cần sử dụng khi quyết định ngưng chất này (xuống thang) ở bệnh nhân mà chẩn đoán ban đầu dường như không có giá trị sau khoảng 3 ngày kể từ khi có thông tin lâm sàng mới.[1] |
tăng |
Chẩn đoán khác biệt
| Tình trạng | Các dấu hiệu/triệu chứng khác biệt | Các xét nghiệm khác biệt |
| Phù phổi do tim | • Các triệu chứng suy tim bao gồm khó thở, tĩnh mạch cổ nổi, tiếng ngựa phi S3, và phù nề.
• Biểu hiện đồng thời của HAP như tràn dịch hoặc phù nề khiến việc chẩn đoán trở nên phức tạp. |
• XQ ngực thẳng có thể cho thấy chứng tim to, co kéo thuỳ trên, dịch trong các đường rãnh, tràn dịch màng phổi, và bóng mờ lan toả mô kẽ hoặc phế nang.
• ECG có thể gợi ý về nguyên nhân: ví dụ như MI, chứng thiếu máu cục bộ, hoặc phì đại thất. • Siêu âm tim có thể có tính chẩn đoán. Peptid lợi niệu loại B (BNP) có thể tăng. |
| Hội chứng suy hô hấp cấp tiến triển (ARDS) | • Khó thở và thở nhanh thường gặp trước khi đặt nội khí quản. Nếu ARDS là thứ phát do nhiễm trùng, sẽ biểu hiện sốt. Hơn nữa, sốt là đặc điểm của fibroproliferative ARDS. | • Tỷ số FiO2 với PaO2 <200 hỗ trợ ARDS khi có hình ảnh mờ đục lan tỏa.
• Bệnh nhân thường được đặt nội khí quản và sử dụng thuốc an thần, do đó biện pháp chẩn đoán chung là thấy hình ảnh mờ đục phổi hoàn toàn trên XQ ngực thẳng. |
| Tràn dịch màng phổi | • Có thể ho nặng; có thể biểu hiện viêm màng phổi | • Chụp CT giúp phân biệt dịch từ phổi xẹp vì dịch được giữ lại trong khoang màng phổi, thường tạo ra một đường thẳng rõ ràng trên phim chụp. |
| Thuyên tắc động mạch phổi | • Khởi phát thở nông cấp tính hơn, có khả năng giảm oxy máu, và giảm cacbon dioxit máu. | • Chụp CT xoắn ốc dương tính; kĩ thuật mới giúp phát hiện nghẽn mạch ngoại biên tốt hơn.
• Cần chụp V/Q nếu bệnh nhân không thể sử dụng chất cản quang. |
| Xẹp phổi | • Thường không giảm oxy máu hoặc sốt, mặc dù có thể biểu hiện sốt nhẹ. | • Tăng bạch cầu và đờm có thể có hoặc có thể không biểu hiện.
• Hình ảnh mờ đục trên XQ ngực thẳng có xu hướng tuyến tính hơn là dạng thùy. |
| Xuất huyết phổi | • Ho ra máu với huyết động không ổn định cấp tính. Các triệu chứng ở phổi không đặc hiệu khác bao gồm ho, khó thở, và đau ngực.
• Có thể có tiền sử hội chứng Goodpasture. |
• XQ ngực thẳng cho thấy đầy dịch trong phế nang lan tỏa trong phân bổ vùng rốn phổi hoặc nền phổi. Tuy nhiên, khó phân biệt với phù phổi hoặc quá trình nhiễm trùng lan tỏa. Chục CT có thể phân biệt rõ hơn giữa thâm nhiễm và dịch. Bệnh nhân có thể bị thiếu máu. |
| Ung thư phổi | • Các triệu chứng tương tự, nhưng yếu tố phân biệt là các triệu chứng có thể biểu hiện trong nhiều tuần. | • Chụp CT sẽ có nhiều khả năng hiển thị khối u ở một hình thái khác (nốt) với khả năng là tổn thương di căn của mô khác (xương). |
Các tiêu chí chẩn đoán
Điều trị cho người lớn bị viêm phổi mắc phải tại bệnh viện và viêm phổi do thở máy: hướng dẫn thực hành lâm sàng năm 2016 của Hội Bệnh Truyền Nhiễm Hoa Kỳ và Hội lồng ngực Hoa Kỳ[1]
Chẩn đoán HAP cần hình ảnh tổn thương qua chẩn đoán hình ảnh cộng với 2 trong 3 đặc điểm lâm sàng: sốt >38°C (100,4°F), tăng bạch cầu hoặc giảm bạch cầu, hoặc ho có mủ.
Điều trị
Cách tiếp cận điều trị từng bước
Cần điều trị kháng sinh nhanh chóng, chính xác, và đầy đủ để điều trị HAP.[2] [61] [62] 1[C]Evidence Phác đồ dựa trên biểu hiện của các yếu tố nguy cơ đối với mầm bệnh đa kháng thuốc (MDR). Các yếu tố nguy cơ này là:[8]
• Điều trị kháng sinh trong 90 ngày trước đó
• Sốc nhiễm trùng khi viêm phổi do thở máy (VAP)
• Hội chứng suy hô hấp cấp tính trước khi VAP
• Nằm viện trong hơn 5 ngày gần đây
• Điều trị thay thận cấp tính trước khi khởi phát VAP.
Nếu có biểu hiện các yếu tố nguy cơ nói trên, chỉ định kết hợp điều trị kháng sinh phổ rộng.[64]
Cần sử dụng thận trọng thuốc kháng sinh trong bệnh viện, vì có thể ảnh hưởng đến sự phát triển của các chủng đề kháng, nhất là trong ICU. Các đợt bùng phát MDR, mầm bệnh gram âm xảy ra do sử dụng quá mức beta-lactam hoặc quinolone.[65] Nhìn chung, nếu bất kỳ thuốc kháng sinh nào được ưa thích sử dụng, thì đề kháng thuốc có thể xảy ra. Một nghiên cứu cho biết đợt bùng phát sau khi sử dụng kéo dài thuốc kháng sinh carbapenem (20 ngày) và colistimethate (13 ngày).[66]
Không yêu cầu nhưng sử dụng quy trình kháng sinh được xác định trước ở bệnh nhân mới được chẩn đoán HAP dc khuyến nghị, vì điều này đảm bảo rằng bệnh nhân không bị điều trị thiếu, nhất là điều trị giai đoạn sớm khi bác sĩ có điều kiện làm giảm tỷ lệ tử vong.[2] [54] Quy trình cần có một danh sách các loại thuốc để chọn lựa, và cần xuống thang phác đồ phù hợp sau đó hoặc đề kháng có thể xuất hiện.[8] [54]
Điều trị kháng sinh theo kinh nghiệm
Phác đồ sử dụng kháng sinh theo kinh nghiệm luôn cần tuân theo mô hình kháng thuốc cục bộ; cần thực hiện kháng sinh đồ.[64] Nếu bệnh nhân không có các yếu tố nguy cơ đối với mầm bệnh MDR, mầm bệnh gây viêm phổi có khả năng là Streptococcus pneumoniae, Haemophilus influenzae, tụ cầu vàng nhạy Methicillin (MSSA), hoặc trực khuẩn gram âm đường ruột nhạy thuốc kháng sinh (ví dụ như Escherichia coli, Klebsiella pneumoniae, Enterobacter species, Proteus species, hoặc Serratia marcescens). Điều trị bao gồm đơn trị liệu bao phủ Pseudomonas aeruginosa: cefepime, ceftazidime, imipenem/cilastatin, meropenem, levofloxacin, hoặc piperacillin/tazobactam.[1] [67] [68] Ghi nhận không có aminoglycosides trong danh sách này vì chúng được xem là có nguy cơ nhiều hơn là lợi ích, mặc dù chúng có thể bao phủ P aeruginosa gây HAP/VAP.[69] Nếu bệnh nhân có yếu tố nguy cơ đối với mầm bệnh MDR, mầm bệnh có khả năng là P aeruginosa, K pneumoniae (chủng sinh beta-lactamase phổ rộng [ESBL]), loài Acinetobacter, MRSA, hoặc Legionella pneumophila. HAP/viêm phổi do máy thở (VAP) do một trong những mầm bệnh này có liên quan đến tỷ lệ tử vong cao hơn.[70] Các yếu tố nguy cơ đối với P aeruginosa bao gồm nhuộm Gram có chất lượng cao với trực khuẩn gram âm, và bệnh phổi có cấu trúc. Nếu có một trong những yếu tố này biểu hiện hoặc nếu bệnh nhân được đặt nội khí quản và thông khí nhân tạo, hoặc bị sốc nhiễm khuẩn, cần điều trị kết hợp đối với P aeruginosa. Đối với bệnh nhân có khả năng có mầm bệnh MDR, liệu pháp điều trị cần kết hợp cephalosporin (ví dụ như cefepime, ceftazidime), carbapenem (ví dụ như imipenem/cilastatin, meropenem), beta-lactam/chất ức chế beta-lactamase (ví dụ như piperacillin/tazobactam), hoặc monobactam (ví dụ như aztreonam); cộng với quinolone (ví dụ như ciprofloxacin, levofloxacin) hoặc aminoglycoside (ví dụ như amikacin, gentamicin, tobramycin); cộng với linezolid hoặc vancomycin (hoặc alternatively, telavancin).[8] [68]
Nếu nghi ngờ Pseudomonas là mầm bệnh gây bệnh, cần sử dụng 2 thuốc kháng sinh theo kinh nghiệm với cơ chế tác động khác nhau, kèm theo các phác đồ bao gồm nhiều sự kết hợp khác nhau của beta-lactams kháng pseudomona, carbapenem, quinolone, và aminoglycoside. Có thể sử dụng imipenem/cilastatin hoặc meropenem (thuốc kháng sinh carbapenem), nhưng không nên sử dụng ertapenem, vì nó không bao phủ P aeruginosa và chỉ được chấp thuận sử dụng cho viêm phổi mắc phải trong cộng đồng. Aminoglycoside có khả năng diệt vi khuẩn gram âm nhanh, nhưng có thể gây độc tố thận hoặc nhiễm độc tai. Tobramycin có khả năng thâm nhập vào phổi hơi tốt hơn so với gentamicin, và có thể sử dụng dạng hít, mặc dù đây là phương pháp điều trị mới. Quinolones có tính hiệu quả và ciprofloxacin có phổ tương đối hẹp, nhưng sự đề kháng của Pseudomonas tăng lên hàng năm.
Quinolones cũng có liên quan đến viêm đại tràng do Clostridium difficile. Cả hai aminoglycosides và quinolones là thuốc kháng sinh phụ thuộc vào nồng độ và được định liều để tận dụng đặc điểm này với liều dùng cao và không thường xuyên, trái với thuốc kháng sinh phụ thuộc vào thời gian (ví dụ như beta-lactams), được định liều để duy trì mức độ thuốc trên nồng độ ức chế tối thiểu
(MIC). Một nghiên cứu so sánh tigecycline với imipenem/cilastatin tình cờ nhận thấy rằng hiệu quả của nó không thua kém ở bệnh nhân HAP, nhưng kém hơn ở bệnh nhân VAP.[71] Tigecycline hiện được chấp thuận điều trị viêm phổi mắc phải từ cộng đồng, không phải cho HAP. Hiện nay Tigecycline được cảnh báo rằng chỉ nên sử dụng khi thuốc khác không thích hợp. Đó là do tỷ lệ tử vong tăng (0,6%; 95% CI 0,1, 1,2) liên quan đến việc sử dụng thuốc này. Đối với bệnh nhân VAP, tỷ lệ tử vong do tigecycline là 50,0% so với 7,7% đối với nhóm sử dụng thuốc so sánh.[72] Cuối cùng, phác đồ cần dựa vào kháng sinh đồ của địa phương.
Cần bổ sung vancomycin hoặc linezolid (nghĩa là bệnh nhân sẽ sử dụng 3 thuốc kháng sinh) nếu bệnh nhân có nguy cơ nhiễm MRSA. Các yếu tố nguy cơ MRSA bao gồm sử dụng thuốc kháng sinh trước đó trong nhiều ngày trước, vào ICU có >20% ca phân lập Staphylococcus aureus là MRSA (hoặc tỷ lệ phần trăm không được biết), và có nguy cơ tỷ lệ tử vong cao. Dữ liệu gợi ý rằng linezolid và vancomycin có hiệu lực tương tự. Dữ liệu theo dõi không rõ ràng, gợi ý rằng linezolid và vancomycin tương đương nhau hoặc linezolid ưu việt hơn.[73] [74] [75] [76] [77] [78] 2[B]Evidence
Nếu HAP được chẩn đoán sau khi sử dụng thuốc kháng sinh gần đây hoặc trong khi bệnh nhân đang sử dụng thuốc kháng sinh để điều trị một bệnh nhiễm trùng khác, thì theo kinh nghiệm cần thêm thuốc từ một nhóm khác.[8] [79]
Điều trị kháng sinh theo m bệnh
Khi có kết quả nuôi cấy, cần xuống thang thuốc kháng sinh tương ứng: cần thu hẹp điều trị theo độ nhạy cảm của mầm bệnh cụ thể, hoặc cần ngưng thuốc kháng sinh theo những gì không xuất hiện. Ví dụ như cần tiếp tục linezolid nếu nuôi cấy MRSA, hoặc ngưng nếu không phải.[80] [81]
Các ví dụ về thuốc kháng sinh được sử dụng để điều trị nhiễm trùng gram âm được xác định (ví dụ như Pseudomonas, Acinetobacter, Klebsiella, Serratia) là cephalosporin (cefepime, ceftazidime), hoặc carbapenem (imipenem/cilastatin, meropenem), hoặc chất ức chế beta-lactamase (piperacillin/tazobactam), hoặc a quinolone (ciprofloxacin, levofloxacin), hoặc aminoglycoside (amikacin, gentamicin, tobramycin), hoặc polymyxin (colistimethate). Đơn trị liệu với một loại thuốc kháng sinh là đủ. Tuy nhiên, có thể sử dụng kết hợp 2 loại thuốc nếu nhiễm trùng xảy ra ở vị trí khó thâm nhập như áp-xe phổi, tràn mủ màng phổi, hoặc viêm nội tâm mạc kèm theo. Phác đồ kết hợp có thể bao gồm cephalosporin (cefepime, ceftazidime), carbapenem (imipenem/cilastatin, meropenem), hoặc chất ức chế beta-lactamase (piperacillin/tazobactam), cộng với quinolone (ví dụ như ciprofloxacin, levofloxacin), aminoglycoside (amikacin, gentamicin, tobramycin); hoặc polymyxin (colistimethate). Ceftazidime/ avibactam đã được chấp thuận sử dụng để điều trị HAP và viêm phổi do thở máy (VAP) do vi khuẩn ở bệnh nhân người lớn.[82] Nó có hoạt tính kháng mầm bệnh Gram âm đa kháng thuốc, bao gồm vi khuẩn sinh beta-lactamase phổ rộng (ESBL), và Pseudomonas aeruginosa. Để phòng ngừa đề kháng toàn cầu, cần để dành cho bệnh nhân nhiễm trùng đã được chứng minh hoặc nghi ngờ cao là do vi khuẩn nhạy cảm gây ra, hoặc cho những bệnh nhân có nguy cơ cao với vi khuẩn đa kháng thuốc.
Thông thường, bất kỳ ca nhiễm pseudomonal nào cũng được điều trị với 2 loại thuốc kháng sinh. Một nghiên cứu vào năm 1989 đánh giá bệnh nhân có vãnhiễmng khuẩn huyết do Pseudomonas, bao gồm một số bệnh nhân viêm phổi, cho thấy tỷ lệ tử vong thấp hơn trong những bệnh nhân sử dụng liệu pháp kết hợp.[79] Từ đó, các nghiên cứu cho thấy rằng giữa các bệnh nhân HAP sử dụng đơn trị liệu hoặc kết hợp có kết quả tương tự nhau.[83] [84] [85] 3[C]Evidence Lợi ích của đơn trị liệu bao gồm biến cố bất lợi ít hơn, ít đề kháng hơn, và chi phí thấp hơn.
Ví dụ về mầm bệnh gram dương là nguyên nhân thường gặp gây HAP là S aureus. Các chủng nhạy methicillin được điều trị với penicillin hoặc cephalosporin. Nếu bệnh nhân dị ứng với penicillins, có thể sử dụng linezolid hoặc vancomycin. Điều trị các chủng kháng Methicillin với linezolid hoặc vancomycin.
Nếu Enterobacteriaceae sinh ESBL là nguyên nhân của HAP, thì điều trị bước đầu được khuyến nghị là với thuốc kháng sinh carbapenem. Điều trị bậc hai với quinolone. Không khuyến nghị Cephalosporins, cho dù mầm bệnh nhạy cảm, vì khả năng đề kháng nhanh nếu bắt đầu. Nguyên nhân gây HAP hiếm khi được nhận biết là L pneumophila. Có thể điều trị với quinolone hoặc macrolide.
Thời gian điều trị
Đã có một phương pháp hỗ trợ quyết định xem có cần điều chỉnh điều trị không, hay thậm chí có cần ngưng thuốc không, theo Điểm nhiễm trùng phổi lâm sàng (CPIS).[54]
Vào ngày chẩn đoán, tính CPIS bằng cách đánh giá 5 đặc điểm lâm sàng, mỗi đặc điểm được cho điểm từ không đến 2 điểm dựa trên mức độ nghiêm trọng của tiêu chí (cao hơn là tệ hơn):
• Thân nhiệt
• Số lượng bạch cầu
• Bão hoà oxy
• Chụp x-quang phổi
Sau đó, vào ngày thứ ba, tính tổng cộng, với 2 tiêu chí mới được bổ sung:
• Tiến triển của thâm nhiễm
• Dữ liệu vi sinh học.
Nếu CPIS <6 trong cả hai thời điểm, thì thuốc kháng sinh bắt đầu vào ngày chẩn đoán nghi ngờ có thể được ngừng, với điều kiện là bệnh nhân không bị ức chế miễn dịch nặng và không bị nhiễm khuẩn huyết nặng. Điều này được gọi là ‘điều trị ngắn hạn’. Nếu một trong hai ngày có CPIS 6 hoặc cao hơn, thì cần tiếp tục sử dụng đầy đủ liệu trình thuốc kháng sinh.
Dữ liệu từ các nghiên cứu về tính chính xác cho thấy bằng chứng kém thuyết phục về việc ngăn cản sử dụng CPIS trong việc xác định hay loại trừ VAP hay để xác định thời gian điều trị kháng sinh.[1] [86]
Thời gian điều trị kháng sinh có thể hoàn tất trong 7 ngày nếu bệnh nhân ổn định về mặt lâm sàng và qua chẩn đoán hình ảnh, bao gồm các giá trị xét nghiệm, và không bị nhiễm trùng với Acinetobacter hoặc P aeruginosa.[1] [67] [87] Không có dữ liệu hỗ trợ điều trị MRSA lâu dài, mặc dù thường được thực hiện; cần sử dụng trong 2 tuần nếu có vãng khuẩn huyết, và lâu hơn nếu HAP/VAP có biến chứng như tràn mủ màng phổi hoặc viêm nội tâm mạc,. Bệnh nhân được sử dụng thuốc kháng sinh từ 7 đến 8 ngày ít tái phát VAP do mầm bệnh MDR và tỷ lệ tử vong, thời gian nằm viện, điều trị thất bại, và thời gian đặt nội khí quản cùng với thở máy không khác biệt.[88] [89] Chiến dịch tối ưu sử dụng thuốc kháng sinh trong cơ sở chăm sóc nội trú của Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh (CDC) nhằm mục tiêu ngưng điều trị kháng sinh nếu thích hợp, trái với sử dụng kháng sinh kéo dài, mà trước đây được áp dụng khi điều trị HAP.[90] Kết quả là hầu hết thời gian điều trị HAP có thể ngắn hơn, nhưng vẫn cần điều trị HAP do Pseudomonas hoặc Acinetobacter trong 2 tuần.[87]
Nếu không thấy cải thiện vào lúc này, cần xem xét thay đổi phác đổi kháng sinh để bao phủ mầm bệnh đề kháng hoặc bất thường (ví dụ như nấm). Tuy nhiên, một điều cũng quan trọng là đánh giá bệnh nhân để tìm các biểu hiện phổi khác, như xem xét lại tràn dịch có thể là do dịch tiết (ví dụ như tràn mủ màng phổi) thay vì dịch thấm.[8] Một điều cũng quan trọng là đánh giá tìm nguồn nhiễm trùng khác, không phải do phổi. Có thể chỉ định một thủ thuật nhất định mà trước đây không được xem xét, như siêu âm chi với đường truyền tĩnh mạch để loại trừ viêm tĩnh mạch huyết khối nhiễm khuẩn. Có thể cần lặp lại nội soi phế quản hoặc chọc dò màng phổi. Nói chung, điều trị không thành công có thể là do:[91]
• Biến chứng
• Chẩn đoán sai
• Điều trị sai mầm bệnh.
Bác sĩ hô hấp có thể xem xét các chiến lược như thay đổi thông số của máy thở thành hỗ trợ áp suất hoặc sử dụng chế độ máy tạo dao động.
Đáp ứng điều trị: CRP và procalcitonin
Có thể sử dụng procalcitonin để theo dõi xu hướng các giá trị bắt đầu từ ngày chẩn đoán.[98] Có thể sử dụng thông tin đó để xác định khi nào cần ngưng thuốc kháng sinh.[1]
Tổng quan về các chi tiết điều trị
| Bắt đầu | ||
| trước khi có kết quả nuôi cấy: không có các yếu tố nguy cơ đối với mầm bệnh đa kháng thuốc (MDR) | ||
| 1 | đơn trị liệu kháng sinh theo kinh nghiệm | |
| trước khi có kết quả nuôi cấy: có các yếu tố nguy cơ đối với mầm bệnh đa kháng thuốc (MDR), bao gồm Pseudomonas và MRSA | ||
| 1 | liệu pháp kết hợp kháng sinh theo kinh nghiệm | |
| Cấp tính | ||
| sau khi có kết quả nuôi cấy: do mầm bệnh gram âm | ||
| nhiễm trùng không do Pseudomonas dễ thâm nhập | 1 | điều trị kháng sinh theo mẫm bệnh |
| Pseudomonas hoặc nhiễm trùng khó thâm nhập | 1 | điều trị kháng sinh theo mẫm bệnh |
| do Legionella pneumophila | 1 | điều trị kháng sinh theo mẫm bệnh |
| sau khi có kết quả nuôi cấy: do mầm bệnh gram dương | ||
| tụ cầu vàng nhạy Methicillin | 1 | điều trị kháng sinh theo mẫm bệnh |
| Staphylococcus aureus kháng | 1 | điều trị kháng sinh theo mẫm bệnh Methicillin (MRSA) |
Các lựa chọn điều trị
| Bắt đầu | ||
| trước khi có kết quả nuôi cấy: không có các yếu tố nguy cơ đối với mầm bệnh đa kháng thuốc (MDR) | ||
| 1 | đơn trị liệu kháng sinh theo kinh nghiệm
Các lựa chọn sơ cấp Hoặc » Ceftazidime: 2 g đường tĩnh mạch mỗi 8 giờ một lần Hoặc » imipenem/cilastatin: 500 mg tiêm tĩnh mạch mỗi 6 giờ Hoặc » meropenem: 1 g qua đường tĩnh mạch 8 giờ một lần Hoặc » piperacillin/tazobactam: 4,5 g truyền tĩnh mạch mỗi 6 giờ; hoặc 3,375 g truyền tĩnh mạch mỗi 4 giờ » Không có các yếu tố nguy cơ sau đây: điều trị kháng sinh trong 90 ngày trước đó; sốc nhiễm khuẩn khi viêm phổi do thở máy (VAP); hội chứng suy hô hấp cấp tính trước khi VAP; nhập viện gần đây trên 5 ngày; liệu pháp thay thận cấp tính trước khi khởi phát VAP; nhuộm Gram chất lượng cao với trực khuẩn gram âm; bệnh phổi cấu trúc; đặt nội khí quản và thông khí nhân tạo.[1] » Phác đồ sử dụng kháng sinh theo kinh nghiệm luôn cần tuân theo mô hình kháng thuốc cục bộ; cần thực hiện kháng sinh đồ.[64] » Nếu bệnh nhân không có các yếu tố nguy cơ đối với mầm bệnh MDR, mầm bệnh gây viêm phổi có khả năng là Streptococcus pneumoniae, Haemophilus influenzae, tụ cầu vàng nhạy Methicillin (MSSA), hoặc trực khuẩn gram âm đường ruột nhạy thuốc kháng sinh (ví dụ như Escherichia coli, Klebsiella pneumoniae, Enterobacter species, Proteus species, hoặc |
|
| trước khi có kết quả nuôi cấy: có các yếu tố nguy cơ đối với mầm bệnh đa kháng thuốc (MDR), bao gồm Pseudomonas và MRSA | ||
| liệu pháp kết hợp kháng sinh theo kinh nghiệm Các lựa chọn sơ cấp
» cefepime: 2 g đường tĩnh mạch mỗi 8 giờ một lần Và » linezolid: 600 mg đường tĩnh mạch mỗi 12 giờ một lần » Có bất kỳ yếu tố nguy cơ nào sau đây: điều trị kháng sinh trong 90 ngày trước đó; sốc nhiễm khuẩn khi viêm phổi do thở máy (VAP); hội chứng suy hô hấp cấp tính trước khi VAP; nhập viện gần đây trên 5 ngày; liệu pháp thay thận cấp tính trước khi khởi phát VAP; nhuộm Gram chất lượng cao với trực khuẩn gram âm; bệnh phổi cấu trúc; đặt nội khí quản và thông khí nhân tạo.[1]
» Phác đồ sử dụng kháng sinh theo kinh nghiệm luôn cần tuân theo mô hình kháng thuốc cục bộ; cần thực hiện kháng sinh đồ.[64]
» Nếu bệnh nhân có yếu tố nguy cơ đối với mầm bệnh MDR, mầm bệnh có khả năng là Pseudomonas aeruginosa, Klebsiella pneumoniae (chủng beta- lactamase phổ rộng), loài Acinetobacter, MRSA, hoặc Legionella pneumophila. HAP/VAP do một trong những mầm bệnh này có liên quan đến tỷ lệ tử vong tăng.[70]
» Cần bao phủ Pseudomonas trong phác đồ điều trị bao gồm nhiều sự kết hợp khác nhau của beta-
|
||
| sau khi có kết quả nuôi cấy: do mầm bệnh gram âm | ||
| nhiễm trùng không do Pseudomonas dễ thâm nhập | 1 | điều trị kháng sinh theo mẫm bệnh Các lựa chọn sơ cấp
» cefepime: 2 g đường tĩnh mạch mỗi 8 giờ một lần Hoặc » imipenem/cilastatin: 500 mg tiêm tĩnh mạch mỗi 6 giờ Hoặc » piperacillin/tazobactam: 4,5 g truyền tĩnh mạch mỗi 6 giờ; hoặc 3,375 g truyền tĩnh mạch mỗi 4 giờ Hoặc » Muối Natri colistimethate: tham khảo ý kiến chuyên gia để có hướng dẫn về liều » Khi có kết quả nuôi cấy, cần xuống thang thuốc kháng sinh tương ứng; nghĩa là cần thu hẹp điều trị theo độ nhạy cảm của mầm bệnh, hoặc cần ngưng thuốc kháng sinh theo những vi khuẩn không phát hiện được. Ví dụ như có thể xuống thang phác đồ piperacillin/tazobactam, levofloxacin, và vancomycin thành ampicillin/sulbactam. |
| Pseudomonas hoặc nhiễm trùng khó thâm nhập | điều trị kháng sinh theo mẫm bệnh Các lựa chọn sơ cấp
» cefepime: 2 g đường tĩnh mạch mỗi 8 giờ một lần » Ciprofloxacin: 400 mg đường tĩnh mạch mỗi 8 giờ một lần » Khi có kết quả nuôi cấy, cần xuống thang thuốc kháng sinh tương ứng; nghĩa là cần thu hẹp điều trị theo độ nhạy cảm của mầm bệnh, hoặc cần ngưng thuốc kháng sinh theo những vi khuẩn không phát hiện được. Ví dụ như có thể xuống thang phác đồ piperacillin/tazobactam, levofloxacin, và vancomycin thành ampicillin/sulbactam. » Vi khuẩn gram âm thường gặp có thể gây HAP bao gồm Pseudomonas aeruginosa, Acinetobacter, Klebsiella pneumoniae, và Serratia marcescens. |
|
| Staphylococcus aureus kháng Methicillin (MRSA) | 1 | điều trị kháng sinh theo mẫm bệnh Các lựa chọn sơ cấp
» linezolid: 600 mg đường tĩnh mạch mỗi 12 giờ một lần Hoặc » vancomycin: 15 mg/kg truyền tĩnh mạch mỗi 12 giờ một lần Các lựa chọn thứ cấp » Telavancin: 10 mg/kg tiêm tĩnh mạch mỗi 24 giờ » Khi có kết quả nuôi cấy, cần xuống thang thuốc kháng sinh tương ứng; nghĩa là cần thu hẹp điều trị theo độ nhạy cảm của mầm bệnh, hoặc cần ngưng thuốc kháng sinh theo những vi khuẩn không phát hiện được. » Telavancin được chấp thuận để điều trị HAP/viêm phổi do thở máy (VAP). Dữ liệu hỗ trợ sử dụng cho thấy rằng thuốc này không kém hơn so với vancomycin khi so sánh tỷ lệ chữa lành. Khỏi bệnh
|
Giai đoạn đầu
Điều trị kháng sinh dạng khí dung
Có dữ liệu mới về việc sử dụng thuốc kháng sinh dạng khí dung. Một thử nghiệm tiến cứu, ngẫu nhiên, mù đôi, có đối chứng giả dược nhận thấy các dấu hiệu nhiễm trùng hô hấp giảm khi sử dụng thuốc kháng sinh dạng khí dung.[102] Một phân tích tổng hợp 7 nghiên cứu nhỏ cho thấy rằng đơn trị liệu với thuốc kháng sinh dạng khí dung không kém hơn so với liệu pháp thông thường.[103] Phân tích này khuyến nghị chỉ sử dụng cách điều trị này này khi liệu pháp truyền tĩnh mạch không có. Một đánh giá do Hội Dược sĩ về Bệnh truyền nhiễm (SIDP) công bố nêu khuyến nghị dựa trên bằng chứng, bao gồm liều dùng, đối với một vài thuốc kháng sinh cho HAP.[104] Xem xét này cho biết rằng ứng viên tốt nhất là những người không đáp ứng với thuốc kháng sinh truyền tĩnh mạch, có HAP tái phát, hoặc có HAP do vi khuẩn MDR. Hướng dẫn năm 2016 về HAP/VAP khuyến nghị sử dụng thuốc kháng sinh dạng khí dung cho những bệnh nhân nhiễm mầm bệnh chỉ nhạy với aminoglycosides hoặc polymyxins.[1] Có các nghiên cứu có kết quả không tốt trong nhóm bệnh nhân này.[105]
Iclaprim
Iclaprim, liên quan đến trimethoprim, là loại thuốc gần đây được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) chỉ định thuốc để điều trị nhiễm trùng phổi do Staphylococcus aureus ở bệnh nhân xơ nang. Iclaprim cho thấy phổ rộng chống các mầm bệnh kháng thuốc khác nhau, bao gồm MRSA và Streptococcus pneumoniae đa kháng thuốc. Nó có chỉ định với HAP và nhiễm trùng tổ chức da. Iclaprim là chất ức chế dihydrofolate reductase của vi khuẩn. Nghiên cứu giai đoạn 2 ở 70 bệnh nhân bị viêm phổi tại bệnh viện so với tỷ lệ chữa lành lâm sàng giữa iclaprim và vancomycin. Hai nhóm iclaprim được so với vancomycin; iclaprim có tỷ lệ chữa lành là 74% và 63%, trong khi vancomycin có tỷ lệ chữa lành là 52%.[106] Nghiên cứu bị hạn chế bởi liều dùng thống nhất vancomycin mà không có liều nạp.
Điều trị kháng sinh mới
Ceftobiprole, cephalosporin thế hệ thứ năm, được chấp thuận để điều trị HAP và viêm phổi mắc phải trong cộng đồng (CAP) ở Châu Âu. Nó bao phủ MRSA và vi khuẩn gram âm, bao gồm Pseudomonas aeruginosa. Cephalosporin thế hệ thứ năm, ceftaroline (bao gồm khả năng chống MRSA), được chấp thuận để điều trị CAP, nhưng không phải HAP. Kháng sinh phổ rộng, ceftolozane/tazobactam, được chấp thuận và được chỉ định điều trị các nhiễm trùng khác ngoài HAP hoặc VAP (viêm phổi do máy thở), nhưng các nghiên cứu giai đoạn III đang được thực hiện. Plazomicin là thế hệ mới của aminoglycoside trong các nghiên cứu giai đoạn III đối với HAP. Nó bao gphủồm vi khuẩn Gram âm, như Escherichia coli, Klebsiella pneumoniae, Enterobacterspp và Acinetobacter baumannii, không gây nhiễm độc tai hoặc độc tố thận như ở aminoglycosides loại cũ.[107] Việc sử dụng thuốc kháng sinh dự phòng còn nhiều tranh cãi. Một nghiên cứu cho thấy rằng bệnh nhân sử dụng thuốc kháng sinh truyền tĩnh mạch dự phòng có tỷ lệ HAP thấp hơn;[108] các nghiên cứu khác cho thấy rằng bệnh nhân có mầm bệnh MDR cư trú, sau đó dẫn đến nhiễm trùng.[109] [110] Sử dụng thuốc kháng sinh dự phòng trong thời gian ngắn ở các bệnh nhân chọn lựa có thể có lợi.[8]
Kháng thể đơn dòng
Có hai kháng thể đơn dòng dùng để điều trị viêm phổi được FDA Hoa Kỳ cấp trạng thái theo dõi nhanh để phát triển. Loại thứ nhất là kháng thể đơn dòng phản ứng diện rộng (immunoglobulin G) kháng P aeruginosa. Nghiên cứu giai đoạn 1 đánh giá ba liều dùng khác nhau của thuốc này trong 84 ngày.[111] Nghiên cứu này không cho thấy có phản ứng phụ nghiêm trọng, và phản ứng phụ nhẹ không liên quan đến thuốc. Kháng thể đơn dòng thứ hai là AR-301, immunoglobulin G1 kháng độc tố của Staphylococcus aureus, bao gồm MRSA. Gần đây, một nghiên cứu giai đoạn 2 đánh giá tính an toàn và hiệu lực của thuốc đã ghi danh ít nhất 52 bệnh nhân, chia thành hai nhánh: những người được điều trị với thuốc kháng sinh và những người được sử dụng thuốc kháng sinh cộng với thuốc này. Liên minh Châu Âu đã có chỉ định thuốc mồ côi cho AR-301. Các kháng thể đơn dòng khác đang được thử nghiệm bao gồm lipopolysaccharide kháng P aeruginosa, các loại khác kháng chủng Acinetobacter, và các loại khác kháng siêu vi hợp bào hô hấp.
Ống nội khí quản phủ bạc
Ống nội khí quản được tẩm bạc diệt mầm bệnh phủ lên ống. Một nghiên cứu lớn nhất về ống phủ bạc cho thấy rằng bệnh nhân thở máy mắc bệnh viêm phổi với ống phủ bạc with ít hơn là không có ống.[46] Although 1509 patients were enrolled, the study was not powered to detect a difference in length of stay or mortality.
Mở khí quản sớm
Mở khí quản sớm so với muộn được nghiên cứu ở bệnh nhân thở máy để xác định xem có diễn biến hoặc giảm viêm phổi do thở máy (VAP) không, nhưng không tìm thấy kết quả.[112] [113]
Đặt nội khí quản vô trùng
Phạm vi nghiên cứu mới là vai trò vô trùng trong khi đặt nội khí quản. Điều này dường như khá dễ hiểu rằng bệnh nhân được đặt nội khí quản trên cánh đồng hoặc phòng cấp cứu có nguy cơ VAP cao hơn, nhưng vẫn còn rất ít dữ liệu hỗ trợ chính sách yêu cầu bệnh nhân được đặt lại nội khí quản nếu ban đầu họ không được đặt trong môi trường sạch sẽ, có kiểm soát.[114]
Thủ thuật nắn xương
Trong một thử nghiệm ngẫu nhiên, mù đôi, có kiểm soát từ Hoa Kỳ, bệnh nhân nhập viện được điều trị bằng thủ thuật nắn xương 2 lần, mỗi lần 15 phút mỗi ngày (ví dụ như giải phóng cân cơ ở lỗ vào ngực) có thời gian nằm viện, sử dụng thuốc kháng sinh truyền tĩnh mạch, và suy hô hấp hoặc tử vong giảm đáng kể về mặt thống kê trong các nhóm thử nghiệm theo quy trình, mà không trong nhóm thử nghiệm theo chủ ý.[115]
Men vi sinh
Việc sử dụng men vi sinh ở bệnh nhân VAP đang là đề tài cho các thử nghiệm ngẫu nhiên có đối chứng; tuy nhiên, kết quả không phù hợp. Một thử nghiệm đánh giá Synbiotic 2000 Forte (có Pediococcus pentosaceus, Leuconostoc mesenteroides, L paracasei ssp, và L plantaru) so với giả dược hai lần một ngày.[116] Tỷ lệ mắc VAP cho thấy tương tự giữa các nhóm (9% trong nhóm can thiệp, 13% trong nhóm giả dược). Số ngày thở máy, thời gian lưu trú trong ICU, và tỷ lệ tử vong cũng tương tự. Một nghiên cứu khác đánh giá men vi sinh Lactobacillus rhamnosus so với giả dược hai lần mỗi ngày.[117] Tỷ lệ mắc bệnh VAP thấp hơn đáng kể trong nhóm men vi sinh (19% so với 40%). Thời gian tiến triển VAP lâu hơn, cũng như tỷ lệ cư trú các mầm bệnh thấp hơn, cũng được ghi nhận; tuy nhiên, thời gian thở máy, thời gian lưu trú trong ICU, và thời gian nằm viện tổng cộng giữa các nhóm tương tự nhau. Vào năm 2012 và 2013, tổng cộng 19 nghiên cứu được xem xét trong 3 phân tích tổng hợp, với sự trùng lắp của các nghiên cứu trong từng lần xem xét.[118] [119] [120] Kết luận không nhất quán. Các ngiên cứu sau này có thể cho thấy rằng có một lợi ích trong nhóm cụ thể như ở bệnh nhân chấn thương.[120]
macrolides
Điều trị bổ trợ clarithromycin đã được nghiên cứu ở bệnh nhân VAP để xác định xem nó có liên quan đến cải thiện diễn biến. Khi sử dụng trong ba ngày, tỷ lệ tử vong ít hơn đáng kể ở bệnh nhân sử dụng clarithromycin (60% ở nhánh giả dược so với 43% với clarithromycin; P=0,023). Clarithromycin cũng liên quan đến chi phí nằm viện giảm.[121]
Liệu pháp thay đổi tư thế liên tục
Thỉnh thoảng sử dụng liệu pháp thay đổi tư thế liên tục ở bệnh nhân ICU. Phân tích tổng hợp ở bệnh nhân chấn thương cho thấy rằng liệu pháp này giúp giảm mức độ viêm phổi trong bệnh viện, nhưng không ảnh hưởng đến tỷ lệ tử vong.[122]
Liên lạc theo dõi
Khuyến nghị
Giám sát
Theo định nghĩa, bệnh nhân HAP được theo dõi tại bệnh viện. Dự kiến xu hướng cải thiện trong vòng 72 giờ sau khi bắt đầu điều trị thuốc kháng sinh. Thông thường, thực hiện FBC, CXR, và đánh giá bão hoà oxy hàng ngày trong khi bệnh nhân đang ở trong ICU. Nếu bệnh nhân ở trong khoa bệnh viện, cần thực hiện những đánh giá này 3 ngày sau khi chẩn đoán để xác thực chẩn đoán và nhu cầu sử dụng thuốc kháng sinh sau đó. Các hệ thống cơ quan bị ảnh hưởng khác cũng cần cải thiện, thấy rõ qua huyết áp cao hơn với yêu cầu sử dụng chất tăng huyết áp ít hơn, lượng nước tiểu tăng, và tình trạng tinh thần tỉnh táo hơn. Cải thiện là cơ hội thích hợp để xuống thang thuốc kháng sinh.
Điều này là bình thường đối với bệnh nhân có thâm nhiễm dai dẳng trên CXR, vì có thể mất nhiều tuần để khỏi, nhưng nếu bệnh nhân đáp ứng thích hợp, thì cần tiết giảm yêu cầu bổ sung oxy.
Nếu không thấy cải thiện như mong đợi, cần xem xét thay đổi phác đổi kháng sinh để bao phủ mầm bệnh đề kháng hoặc bất thường (ví dụ như nấm). Tuy nhiên, một điều cũng quan trọng là đánh giá bệnh nhân để tìm các biểu hiện phổi khác, như xem xét lại tràn dịch có thể là do dịch tiết (ví dụ như tràn mủ màng phổi) thay vì dịch thấm.[8] Một điều cũng quan trọng là đánh giá tìm nguồn nhiễm trùng khác, không phải do phổi. Có thể chỉ định một thủ thuật nhất định mà trước đây không được xem xét, như siêu âm chi có đường truyền tĩnh mạch để loại trừ viêm tĩnh mạch huyết khối nhiễm khuẩn. Có thể cần nội soi phế quản hoặc chọc dò màng phổi để sinh thiết. Nói chung, điều trị không thành công có thể là do:[91]
• Biến chứng
• Chẩn đoán sai
• Điều trị sai mầm bệnh.
Bác sĩ hô hấp có thể xem xét các chiến lược như thay đổi thông số của máy thở thành hỗ trợ áp suất hoặc sử dụng chế độ máy tạo dao động.
Nếu HAP là một phần của một chuỗi biến chứng góp phần làm suy đa phủ tạng, thỉ bệnh nặng hơn và thậm chí tử vong có thể xảy ra sau đó. Ở bệnh nhân cải thiện và được xuất viện, chỉ định tái khám tại phòng khám. Các xét nghiệm, bao gồm chẩn đoán hình ảnh, chỉ được thực hiện khi có chỉ định lâm sàng như sốt. Có thể kiểm tra procalcitonin để hướng dẫn thời gian sử dụng kháng sinh.
Hướng dẫn dành cho bệnh nhân
Bệnh nhân có khả năng cải thiện, phổi giãn nở đầy đủ bằng cách vận động hoặc sử dụng hô hấp kế khuyến khích. Cử động làm giãn nở phổi xẹp và vận động bài tiết. Bệnh nhân cần cho biết bất kỳ tình trạng tiêu chảy nào trong trường hợp có viêm đại tràng do Clostridium.
Các biến chứng
| Các biến chứng | Khung thời gian | Khả năng |
| tràn mủ màng phổi hoặc áp xe phổi | dài hạn | thấp |
| Mặc dù tràn dịch màng phổi thường gặp, nhưng tràn mủ màng phổi xảy ra chỉ ở 5% đến 10% trong số những bệnh nhân bị tràn dịch.[123] Nhiễm trùng có thể lây lan trực tiếp hoặc qua đường máu từ mô trong nhu mô đến khoang màng phổi.
Cần nghi ngờ tất cả các ca tràn dịch là tràn mủ màng phổi, nhất là nếu chúng ở một bên, không hết khi dùng thuốc bài niệu, và không trong bối cảnh suy tim. Chụp CT sẽ phân biệt tràn dịch với phù phổi, nhưng cần chọc dò màng phổi chẩn đoán để loại trừ tràn mủ màng phổi hoặc áp-xe. Có hướng dẫn điều trị tràn dịch màng phổi do viêm phổi.[124] |
||
| hội chứng đáp ứng viêm hệ thống (SIRS) hoặc nhiễm khuẩn huyết kèm theo suy đa phủ tạng | dài hạn | thấp |
| Nhiễm khuẩn huyết có thể xảy ra qua đường máu từ mầm bệnh gây HAP. Cần thực hiện hai mẫu nuôi cấy máu cách ít nhất 30 phút để phát hiện sự hiện diện của vãng khuẩn huyết dai dẳng, điều này sẽ hỗ trợ chẩn đoán viêm nội tâm mạc.
Cần lấy kết quả phân biệt bằng công thức máu để xác định mức độ hình thành bạch cầu đũa. Cần thực hiện theo hướng dẫn điều trị nhiễm khuẩn huyết.[125] |
||
| thuyên tắc động mạch phổi/nhồi máu | biến thiên | thấp |
| Khó chẩn đoán thuyên tắc động mạch phổi vì nó có biểu hiện với các triệu chứng không rõ rệt (chủ yếu là khó thở và nhịp tim nhanh). Ngoài ra, việc đưa bệnh nhân bệnh nặng đi chụp CT xoắn ốc có thể phức tạp và nguy hiểm. | ||
| Viêm đại tràng do Clostridium difficile do sử dụng thuốc kháng sinh phổ rộng | biến thiên | thấp |
| Viêm đại tràng do Clostridium difficile thường xảy ra sau khi sử dụng thuốc kháng sinh phổ rộng. Cần cẩn trọng khi chỉ định xét nghiệm phân. Có thể cần lặp lại xét nghiệm nếu sử dụng xét nghiệm độc tố hoặc kháng nguyên, vì độ nhạy cảm chỉ 80% (tùy theo bộ xét nghiệm thương mại được sử dụng). Nếu nghi ngờ cao, cần tiến hành điều trị.
Cũng có thể xảy ra tình trạng tăng bạch cầu cao, do đó cần chỉ định thực hiện công thức máu. Nếu nghi ngờ phình đại tràng nhiễm độc, cần chụp CT vùng bụng và gọi cho bác sĩ phẫu thuật. Có thể phòng ngừa nhiễm trùng C difficile bằng cách hạn chế sử dụng thuốc kháng sinh. Kết quả xét nghiệm độc tố khác từ phân để chữa bệnh không thích hợp, vì bệnh nhân còn thải độc tố trong nhiều tuần sau khi viêm đại tràng; do đó, chữa bệnh là quyết định lâm sàng. |
||
Tiên lượng
Tỷ lệ tử vong do mọi nguyên nhân gây HAP là 30% đến 70%, trong khi tỷ lệ tử vong quy bổ là khoảng 10%. Nhiều người bị HAP tử vong do bệnh nền của họ. Tỷ lệ tử vong tăng liên quan đến bệnh nhân bị HAP do các chủng Pseudomonas aeruginosa hoặc Acinetobacter, sử dụng thuốc kháng sinh không bao phủ mầm bệnh gây bệnh, và có bệnh lý nội thay vì bệnh lí ngoại khoa.[10] Khả năng nhiễm viêm phổi do thở máy (VAP) lúc đầu cao nhất; hầu hết bệnh nhân bị viêm phổi trong vòng 10 ngày sau khi được đặt nội khí quản.
Kết quả muộn
Điều này không phải hiếm gặp đối với bệnh nhân HAP, thường có nhiều bệnh đồng mắc hoặc chấn thương nặng, suy hô hấp kéo dài và do đó phải mất nhiều tuần hoặc thậm chí nhiều tháng để ngưng thở máy. Bệnh nhân sẽ hồi phục khỏi HAP và vẫn cần thở máy, do đó thời gian thở máy không tương ứng với thời gian HAP. Có thể ngưng thuốc kháng sinh chỉ sau 7 ngày nếu bệnh nhân ổn định và không phải Pseudomonas hay Acinetobacter gây HAP.[87] Thời gian sử dụng thuốc kháng sinh ngắn hơn, như 7 ngày, có thể phòng ngừa kháng kháng sinh.
Điểm số bằng chứng
1. Tỷ lệ tử vong tại bệnh viện: có bằng chứng kém thuyết phục rằng về mặt dữ liệu thống kê, tỷ lệ bệnh nhân nhiễm trùng đường máu đang được điều trị kháng sinh không đầy đủ (61,9%) tử vong tại bệnh viện cao hơn tỷ lệ bệnh nhân nhiễm trùng đường máu được điều trị kháng sinh đầy đủ (28,4%; nguy cơ tương đối 2,18; 95% CI 1,77 đến 2,69; P <0,001). Nhận thấy có mối quan hệ đáng kể về mặt thống kê giữa tỷ lệ điều trị kháng sinh không đầy
đủ đối với các vi khuẩn và tỷ lệ tử vong tại bệnh viện có liên quan (hệ số tương quan Spearman = 0,8287; P = 0,006).[63]
Bằng chứng cấp độ C: Các nghiên cứu quan sát (thuần tập) có chất lượng thấp hoặc các thử nghiệm ngẫu nhiên đối chứng (RCT) có lỗi về phương pháp với <200 người tham gia.
2. Tỷ lệ chữa khỏi lâm sàng: có bằng chứng tương đối thuyết phục rằng tỷ lệ chữa khỏi trên lâm sàng (71 [66,4%] ở 107 bệnh nhân sử dụng linezolid so với 62 [68,1%] ở 91 bệnh nhân sử dụng vancomycin) và tỷ lệ thành công về vi sinh học (lần lượt 36 [67,9%] trong 53 bệnh nhân so với . 28 [71,8%] trong 39 bệnh nhân) đối với bệnh nhân có thể đánh giá tương đương giữa các nhóm điều trị.[73] Bằng chứng cấp độ B: Các thử nghiệm ngẫu nhiên đối chứng (RCT) với <200 người tham gia, các RCT có lỗi về phương pháp với >200 người tham gia, các đánh giá hệ thống (SR) có lỗi về phương pháp hoặc các nghiên cứu quan sát (thuần tập) có chất lượng cao.
3. Tỷ lệ tử vong: có bằng chứng kém thuyết phục rằng ngoài những bệnh nhân được điều trị theo kinh nghiệm không thích hợp (n = 40), tỷ lệ tử vong không khác biệt về mặt thống kê đối với bệnh nhân nếu họ sử dụng đơn trị liệu hoặc kết hợp trị liệu để điều trị nhiễm trùng Pseudomonas (23,1% so với 33,2%; P = 0,27). Ở những người sống sót, thời gian lưu trú trong ICU (trung bình 27 ngày; khoảng tứ phân vị [IQR] 18-43 so với 31 ngày; IQR 26-58,5; P = 0,2) và thời gian nằm viện (trung bình 40 ngày; IQR 19,25-51,25 so với 43 ngày; IQR 30-68,25; P = 0,15) tương tự ở những bệnh nhân sử dụng đơn trị liệu và liệu pháp kết hợp.[83]
Bằng chứng cấp độ C: Các nghiên cứu quan sát (thuần tập) có chất lượng thấp hoặc các thử nghiệm ngẫu nhiên đối chứng (RCT) có lỗi về phương pháp với <200 người tham gia.
Ca lâm sàng
Mặc dù Staphylococcus aureus kháng methicillin (MRSA) đã được biết là có liên quan đến viêm phổi bệnh viện, một số báo cáo cũng đã mô tả các trường hợp viêm phổi mắc phải tại cộng đồng (CAP) do MRSA gây ra. Tỷ lệ mắc bệnh viêm phổi do MRSA mắc phải tại cộng đồng (CA-MRSA) ước tính là 0,51 đến 0,64 trường hợp trên 100.000 (Vardakas KZ, Matthaiou DK, Falagas ME. Incidence, characteristics and outcomes of patients with severe community acquired-MRSA pneumonia. Eur Respir J 2009;34:1148–58). Một nghiên cứu đa trung tâm quốc tế chỉ ra rằng tỷ lệ chung của MRSA CAP đã được xác nhận là 3% trong số 3193 bệnh nhân CAP được xét nghiệm vi sinh, dao động từ 2,4% ở Châu Âu đến 5,4% ở Nam Mỹ (Aliberti S, Reyes LF, Faverio P, et al. Global initiative for meticillin-resistant Staphylococcus aureus pneumonia (GLIMP): an international, observational cohort study. Lancet Infect Dis 2016;16:1364–76). MRSA có thể gây ra CAP nghiêm trọng, dẫn đến bệnh nặng và đôi khi tử vong. Self và các đồng nghiệp đã quan sát thấy rằng việc chạy thận nhân tạo kéo dài gặp phổ biến hơn ở những bệnh nhân mắc MRSA so với CAP do phế cầu khuẩn và các trường hợp viêm phổi do các nguyên nhân khác không phải S aureus, trong khi các đặc điểm lâm sàng khác khi nhập viện là tương tự nhau (Self WH, Wunderink RG, Williams DJ, et al. Staphylococcus aureus community- acquired pneumonia: prevalence, clinical characteristics, and outcomes. Clin Infect Dis 2016;63:300–9). Bệnh nhân viêm phổi do CA-MRSA có kết cục lâm sàng nặng hơn so với bệnh nhân mắc viêm phổi do phế cầu khuẩn, bao gồm nhập viện chăm sóc đặc biệt và tử vong nội trú. Một số nghiên cứu báo cáo tỷ lệ tử vong do viêm phổi do CA-MRSA cao từ 56% đến 63%. Viêm phổi do vi khuẩn sau cúm là nguyên nhân hàng đầu gây tử vong do cúm và viêm phổi do CA-MRSA đã được báo cáo xảy ra sau khi nhiễm cúm, đặt ra một thách thức điều trị vì nguy cơ cao của liệu pháp kháng sinh kinh nghiệm không phù hợp và kết quả lâm sàng kém. Độc tố PVL thường liên quan đến các chủng CA-MRSA. CAP do MRSA mang gen PVL có thể biểu hiện như hoại tử phổi lan rộng, thâm nhiễm đa thùy, giảm bạch cầu, ho ra máu và nhiễm trùng huyết, dẫn đến tỷ lệ tử vong cao hơn.
Vietnamfor xin đăng một case lâm sàng, của một bạn của trang làm công tác hồi sức gửi tới, về viêm phổi nặng do CA-MRSA dương tính với PVL ở một người trưởng thành khỏe mạnh. CA-MRSA nên được coi là mầm bệnh của CAP nặng, đặc biệt khi kết hợp với sốc nhiễm trùng ở những người khỏe mạnh trước đó và lưu ý rằng rất cần chú ý đến vai trò của xét nghiệm vi sinh và bao vây MRSA trước một trường hợp viêm phổi vi khuẩn sau cúm.
Case cụ thể:
Bệnh nhân nam, 68 tuổi, tiền sử sức khỏe bình thường.
Bệnh nhân bị sốt lên tới 39,0°C, ho có đờm kéo dài trong 5 ngày. Bệnh nhân đến một phòng khám gần đó và được điều trị bằng azithromycin với thuốc giảm sốt trong 2 ngày, các triệu chứng thuyên giảm.
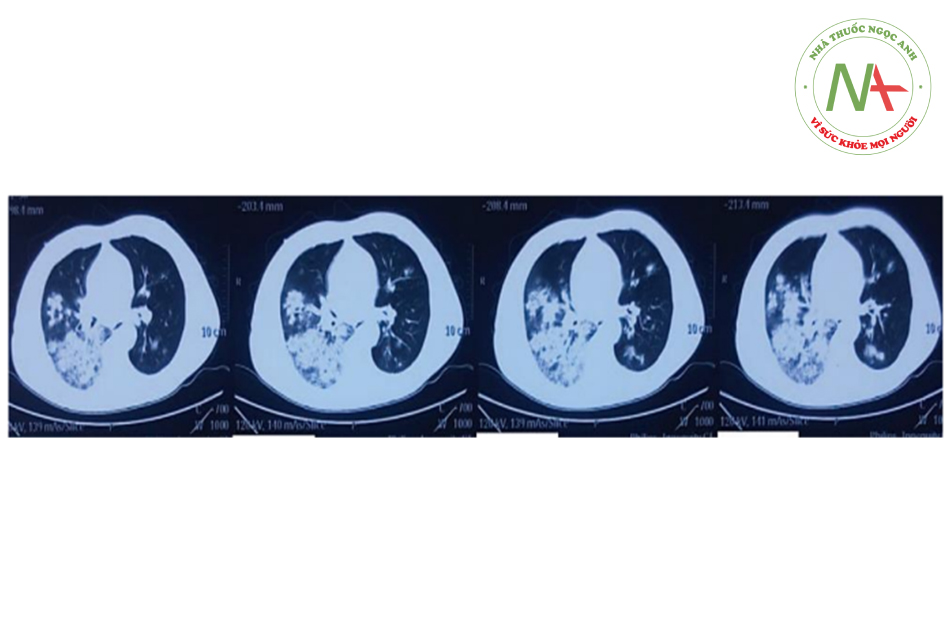
Tuy nhiên, 1 ngày sau, các triệu chứng nặng lên và bệnh nhân được đưa đến bệnh viện y học cổ truyền địa phương để điều trị bằng y học cổ truyền. Tuy nhiên, tình trạng lâm sàng xấu đi nhanh chóng, bệnh nhân khó thở và ho ra máu. Sau đó, bệnh nhân được chụp CT ngực (hình bên dưới), được chẩn đoán viêm phổi nặng và được chuyển cấp cứu bệnh viện đa khoa tỉnh. Tại đây bệnh nhân được đặt nội khí quản để thở máy và chuyển vào ICU.
Các dấu hiệu sinh tồn của bệnh nhân khi nhập viện ICU: nhịp tim là 106 nhịp/phút, huyết áp 70/52 mmHg với biểu hiện sốc. Độ bão hòa oxy là 83% với Oxy 100% qua nội khí quản.
Khám: nghe phổi có tiếng ran nổ cả hai bệnh phổi, tập trung nhiều ở hai đáy phổi, nhất là bên phải. Da và niêm mạc không thấy tổn thương và dấu hiệu bất thường.
Xét nghiệm:
- Bạch cầu máu (WBC) là 1,2×109 tế bào/L bao gồm 75% bạch cầu trung tính, số lượng tế bào lympho là 0,21×109 tế bào/L và số lượng tiểu cầu là 94×109 tế bào/L.
- Khí máu động mạch: pH là 7,19, áp suất riêng phần của carbon dioxide (PaCO2) là 39 mmHg, áp suất riêng phần của oxy (PO2) là 57 mmHg và mức lactate là 5,6 mmol/L.
Sinh hóa máu: Protein phản ứng C và procalcitonin tăng cao ở mức tương ứng là 61,24 mg/L và >400 ng/mL. Protein toàn phần là 42,2 g/L và mức albumin là 22,8 g/L. BUN 12,62 mmol/L và nồng độ creatinine là 231,2 mmol/L. Thromboplastin từng phần được hoạt hóa là 41,5 giây, thời gian prothrombin huyết tương là 14,9 giây, tỷ lệ chuẩn hóa quốc tế là 1,27 và prothrombin hoạt tính là 65%. Canxi trong máu 1,67 mmol/L. D-dimer huyết tương và sản phẩm thoái biến fibrinogen tương ứng là 2708 mg/L và 15,6 mg/ml.
Bệnh nhân được thở máy xâm lấn ngay với FiO2 là 1.0 và áp suất dương thì thở ra (PEEP) là 10 cm H2O cùng với thuốc an thần và phong tỏa thần kinh cơ. Noradrenaline được tiêm tĩnh mạch và tiến hành hồi sức truyền dịch. Liệu pháp kháng sinh cũng được tiến hành và bao gồm mezlocillin natri/sulbactam natri, linezolid và oseltamivir. Hydrocortison được chỉ định do sốc nhiễm trùng.
Đường thở của bệnh nhân sau đó bắt đầu đầy dịch tiết màu máu. Mặc dù anh ấy đã được điều trị ngay lập tức nhưng tình trạng thiếu oxy trong máu của anh ấy không được cải thiện và bệnh nhân đã được tư vấn phương pháp cung cấp oxy qua màng ngoài cơ thể (ECMO). Người nhà bệnh nhân từ chối điều trị ECMO. Vào ngày thứ 2 của ICU bệnh nhân tử vong.
Sau đó 2 ngày cấy đờm cho thấy MRSA kháng oxacillin, benzylpenicillin, erythromycin và clindamycin, nhưng nhạy cảm với ciprofloxacin, vancomycin, levofloxacin, quinupristin/dalfopri, oxacillin, moxifloxcin, rifampicin, trimethoprim/sulfamet, tigecyclin, tetracycline, và gentamycin. Phản ứng chuỗi polymerase (PCR) của các chủng MRSA thu được từ đờm của bệnh nhân có kết quả dương tính với gen PVL.
Tài liệu tham khảo
1. Kalil AC, Metersky ML, Klompas M, et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society. Clin Infect Dis. 2016;63:e61-e111. Toàn văn Tóm lược
2. Iregui M, Ward S, Sherman G, et al. Clinical importance of delays in the initiation of appropriate antibiotic treatment for ventilator-associated pneumonia. Chest. 2002;122:262-268. Toàn văn Tóm lược
3. Tablan OC, Anderson LJ, Besser R, et al. Guidelines for preventing health-care-associated pneumonia, 2003: recommendations of CDC and the Healthcare Infection Control Practices Advisory Committee. MMWR Recomm Rep. 2004;53:1-36. Toàn văn Tóm lược
4. Masterton RG, Galloway A, French G, et al. Guidelines for the management of hospital-acquired pneumonia in the UK: report of the working party on hospital-acquired pneumonia of the British Society for Antimicrobial Chemotherapy. J Antimicrob Chemother. 2008;62:5-34. Toàn văn Tóm lược
5. Richards MJ, Edwards JR, Culver DH, et al. Nosocomial infections in medical intensive care units in the United States: National Nosocomial Infections Surveillance System. Crit Care Med. 1999;27:887-892. Tóm lược
6. Muscedere JG, Day A, Heyland DK. Mortality, attributable mortality, and clinical events as end points for clinical trials of ventilator-associated pneumonia and hospital-acquired pneumonia. Clin Infect Dis. 2010;51(suppl 1):S120- S125. Toàn văn Tóm lược
7. Kollef MH, Hamilton CW, Ernst FR. Economic impact of ventilator-associated pneumonia in a large matched cohort. Infect Control Hosp Epidemiol. 2012;33:250-256. Tóm lược
8. American Thoracic Society; Infectious Diseases Society of America. Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med. 2005;171:388-416. Toàn văn Tóm lược
9. Melsen WG, Rovers MM, Koeman M, et al. Estimating the attributable mortality of ventilator-associated pneumonia from randomized prevention studies. Crit Care Med. 2011;39:2736-2742. Tóm lược
10. Heyland DK, Cook DJ, Griffith L, et al. The attributable morbidity and mortality of ventilator-associated pneumonia in the critically ill patient. Am J Respir Crit Care Med. 1999;159:1249-1256. Toàn văn Tóm lược
11. Mosier MJ, Pham TN. American Burn Association practice guidelines for prevention, diagnosis, and treatment of ventilator-associated pneumonia (VAP) in burn patients. J Burn Care Res. 2009;30:910-928. Tóm lược
12. Rubinstein E, Kollef MH, Nathwani D. Pneumonia caused by methicillin-resistant Staphylococcus aureus. Clin Infect Dis. 2008;46 Suppl 5:S378-S385. Tóm lược
13. Allen M, Mirsaeidi M, Peyrani P, et al. Emergence of community-associated MRSA as etiology of hospital-acquired pneumonia and ventilator-associated pneumonia: results from the IMPACT HAP study. Paper presented at: 46th Annual Meeting of ICAAC/IDSA; October 2008; Washington, D.C.
14. Sopena N, Sabrià M; Neunos 2000 Study Group. Multicenter study of hospital-acquired pneumonia in non-ICU patients. Chest. 2005;127:213-219. Toàn văn Tóm lược
15. el-Ebiary M, Sarmiento X, Torres A, et al. Prognostic factors of severe Legionella pneumonia requiring admission to ICU. Am J Respir Crit Care Med. 1997;156:1467-1472. Toàn văn Tóm lược
16. Wilde JA, McMillan JA, Serwint J, et al. Effectiveness of influenza vaccine in health care professionals: a randomized trial. JAMA. 1999;281:908-913. Toàn văn Tóm lược
17. Sarubbi FA Jr, Kopf HB, Wilson MB, et al. Increased recovery of Aspergillus flavus from respiratory specimens during hospital construction. Am Rev Respir Dis. 1982;125:33-38. Tóm lược
18. Cook D, De Jonghe B, Brochard L, et al. Influence of airway management on ventilator-associated pneumonia: evidence from randomized trials. JAMA. 1998;279:781-787. Tóm lược
19. Bergmans DC, Bonten MJ, van Tiel FH, et al. Cross-colonisation with Pseudomonas aeruginosa of patients in an intensive care unit. Thorax. 1998;53:1053-1058. Toàn văn Tóm lược
20. Craven DE, Steger KA. Nosocomial pneumonia in mechanically ventilated adult patients: epidemiology and prevention in 1996. Semin Respir Infect. 1996;11:32-53. Tóm lược
21. Pittet D, Hugonnet S, Harbarth S, et al. Effectiveness of a hospital-wide programme to improve compliance with hand hygiene. Lancet. 2000;356:1307-1312. Tóm lược
22. Kollef MH. The prevention of ventilator-associated pneumonia. N Engl J Med. 1999;340:627-634. Tóm lược
23. Cook D, Guyatt G, Marshall J, et al. A comparison of sucralfate and ranitidine for the prevention of upper gastrointestinal bleeding in patients requiring mechanical ventilation. N Engl J Med. 1998;338:791-797. Toàn văn Tóm lược
24. Donowitz GR, Mandell GL. Acute pneumonia. In: Mandell GL, Bennett JE, Dolin R, eds. Principles and practice of infectious diseases. 6th ed. Philadelphia, PA: Churchill Livingstone; 2005:819-845.
25. Hess DR. Patient positioning and ventilator-associated pneumonia. Respir Care. 2005;50:892-898. Tóm lược
26. Drakulovic MB, Torres A, Bauer TT, et al. Supine body position as a risk factor for nosocomial pneumonia in mechanically ventilated patients: a randomised trial. Lancet. 1999;354:1851-1858. Tóm lược
27. Niël-Weise BS, Gastmeier P, Kola A, et al. An evidence-based recommendation on bed head elevation for mechanically ventilated patients. Crit Care. 2011;15:R111. Toàn văn Tóm lược
28. Huang JC, Cao Y, Liao C, et al. Effect of histamine-2-receptor antagonists versus sucralfate on stress ulcer prophylaxis in mechanically ventilated patients: a meta-analysis of 10 randomized controlled trials. Crit Care. 2010;14:R194. Toàn văn Tóm lược
29. MacLaren R, Reynolds PM, Allen RR. Histamine-2 receptor antagonists vs proton pump inhibitors on gastrointestinal tract hemorrhage and infectious complications in the intensive care unit. JAMA Intern Med. 2014;174:564-574. Tóm lược
30. Schleder B, Stott K, Lloyd RC. The effect of a comprehensive oral care protocol on patients at risk for ventilator- associated pneumonia. Crit Care Nurse Clinic N Am. 2002;4:27-30.
31. Hua F, Xie H, Worthington HV, et al. Oral hygiene care for critically ill patients to prevent ventilator-associated pneumonia. Cochrane Database Syst Rev. 2016 Oct 25;10:CD008367. Toàn văn Tóm lược
32. Berry AM, Davidson PM, Masters J, et al. Systematic literature review of oral hygiene practices for intensive care patients receiving mechanical ventilation. Am J Crit Care. 2007;16:552-562. Tóm lược
33. DeRiso AJ 2nd, Ladowski JS, Dillon TA, et al. Chlorhexidine gluconate 0.12% oral rinse reduces the incidence of total nosocomial respiratory infection and nonprophylactic systemic antibiotic use in patients undergoing heart surgery. Chest. 1996;109:1556-1561. Toàn văn Tóm lược
34. Marelich GP, Murin S, Battistella F, et al. Protocol weaning of mechanical ventilation in medical and surgical patients by respiratory care practitioners and nurses: effect on weaning time and incidence of ventilator-associated pneumonia. Chest. 2000;118:459-467. Toàn văn Tóm lược
35. Kress JP, Pohlman AS, O’Connor MF, et al. Daily interruption of sedative infusions in critically ill patients undergoing mechanical ventilation. N Engl J Med. 2000;342:1471-1477. Toàn văn Tóm lược
36. Gao F, Yang LH, He HR, et al. The effect of reintubation on ventilator-associated pneumonia and mortality among mechanically ventilated patients with intubation: A systematic review and meta-analysis. Heart Lung. 2016 Jul- Aug;45(4):363-71. Tóm lược
37. Allegranzi B, Pittet D. Preventing infections acquired during health-care delivery. Lancet. 2008;372:1719-1720. Tóm lược
38. Boyce JM, Pittet D. Guideline for hand hygiene in health-care settings: recommendations of the Healthcare Infection Control Practices Advisory Committee and the HICPAC/SHEA/APIC/IDSA Hand Hygiene Task Force. MMWR Recomm Rep. 2002;51:1-44. Toàn văn Tóm lược
39. Burns KE, Meade MO, Premji A, et al. Noninvasive positive-pressure ventilation as a weaning strategy for intubated adults with respiratory failure. Cochrane Database Syst Rev. 2013;(12):CD004127. Toàn văn Tóm lược
40. Muscedere J, Rewa O, McKechnie K, et al. Subglottic secretion drainage for the prevention of ventilator-associated pneumonia: a systematic review and meta-analysis. Crit Care Med. 2011;39:1985-1991. Tóm lược
41. Han JN, Liu YP, Ma S, et al. Effects of decreasing the frequency of ventilator circuit changes to every 7 days on the rate of ventilator-associated pneumonia in a Beijing hospital. Respir Care. 2001;46:891-896. Tóm lược
42. Han J, Liu Y. Effect of ventilator circuit changes on ventilator-associated pneumonia: a systematic review and meta- analysis. Respir Care. 2010;55:467-474. Toàn văn Tóm lược
43. Panchabhai TS, Dangayach NS, Krishnan A, et al. Oropharyngeal cleansing with 0.2% chlorhexidine for prevention of nosocomial pneumonia in critically ill patients: an open-label randomized trial with 0.01% potassium permanganate as control. Chest. 2009;135:1150-1156. Toàn văn Tóm lược
44. Klompas M, Speck K, Howell MD, et al. Reappraisal of routine oral care with chlorhexidine gluconate for patients receiving mechanical ventilation: systematic review and meta-analysis. JAMA Intern Med. 2014;174:751-761. Tóm lược
45. Alexiou VG, Ierodiakonou V, Dimopoulos G, et al. Impact of patient position on the incidence of ventilator- associated pneumonia: a meta-analysis of randomized controlled trials. J Crit Care. 2009;24:515-522. Tóm lược
46. Kollef MH, Afessa B, Anzueto A, et al. Silver-coated endotracheal tubes and incidence of ventilator-associated pneumonia: the NASCENT randomized trial. JAMA. 2008;300:805-813. Toàn văn Tóm lược
47. Damas P, Frippiat F, Ancion A, et al. Prevention of ventilator-associated pneumonia and ventilator-associated conditions: a randomized controlled trial with subglottic secretion suctioning. Crit Care Med. 2015;43:22-30. Tóm lược
48. Lacherade JC, De Jonghe B, Guezennec P, et al. Intermittent subglottic secretion drainage and ventilator-associated pneumonia: a multicenter trial. Am J Respir Crit Care Med. 2010;182:910-917. Toàn văn Tóm lược
49. Gillies D, Todd DA, Foster JP, Batuwitage BT. Heat and moisture exchangers versus heated humidifiers for mechanically ventilated adults and children. Cochrane Database Syst Rev. 2017 Sep 14;9:CD004711. Toàn văn Tóm lược
50. Siempos II, Ntaidou TK, Falagas ME. Impact of the administration of probiotics on the incidence of ventilator- associated pneumonia: a meta-analysis of randomized controlled trials. Crit Care Med. 2010;38:954-962. Tóm lược
51. Canter RR, Harvey SE, Harrison DA, et al. Observational study of current use of selective decontamination of the digestive tract in UK Critical Care units. Br J Anaesth. 2014;113:610-617. Tóm lược
52. Li Z, Qi J, Zhao X, et al. Risk-Benefit Profile of Gastric vs Transpyloric Feeding in Mechanically Ventilated Patients: A Meta-Analysis. Nutr Clin Pract. 2016 Feb;31(1):91-8. Tóm lược
53. van Zanten AR, Brinkman S, Arbous MS, et al. Guideline bundles adherence and mortality in severe sepsis and septic shock. Crit Care Med. 2014;42:1890-1898. Tóm lược
54. Singh N, Rogers P, Atwood CW, et al. Short-course empiric antibiotic therapy for patients with pulmonary infiltrates in the intensive care unit: a proposed solution for indiscriminate antibiotic prescription. Am J Respir Crit Care Med. 2000;162:505-511. Toàn văn Tóm lược
55. Larsson J, Itenov TS, Bestle MH. Risk prediction models for mortality in patients with ventilator-associated pneumonia: A systematic review and meta-analysis. J Crit Care. 2017 Feb;37:112-118. Tóm lược
56. Torres A, Ewig S. Diagnosing ventilator-associated pneumonia. N Engl J Med. 2004;350:433-435. Tóm lược
57. Canadian Critical Care Trials Group. A randomized trial of diagnostic techniques for ventilator-associated pneumonia. N Engl J Med. 2006;355:2619-2630. Toàn văn Tóm lược
58. Schuetz P, Wirz Y, Sager R, et al. Procalcitonin to initiate or discontinue antibiotics in acute respiratory tract infections. Cochrane Database Syst Rev. 2017 Oct 12;10:CD007498. Toàn văn Tóm lược
59. Sahn SA. Diagnosis and management of parapneumonic effusions and empyema. Clin Infect Dis. 2007;45:1480-1486. Toàn văn Tóm lược
60. Ramirez P, Garcia MA, Ferrer M, et al. Sequential measurements of procalcitonin levels in diagnosing ventilator- associated pneumonia. Eur Respir J. 2008;31:356-362. Toàn văn Tóm lược
61. Clec’h C, Timsit JF, De Lassence A, et al. Efficacy of adequate early antibiotic therapy in ventilator-associated pneumonia: influence of disease severity. Intensive Care Med. 2004;30:1327-1333. Tóm lược
62. Muscedere JG, Shorr AF, Jiang X, et al. The adequacy of timely empiric antibiotic therapy for ventilator-associated pneumonia: an important determinant of outcome. J Crit Care. 2012;27:322. Tóm lược
63. Ibrahim EH, Sherman G, Ward S, et al. The influence of inadequate antimicrobial treatment of bloodstream infections on patient outcomes in the ICU setting. Chest. 2000;118:146-155. Toàn văn Tóm lược
64. Ibrahim EH, Ward S, Sherman G, et al. Experience with a clinical guideline for the treatment of ventilator- associated pneumonia. Crit Care Med. 2001;29:1109-1115. Tóm lược
65. Manzur A, Tubau F, Pujol M, et al. Nosocomial outbreak due to extended-spectrum-beta-lactamase- producing Enterobacter cloacae in a cardiothoracic intensive care unit. J Clin Microbiol. 2007;45:2365-2369. Toàn văn Tóm lược
66. Mentzelopoulos SD, Pratikaki M, Platsouka E, et al. Prolonged use of carbapenems and colistin predisposes to ventilator-associated pneumonia by pandrug-resistant Pseudomonas aeruginosa. Intensive Care Med. 2007;33:1524-1532. Tóm lược
67. Franzetti F, Antonelli M, Bassetti M, et al. Consensus document on controversial issues for the treatment of hospital-associated pneumonia. Int J Infect Dis. 2010;14 Suppl 4:S55-S65. Tóm lược
68. Heyland DK, Dodek P, Muscedere J, et al. Randomized trial of combination versus monotherapy for the empiric treatment of suspected ventilator-associated pneumonia. Crit Care Med. 2008;36:737-744. Tóm lược
69. Kim JW, Chung J, Choi SH, et al. Early use of imipenem/cilastatin and vancomycin followed by de-escalation versus conventional antimicrobials without de-escalation for patients with hospital-acquired pneumonia in a medical ICU: a randomized clinical trial. Crit Care. 2012;16:R28. Toàn văn Tóm lược
70. Kett DH, Cano E, Quartin AA, et al. Implementation of guidelines for management of possible multidrug-resistant pneumonia in intensive care: an observational, multicentre cohort study. Lancet Infect Dis. 2011;11:181-189. Tóm lược
71. Freire AT, Melnyk V, Kim MJ, et al. Comparison of tigecycline with imipenem/cilastatin for the treatment of hospital-acquired pneumonia. Diagn Microbiol Infect Dis. 2010;68:140-151. Tóm lược
72. McGovern PC, Wible M, El-Tahtawy A, et al. All-cause mortality imbalance in the tigecycline phase 3 and 4 clinical trials. Int J Antimicrob Agents. 2013 May;41(5):463-7. Tóm lược
73. Rubinstein E, Cammarata S, Oliphant T, et al. Linezolid (PNU-100766) versus vancomycin in the treatment of hospitalized patients with nosocomial pneumonia: a randomized, double-blind, multicenter study. Clin Infect Dis. 2001;32:402-412. Toàn văn Tóm lược
74. Wunderink RG, Cammarata SK, Oliphant TH. Continuation of a randomized, double-blind, multicenter study of linezolid versus vancomycin in the treatment of patients with nosocomial pneumonia. Clin Ther. 2003;25:980-992. Tóm lược
75. Kollef MH, Rello J, Cammarata SK, et al. Clinical cure and survival in Gram-positive ventilator-associated pneumonia: retrospective analysis of two double-blind studies comparing linezolid with vancomycin. Intensive Care Med. 2004;30:388-394. Tóm lược
76. Kalil AC, Murthy MH, Hermsen ED, et al. Linezolid versus vancomycin or teicoplanin for nosocomial pneumonia: a systematic review and meta-analysis. Crit Care Med. 2010;38:1802-1808. Tóm lược
77. Walkey AJ, O’Donnell MR, Wiener RS. Linezolid vs glycopeptide antibiotics for the treatment of suspected methicillin-resistant Staphylococcus aureus nosocomial pneumonia: a meta-analysis of randomized controlled trials. Chest. 2011;139:1148-1155. Tóm lược
78. Wunderink RG, Niederman MS, Kollef MH, et al. Linezolid in methicillin-resistant Staphylococcus aureus nosocomial pneumonia: a randomized, controlled study. Clin Infect Dis. 2012;54:621-629. Toàn văn Tóm lược
79. Hilf M, Yu VL, Sharp J, et al. Antibiotic therapy for Pseudomonas aeruginosa bacteremia: outcome correlations in a prospective study of 200 patients. Am J Med. 1989;87:540-546. Tóm lược
80. Fartoukh M, Maître B, Honoré S, et al. Diagnosing pneumonia during mechanical ventilation: the clinical pulmonary infection score revisited. Am J Respir Crit Care Med. 2003;168:173-179. Toàn văn Tóm lược
81. Trouillet JL, Vuagnat A, Combes A, et al. Pseudomonas aeruginosa ventilator-associated pneumonia: comparison of episodes due to piperacillin-resistant versus piperacillin-susceptible organisms. Clin Infect Dis. 2002;34:1047-1054. Toàn văn Tóm lược
82. Torres A, Zhong N, Pachl J, et al. Ceftazidime-avibactam versus meropenem in nosocomial pneumonia, including ventilator-associated pneumonia (REPROVE): a randomised, double-blind, phase 3 non-inferiority trial. Lancet Infect Dis. 2018 Mar;18(3):285-295. Tóm lược
83. Garnacho-Montero J, Sa-Borges M, Sole-Violan J, et al. Optimal management therapy for Pseudomonas aeruginosa ventilator-associated pneumonia: an observational, multicenter study comparing monotherapy with combination antibiotic therapy. Crit Care Med. 2007;35:1888-1895. Tóm lược
84. Paul M, Benuri-Silbiger I, Soares-Weiser K, et al. Beta lactam monotherapy versus beta lactam-aminoglycoside combination therapy for sepsis in immunocompetent patients: systematic review and metaanalysis of randomised trials. BMJ. 2004;328:668. Toàn văn Tóm lược
85. Cometta A, Baumgartner JD, Lew D, et al. Prospective randomized comparison of imipenem monotherapy with imipenem plus netilmicin for treatment of severe infections in nonneutropenic patients. Antimicrob Agents Chemother. 1994;38:1309-1313. Toàn văn Tóm lược
86. Shan J, Chen HL, Zhu JH. Diagnostic accuracy of clinical pulmonary infection score for ventilator-associated pneumonia: a meta-analysis. Respir Care. 2011;56:1087-1094. Toàn văn Tóm lược
87. Chastre J, Wolff M, Fagon JY, et al; PneumA Trial Group. Comparison of 8 vs 15 days of antibiotic therapy for ventilator-associated pneumonia in adults: a randomized trial. JAMA. 2003;290:2588-2598. Toàn văn Tóm lược
88. Pugh R, Grant C, Cooke RP, et al. Short-course versus prolonged-course antibiotic therapy for hospital-acquired pneumonia in critically ill adults. Cochrane Database Syst Rev. 2015;(8):CD007577. Toàn văn Tóm lược
89. Dimopoulos G, Poulakou G, Pneumatikos IA, et al. Short- vs long-duration antibiotic regimens for ventilator- associated pneumonia: a systematic review and meta-analysis. Chest. 2013;144:1759-1767. Toàn văn Tóm lược
90. Centers for Disease Control and Prevention. Antibiotic Prescribing and Use in Hospitals and Long-Term care. December 2017 [internet publication] Toàn văn
91. Meduri GU, Mauldin GL, Wunderink RG, et al. Causes of fever and pulmonary densities in patients with clinical manifestations of ventilator-associated pneumonia. Chest. 1994;106:221-235. Toàn văn Tóm lược
92. Colquhoun MC, Handley A, Evans TR (eds). ABC of resuscitation. 5th ed. London: BMJ Books; 2003.
93. Soar J, Nolan JP, Böttiger BW, et al. European Resuscitation Council guidelines for resuscitation 2015. Section 3: adult advanced life support. Resuscitation. 2015;95:100-147.
94. Resuscitation Council UK. Resuscitation guidelines. Chapter 7: adult advanced life support. 2015. https:// www.resus.org.uk (last accessed 27 October 2017). Toàn văn
95. Soar J, Nolan JP, Böttiger BW, et al; Adult advanced life support section collaborators. European Resuscitation Council Guidelines for resuscitation 2015: section 3. Adult advanced life support. Resuscitation. 2015 Oct;95:100-47.
96. Colquhoun MC, Handley AJ, Evans TR, eds. ABC of resuscitation. 5th ed. Wiley-Blackwell; 2003.
97. Soar J, Nolan JP, Böttiger BW, et al. European Resuscitation Council guidelines for resuscitation 2015: Section 3. Adult advanced life support. Resuscitation. 2015;95:100-147.
98. Seppä Y, Bloigu A, Honkanen PO, et al. Severity assessment of lower respiratory tract infection in elderly patients in primary care. Arch Intern Med. 2001;161:2709-2713. Toàn văn Tóm lược
99. Chastre J, Fagon JY. Ventilator-associated pneumonia. Am J Respir Crit Care Med. 2002;165:867-903. Toàn văn Tóm lược
100. Kollef MH, Chastre J, Clavel M, et al. A randomized trial of 7-day doripenem versus 10-day imipenem-cilastatin for ventilator-associated pneumonia. Crit Care. 2012;16:R218. Toàn văn Tóm lược
101. Rubinstein E, Lalani T, Corey GR, et al. Telavancin versus vancomycin for hospital-acquired pneumonia due to gram-positive pathogens. Clin Infect Dis. 2011;52:31-40. Toàn văn Tóm lược
102. Palmer LB, Smaldone GC, Chen JJ, et al. Aerosolized antibiotics and ventilator-associated tracheobronchitis in the intensive care unit. Crit Care Med. 2008;36:2008-2013. Tóm lược
103. Falagas ME, Agrafiotis M, Athanassa Z, et al. Administration of antibiotics via the respiratory tract as monotherapy for pneumonia. Expert Rev Anti Infect Ther. 2008;6:447-452. Tóm lược
104. Le J, Ashley ED, Neuhauser MM, et al. Consensus summary of aerosolized antimicrobial agents: application of guideline criteria. Insights from the Society of Infectious Diseases Pharmacists. Pharmacotherapy. 2010;30:562-584. Tóm lược
105. Karvouniaris M, Makris D, Zygoulis P, et al. Nebulised colistin for ventilator-associated pneumonia prevention. Eur Respir J. 2015;46:1732-1739. Tóm lược
106. Huang D, Wilcox M, Hadvary P, et al. Randomized, double-blind, multicenter phase 2 study to evaluate efficacy and safety of intravenous iclaprim (ICL) versus vancomycin in the treatment of hospital-acquired, ventilator-associated, or health-care-associated pneumonia suspected or confirmed caused by gram-positive pathogens. Poster abstract 891. IDWeek, San Diego, CA; 2015. Toàn văn
107. Liapikou A, Torres A. Emerging drugs for nosocomial pneumonia. Expert Opin Emerg Drugs. 2016 Sep;21(3):331-41. Tóm lược
108. Cook DJ, Walter SD, Cook RJ, et al. Incidence of and risk factors for ventilator-associated pneumonia in critically ill patients. Ann Intern Med. 1998;129:433-440. Tóm lược
109. Trouillet JL, Chastre J, Vuagnat A, et al. Ventilator-associated pneumonia caused by potentially drug-resistant bacteria. Am J Respir Crit Care Med. 1998;157:531-539. Toàn văn Tóm lược
110. Westendorp WF, Vermeij JD, Zock E, et al; PASS investigators. The Preventive Antibiotics in Stroke Study (PASS): a pragmatic randomised open-label masked endpoint clinical trial. Lancet. 2015;385:1519-1526. Tóm lược
111. Aridis Pharmaceuticals, Inc. Aridis Pharmaceuticals reports positive phase 1 clinical results for Aerucin® for treating hospital-acquired and ventilator-associated pneumonia. January 2016. http://www.aridispharma.com/ (last accessed 2 September 2016). Toàn văn
112. Terragni PP, Antonelli M, Fumagalli R, et al. Early vs late tracheotomy for prevention of pneumonia in mechanically ventilated adult ICU patients: a randomized controlled trial. JAMA. 2010;303:1483-1489. Toàn văn Tóm lược
113. Meng L, Wang C, Li J, Zhang J. Early vs late tracheostomy in critically ill patients: a systematic review and meta- analysis. Clin Respir J. 2016 Nov;10(6):684-692. Tóm lược
114. Cheung N, Betro G, Luckianow G, et al. Endotracheal intubation: the role of sterility. Surg Infect (Larchmt). 2007;8:545-552. Tóm lược
115. Noll DR, Degenhardt BF, Morley TF, et al. Efficacy of osteopathic manipulation as an adjunctive treatment for hospitalized patients with pneumonia: a randomized controlled trial. Osteopath Med Prim Care. 2010;4:2. Toàn văn Tóm lược
116. Knight DJ, Gardiner D, Banks A, et al. Effect of synbiotic therapy on the incidence of ventilator associated pneumonia in critically ill patients: a randomised, double-blind, placebo-controlled trial. Intensive Care Med. 2009;35:854-861. Tóm lược
117. Morrow LE, Kollef MH, Casale TB. Probiotic prophylaxis of ventilator-associated pneumonia: a blinded, randomized, controlled trial. Am J Respir Crit Care Med. 2010;182:1058-1064. Tóm lược
118. Petrof EO, Dhaliwal R, Manzanares W, et al. Probiotics in the critically ill: a systematic review of the randomized trial evidence. Crit Care Med. 2012;40:3290-3302. Tóm lược
119. Gu WJ, Wei CY, Yin RX. Lack of efficacy of probiotics in preventing ventilator-associated pneumonia: a systematic review and meta-analysis of randomized controlled trials. Chest. 2012;142:859-868. Toàn văn Tóm lược
120. Gu WJ, Deng T, Gong YZ, et al. The effects of probiotics in early enteral nutrition on the outcomes of trauma: a meta-analysis of randomized controlled trials. JPEN J Parenter Enteral Nutr. 2013;37:310-317. Tóm lược
121. Tsaganos T, Raftogiannis M, Pratikaki M, Cet al. Clarithromycin Leads to Long-Term Survival and Cost Benefit in Ventilator-Associated Pneumonia and Sepsis. Antimicrob Agents Chemother. 2016 May 23;60(6):3640-6. Toàn văn Tóm lược
122. Schieren M, Piekarski F, Dusse F, et al. Continuous lateral rotational therapy in trauma-A systematic review and meta-analysis. J Trauma Acute Care Surg. 2017 Nov;83(5):926-933. Tóm lược
123. Strange C, Sahn SA. The definitions and epidemiology of pleural space infection. Semin Respir Infect. 1999;45:1480-1486. Tóm lược
124. Colice GL, Curtis A, Deslauriers J, et al. Medical and surgical treatment of parapneumonic effusions: an evidence- based guideline. Chest. 2000;118:1158-1171. [Erratum in: Chest. 2001;119:319.] Toàn văn Tóm lược
125. Rhodes A, Evans LE, Alhazzani W, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med. 2017 Mar;43(3):304-377. Toàn văn Tóm lược
126. Centers for Disease Control and Prevention. Influenza Vaccination Information for Health Care Workers. October 2017. [internet publication] Toàn văn
127. Centers for Disease Control and Prevention. Pneumococcal polysaccharide vaccine information statement. April 2015. http://www.cdc.gov/ (last accessed 2 September 2016).