Sorafenib
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
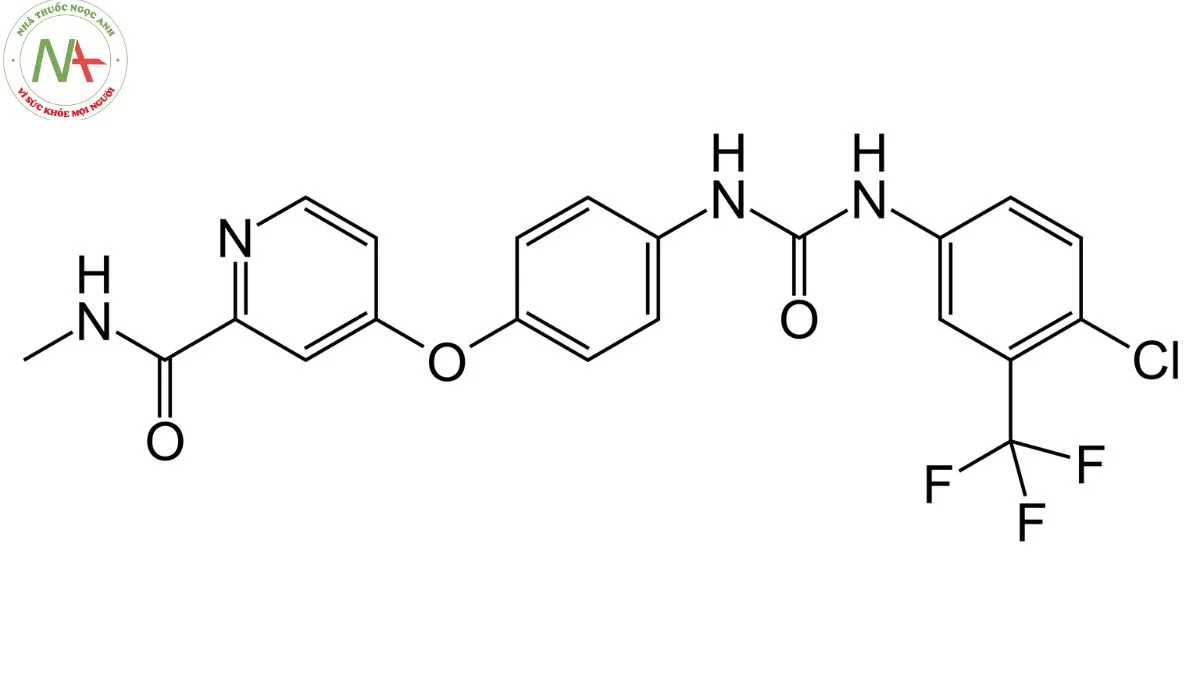
4-[4-[[4-chloro-3-(trifluoromethyl)phenyl]carbamoylamino]phenoxy]-N-methylpyridine-2-carboxamide
Nhóm thuốc
Thuốc chống ung thư – ức chế tyrosine kinase.
Mã ATC
L – Chất chống ung thư và điều hòa miễn dịch
L01 – Thuốc chống ung thư
L01E – Chất ức chế protein kinase
L01EX – Chất ức chế protein kinase khác
L01EX02 – Sorafenib
Mã UNII
9ZOQ3TZI87
Mã CAS
284461-73-0
Cấu trúc phân tử
Công thức phân tử
C21H16ClF3N4O3
Phân tử lượng
464.8 g/mol
Cấu trúc phân tử
Sorafenib là một dẫn xuất của nhóm phenylureas là urê, trong đó một trong các nitơ được thay thế bằng nhóm 4-chloro-3-trifluorophenyl trong khi nhóm còn lại được thay thế bằng nhóm phenyl, do đó, được thay thế ở vị trí para bởi nhóm oxy [2-(metylcarbamoyl)pyridin-4-yl]oxy. Nó là một pyridincarboxamit, một dẫn xuất của monochlorobenzen, một ete thơm, một dẫn xuất của benzen (trifluoromethyl) và một dẫn xuất của phenylureas.
Các tính chất phân tử
Số liên kết hydro cho: 3
Số liên kết hydro nhận: 7
Số liên kết có thể xoay: 5
Diện tích bề mặt tôpô: 92.4Ų
Số lượng nguyên tử nặng: 32
Các tính chất đặc trưng
Điểm nóng chảy: 205.6 °C
Điểm sôi: 523.3±50.0 °C ở 760 mmHg
Tỷ trọng riêng: 1.5±0.1 g/cm3
Độ tan trong nước: < 0.01 g/L
Hằng số phân ly pKa: 3.03
Chu kì bán hủy: 25 – 48 giờ
Khả năng liên kết với Protein huyết tương: 99,5%
Dạng bào chế
Viên nén Sorafenib tablets ip: 200 mg

Độ ổn định và điều kiện bảo quản
Sorafenib, như nhiều thuốc khác, có thể bị mất hiệu quả hoặc bị hỏng nếu không được bảo quản đúng cách. Độ ổn định của Sorafenib phụ thuộc vào nhiều yếu tố như dạng bào chế (ví dụ: viên nén, dạng lỏng), quá trình sản xuất, và thành phần tá dược.
Theo hướng dẫn của nhà sản xuất, Sorafenib thường được khuyến nghị bảo quản ở nhiệt độ phòng (khoảng 20-25°C). Nên bảo quản thuốc ở nơi khô ráo và tránh ánh sáng trực tiếp. Tránh để thuốc ở nơi có độ ẩm cao như phòng tắm. Đậy kín hộp thuốc sau khi sử dụng.
Nguồn gốc
Sorafenib là gì? Sorafenib đã nhận được sự chấp thuận từ Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) vào tháng 12 năm 2005, cùng với Ủy ban Châu Âu vào tháng 7 năm 2006 cho việc điều trị ung thư thận tiến triển. Vào tháng 10 năm 2007, Ủy ban Châu Âu mở rộng sự ủy quyền của mình cho việc điều trị ung thư biểu mô tế bào gan (HCC) – dạng ung thư gan phổ biến nhất, và ngay sau đó vào tháng 11, FDA cũng đồng lòng.
Tuy nhiên, vào tháng 11 năm 2009, Sorafenib không được phê duyệt cho việc sử dụng ở Anh, Wales và Bắc Ireland. Lý do nêu ra là hiệu quả của thuốc (gia tăng tỷ lệ sống sót thêm 6 tháng cho bệnh nhân ung thư gan) không xứng đáng với chi phí cao lên tới £3000 cho mỗi bệnh nhân hàng tháng. Tại Scotland, Hiệp hội Thuốc Scotland cũng từ chối cấp phép thuốc này với lý do tương tự.
Vào tháng 3 năm 2012, khi Văn phòng Bằng sáng chế Ấn Độ đã đồng ý ủy quyền cho Natco Pharma, một công ty trong nước, sản xuất phiên bản generic của Sorafenib, giảm giá thuốc này xuống 97%. Trong khi Bayer định giá mỗi lô thuốc (120 viên Nexavar) là ₹280.000 (3.500 USD), Natco Pharma cung cấp cùng số lượng chỉ với giá ₹8.800 (110 USD) và đồng thời chi trả 7% tiền bản quyền cho Bayer.
Dược lý và cơ chế hoạt động
Sorafenib hoạt động như một tác nhân “diệt tế bào khối u” in vitro, giảm tiến trình tăng sinh và phát triển khối u. Khi thử nghiệm trên chuột có hệ miễn dịch yếu, thuốc này cản trở sự mọc của xenograft khối u từ người và đồng thời giảm việc hình thành mạch máu cho khối u. Quá trình tự tiêu hủy khối u cũng được tăng cường, đặc biệt trong các mô hình ung thư gan, thận và tuyến giáp. Một số thí nghiệm cho thấy sorafenib còn kích hoạt quá trình apoptosis trong nhiều loại tế bào khối u, dù có sự biến đổi giữa các dòng tế bào.
Được biết đến với khả năng ức chế các enzyme kinase liên quan đến sự phát triển của khối u, Sorafenib tập trung vào nhiều kinase nội bào, đặc biệt trong con đường truyền tín hiệu của protein kinase MAPK. Nó cản trở hoạt động của nhiều kinase Raf và thụ thể tyrosine kinase trên bề mặt tế bào, như KIT, FLT-3, RET và các thụ thể VEGFR và PDGFR.
Nhìn chung, Sorafenib hoạt động theo cơ chế kép. Nó can thiệp vào sự tăng sinh và phát triển của tế bào khối u bằng cách tác động lên con đường RAF/MEK/ERK, và cũng giảm việc hình thành mạch máu của khối u bằng cách ức chế tín hiệu từ VEGFR và PDGFR.
Ứng dụng trong y học
Trong lĩnh vực y học, Sorafenib đóng vai trò quan trọng trong việc điều trị các loại ung thư như ung thư biểu mô tế bào thận tiến triển (RCC), ung thư biểu mô tế bào gan không khả thi để phẫu thuật (HCC) và ung thư tuyến giáp.
Ung thư thận
Đối với ung thư thận, dữ liệu từ thử nghiệm lâm sàng công bố vào tháng 1 năm 2007 cho thấy Sorafenib đã tạo ra sự cải thiện đáng chú ý. So với nhóm dùng giả dược, những bệnh nhân sử dụng Sorafenib đã trải qua một giai đoạn dài hơn không có dấu hiệu tiến triển bệnh sau khi các phương pháp điều trị trước đó không mang lại hiệu quả.
Cụ thể, nhóm được điều trị bằng Sorafenib có thời gian sống trung bình không bị tiến triển bệnh là 5,5 tháng, trong khi con số này chỉ là 2,8 tháng ở nhóm dùng giả dược (tỷ lệ rủi ro về tiến triển bệnh ở nhóm sorafenib là 0,44 với khoảng tin cậy 95% từ 0,35 đến 0,55; P<0,01).
Ở Úc, dù Sorafenib được TGA chấp thuận cho việc điều trị ung thư thận, thuốc này lại không có mặt trong danh sách của Chương trình Phúc lợi Dược phẩm cho chỉ định này.
Ung thư gan
Tại Hội nghị ASCO 2007, dữ liệu từ thử nghiệm SHARP đã lên tiếng về sự hiệu quả của Sorafenib điều trị ung thư gan. Nhìn chung, bệnh nhân dùng Sorafenib đã trải qua một giai đoạn dài hơn với sự cải thiện 44% so với nhóm dùng giả dược.
Cả thời gian sống sót trung bình và thời gian trì hoãn sự tiến triển bệnh đều được nâng cao sau 3 tháng. Tuy nhiên, chất lượng cuộc sống của bệnh nhân không thấy sự khác biệt, có thể là do tác dụng phụ của Sorafenib hoặc triệu chứng liên quan đến bệnh gan. Dựa vào kết quả này, FDA đã chấp thuận Sorafenib cho việc điều trị ung thư biểu mô tế bào gan vào tháng 11 năm 2007.
Một thử nghiệm khác đã kết hợp Sorafenib với doxorubicin và kết quả cho thấy thời gian sống sót tổng thể trung bình và thời gian không tiến triển bệnh đều dài hơn khi sử dụng cả hai loại thuốc so với chỉ dùng doxorubicin.
Một nghiên cứu sorafenib khác cho thấy sự kết hợp giữa Sorafenib và DEB-TACE được bệnh nhân dung nạp tốt và an toàn, với hầu hết các tác dụng phụ liên quan đến Sorafenib.
Ở Úc, Sorafenib đã được liệt kê trong PBS, nhờ đó bệnh nhân có thể nhận sự hỗ trợ từ chính phủ khi mua thuốc. Đây cũng là chỉ định duy nhất được chấp thuận bởi TGA ở Úc cho Sorafenib, cùng với ung thư biểu mô tế bào thận.
Ung thư tuyến giáp
Ngày 22 tháng 11 năm 2013, Sorafenib đã nhận được sự chấp thuận từ FDA để điều trị ung thư tuyến giáp biệt hóa tiến triển hoặc tái phát cục bộ, đặc biệt ở trường hợp đã trải qua liệu pháp iốt phóng xạ.
Dựa trên thử nghiệm DECISION giai đoạn III, Sorafenib cho thấy một sự gia tăng đáng chú ý trong thời gian sống sót mà không có dấu hiệu tiến triển bệnh, mặc dù không có sự cải thiện rõ ràng về tỷ lệ sống sót tổng thể. Tuy nhiên, điều đáng lưu ý là các tác dụng phụ thường xuất hiện, trong đó phản ứng da ở vùng tay và chân nổi bật hơn cả.
Dược động học
Hấp thu
Khi sử dụng liều thuốc kéo dài trong 7 ngày, có sự tích tụ từ 2,5 đến 7 lần so với việc dùng liều đơn. Trạng thái ổn định về nồng độ thuốc được đạt sau khoảng 7 ngày. Cmax và AUC tăng không đáng kể khi tăng liều lên hơn 400 mg mỗi lần, hai lần mỗi ngày. Thời gian đạt nồng độ tối đa (Tmax) là khoảng 3 giờ. Dùng viên sorafenib, sinh khả dụng trung bình nằm trong khoảng 38-49%. Việc tiêu thụ một bữa ăn giàu chất béo có thể làm giảm khả dụng sinh học xuống 29%.
Phân bố
Sorafenib phân bố rộng khắp cơ thể, cho thấy nó có khả năng tích tụ trong mô mỡ. Thuốc này liên kết chặt chẽ với protein huyết tương, lên tới 99,5%.
Chuyển hóa
Sorafenib chủ yếu được chuyển hóa trong gan. Thuốc này trải qua quá trình oxy hóa do CYP3A4 và glucuronid hóa do UGT1A9. Trong huyết tương, Sorafenib chiếm từ 70-85% tổng chất. Có tám chất chuyển hóa của Sorafenib đã được biết đến, và chất chuyển hóa chính có hiệu lực in vitro tương tự Sorafenib.
Thải trừ
Sau khi dùng một liều 100 mg dạng dung dịch của Sorafenib, 96% liều thuốc được tìm thấy sau 14 ngày. Trong đó, 77% được thải qua phân và 19% thông qua nước tiểu dưới dạng chất chuyển hóa glucuronid. Thời gian bán rã của Sorafenib là từ 25 – 48 giờ.
Độc tính ở người
Liều Sorafenib cao nhất đã được thử nghiệm trong điều kiện lâm sàng là 800 mg hai lần mỗi ngày. Tại liều này, các tác dụng phụ thường gặp nhất là tiêu chảy và biến chứng liên quan đến da. Ở động vật, không rõ ràng các triệu chứng của việc quá liều cấp tính, bởi việc hấp thu thuốc có xu hướng bão hòa trong các nghiên cứu độc tính.
Tính an toàn
Sorafenib nên được cân nhắc sử dụng kỹ lưỡng trong quá trình mang thai. Lợi ích cho người mẹ và nguy cơ đối với thai nhi cần được xem xét cẩn trọng. Đối với phụ nữ có khả năng mang thai, việc sử dụng các biện pháp tránh thai hiệu quả trong suốt quá trình điều trị là cần thiết.
Không có thông tin chính xác về việc dùng Sorafenib trong giai đoạn cho con bú. Mặc dù Sorafenib chủ yếu liên kết với protein huyết tương, việc nó xuất hiện trong sữa mẹ có thể là rất ít. Tuy nhiên, do thời gian bán rã kéo dài từ 25 đến 48 giờ và khả năng tích tụ, việc sử dụng thuốc có thể ảnh hưởng tới trẻ sơ sinh. Nhà sản xuất khuyến nghị mẹ nên ngừng cho con bú trong thời gian dùng thuốc và ít nhất là 2 tuần sau khi kết thúc liệu pháp.
Tương tác với thuốc khác
Sorafenib có khả năng tương tác với các thuốc được chuyển hóa hoặc thải trừ chủ yếu thông qua con đường UGT1A1 hoặc UGT1A9. Ví dụ, việc sử dụng đồng thời với irinotecan có thể tăng nồng độ của irinotecan và chất chuyển hóa hoạt động của nó, SN-38.
Khi kết hợp với docetaxel, Sorafenib có thể làm tăng nồng độ đỉnh và AUC của docetaxel.
Việc dùng đồng thời Sorafenib với neomycin hay các loại kháng sinh khác có thể gây ảnh hưởng đến cân bằng vi sinh đường tiêu hóa, dẫn đến việc giảm khả dụng của Sorafenib. Trước khi bắt đầu liệu pháp kháng sinh, nên cân nhắc việc giảm nồng độ Sorafenib trong máu.
Đối với thuốc chống co giật như carbamazepine, phenobarbital, phenytoin và dextromethorphan, cũng như St. John’s wort (Hypericum perforatum), cần tránh dùng đồng thời với Sorafenib vì có khả năng giảm nồng độ Sorafenib trong huyết tương.
Lưu ý khi sử dụng Sorafenib
Phản ứng phổ biến nhất khi dùng Sorafenib là việc bị kích ứng da ở lòng bàn tay và sự xuất hiện của phát ban. Để kiểm soát, có thể sử dụng các biện pháp điều trị tại chỗ, điều chỉnh liều lượng hoặc ngừng thuốc tạm thời, hoặc ngừng vĩnh viễn ở trường hợp nặng.
Tăng huyết áp thường xảy ra ở mức độ nhẹ và có thể được điều trị bằng thuốc hạ huyết áp thông thường. Tuy nhiên, nếu tình trạng này trở nên nghiêm trọng, cân nhắc việc ngừng sử dụng thuốc.
Việc sử dụng các thuốc ức chế con đường VEGF có thể tăng nguy cơ xuất hiện túi phình hoặc bóc tách động mạch.
Một số trường hợp mất ý thức đã được ghi nhận khi sử dụng Sorafenib. Trong trường hợp này, nên tạm dừng việc sử dụng thuốc.
Tăng nguy cơ chảy máu là một hiện tượng có thể xảy ra khi dùng thuốc. Nếu chảy máu cần can thiệp y tế, nên xem xét việc ngừng sử dụng thuốc.
Sử dụng Sorafenib cần cẩn trọng ở bệnh nhân có nguy cơ kéo dài QTc, chẳng hạn như bệnh nhân mắc hội chứng QT dài bẩm sinh hoặc những người đang dùng thuốc chống loạn nhịp tim.
Thủng đường tiêu hóa là hiện tượng ít gặp nhưng cần phải ngừng điều trị nếu xảy ra.
Do Sorafenib chủ yếu được thải qua gan, bệnh nhân có tình trạng suy gan nên sử dụng thuốc với sự cảnh giác.
Bệnh nhân dùng warfarin hoặc phenprocoumon cần được theo dõi chặt chẽ về thời gian prothrombin và INR.
Khi bệnh nhân chuẩn bị phẫu thuật lớn, nên tạm ngừng sử dụng Sorafenib. Quyết định tiếp tục sử dụng thuốc sau phẫu thuật dựa trên sự đánh giá vết thương đã lành.
Một vài nghiên cứu của Sorafenib trong Y học
Hiệu quả so sánh của các chiến lược kết hợp mới đối với ung thư biểu mô tế bào gan không thể cắt bỏ: Phân tích mạng lưới các thử nghiệm giai đoạn III
Bối cảnh: Sự ức chế quá trình chết tế bào-1 theo chương trình kép và sự ức chế con đường yếu tố tăng trưởng nội mô mạch máu là tiêu chuẩn mới trong chăm sóc cho bệnh nhân ung thư biểu mô tế bào gan không thể cắt bỏ. Thiếu sự so sánh trực tiếp giữa các phương pháp điều trị đầu tay.
Phương pháp: Chúng tôi đã tiến hành tìm kiếm tài liệu trong MEDLINE (https://pubmed.ncbi.nlm.nih.gov), thư viện Cochrane (https://www.cochranelibrary.com) và Embase (www.embase.com) từ tháng 1 Năm 2007 và tháng 2 năm 2022.
Chúng tôi đã đưa vào các thử nghiệm ngẫu nhiên có đối chứng giai đoạn III nhằm thử nghiệm các chất ức chế điểm kiểm soát miễn dịch hoặc chất ức chế tyrosine kinase, bao gồm sorafenib, lenvatinib và donafenib, đồng thời được đánh giá là tỷ lệ sống sót tổng thể ở điểm cuối chính (OS) hoặc tỷ lệ sống sót không tiến triển (PFS).
Các nghiên cứu thử nghiệm liệu pháp điều trị tại chỗ đã bị loại trừ. Điểm cuối chính là so sánh hiệu quả của các lựa chọn hàng đầu về OS và PFS. Chúng tôi đã trích xuất Tỷ lệ rủi ro (HR) và khoảng tin cậy 95% (KTC 95%) cho OS và PFS, đồng thời thực hiện phân tích tổng hợp mạng thường xuyên với các mô hình hồi quy tổng hợp đa biến có hiệu ứng cố định.
Quy trình nghiên cứu đã được đăng ký tại PROSPERO, một cơ quan đăng ký triển vọng quốc tế về các đánh giá hệ thống (mã đăng ký CRD42022312489).
Kết quả: Đánh giá tài liệu mang lại 13709 kết quả, sau khi loại bỏ các bản sao và loại trừ các nghiên cứu không liên quan, 70 bài báo đã có sẵn để sàng lọc. Sau khi xem xét toàn văn, 9 nghiên cứu đủ điều kiện để phân tích.
Atezolizumab cộng với bevacizumab làm giảm nguy cơ tử vong so với giả dược (HR 0·40; 95% CI 0·28-0·57), sorafenib (HR 0·58; 95% CI 0·42-0·80), lenvatinib ( HR 0·63; 95% CI 0·44-0·89), atezolizumab cộng với cabozantinib (HR 0·64; 95% CI 0·43-0·97), nivolumab (HR 0·68; 95% CI 0· 48-0·98) và donafenib (HR 0·69; KTC 95% 0·48-0·99).
Atezolizumab cộng với bevacizumab không vượt trội về mặt thống kê so với durvalumab cộng với tremelimumab (HR 0·74; 95% CI 0·52-1·06) và sintilimab cộng với IBI305 (HR 1·02; 95% CI 0·67-1·55) ở giảm nguy cơ tử vong. Hiệu quả có liên quan đến nguy cơ xảy ra các tác dụng phụ cấp độ 3 cao hơn.
Tài liệu tham khảo
- Drugbank, Sorafenib, truy cập ngày 25 tháng 9 năm 2023.
- Fulgenzi, C. A. M., D’Alessio, A., Airoldi, C., Scotti, L., Demirtas, C. O., Gennari, A., Cortellini, A., & Pinato, D. J. (2022). Comparative efficacy of novel combination strategies for unresectable hepatocellular carcinoma: A network metanalysis of phase III trials. European journal of cancer (Oxford, England : 1990), 174, 57–67. https://doi.org/10.1016/j.ejca.2022.06.058
- Pubchem, Sorafenib, truy cập ngày 25 tháng 9 năm 2023.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội